基于生物信息学探讨丹参酮ⅡA治疗溃疡性结肠炎及其机制
2021-12-15吴小倩黄伟芳孔德松周伟康樊志敏
吴小倩,黄伟芳,孔德松,周伟康,樊志敏
(1.南京中医药大学医学院,整合医学学院,江苏 南京 210023;2.南京中医药大学附属南京市中医院中医药现代化与大数据研究中心,3.南京中医药大学附属南京市中医院肛肠科,江苏 南京 210001)
溃疡性结肠炎(ulcerative colitis,UC)最早出现于19世纪中期,是一种病因尚不明确的肠道的非特异性慢性炎症病,其病程漫长且反复发作,严重影响着人们的生活质量[1]。目前对其仍没有有效的治疗手段,逐年上升的发病率和高达50%死亡率,让其成为消化系统的主要疾病之一。已有很多研究指出,炎症是肠道疾病诱发的基础,如:炎性肠病、肠易激综合征、结直肠癌等[2]。结肠黏膜屏障的受损、肠道菌群失调与炎症方面之间也是相互作用的,肠黏膜屏障的破坏可导致微生物易位,诱发炎症。肠道稳态的破坏,又会导致不可控的肠黏膜反应,诱发细胞因子与氧自由基释放,引发炎性因子风暴[3]。因此,维护机体内炎症因子的平衡状态,阻断级联放大的炎症反应是防治肠道疾病的重要策略。
丹参SalviamiltiorrhizaBge是传统中药,唇形科植物丹参的根及根茎,具有活血调经、祛瘀止痛、清心除烦、凉血消痈等功效。在临床研究中,丹参因其茎叶中丰富的酚酸类成分与丹参酮类成分已被证实具有抗炎作用[4]。丹参酮ⅡA(tanshinone ⅡA,Tan ⅡA)在丹参中含量较高,是其主要有效成分之一,具有较强的生理活性和药理作用,具有天然抗氧化、抗肿瘤、抗炎除菌和神经保护等作用[5-6]。但是,目前对Tan ⅡA治疗UC的作用机制研究较少,有待进一步深入探究。考虑到中药成分与其功能的复杂性,生物信息学为其确定靶标和靶点提供了便捷。故本文先通过生物信息学,在分子的水平上,从靶点和信号传导通路预测治疗UC的可能性作用机制,再通过建立DSS小鼠模型,研究Tan ⅡA对UC的治疗作用及其作用机制,为Tan ⅡA用于UC的临床治疗提供实验依据。
1 材料与方法
1.1 实验动物50只C57BL/6J小鼠(20±2)g,雄性,SPF级,购于江苏省南京市江宁区青龙山动物繁殖中心(6-8周),许可证号:SCXK(苏)2017-0001。饲养于南京中医药大学动物实验中心,温度(20-25)℃,湿度40%左右,每12 h明暗交替循环饲养。所有动物实验按照南京中医药大学动物伦理委员会相关规定执行。
1.2 药物与试剂丹参酮ⅡA(纯度98%,上海纯优,货号:P0019);葡聚糖硫酸钠(MW:36000-50000,MP Biomedicals,货号:216011050);粪便隐血试剂定性检测试剂盒(雷根生物,货号:TC0511);ELISA试剂盒:TNF-α、IL-1β、IL-6(金霖生物科技发展有限公司,货号:JL30030、JL30027、JL30044);Abcam公司:兔多克隆抗体COX2(货号:ab41762);兔多克隆抗体INOS(货号:ab15323);兔多克隆抗体TNF-α(货号:ab66579);兔抗PPARγ多克隆抗体(货号:ab41762);兔抗p-IκBa单克隆抗体(货号:ab32518);鼠抗△9 dehydrogenase单克隆抗体(货号:ab110330);甲醛溶液、羧甲基纤维素钠(CMC-Na)、0.9%氯化钠注射液(国药集团化学试剂有限公司)。
1.3 仪器电子天平(上海佑科公司)、显微镜及图像分析系统(德国徕卡公司)、手动切片机(美国Thermo公司)、包埋机(美国Thermo公司)、电泳仪(北京六一生物科技有限公司)、低温高速离心机(美国Sigma公司)、全波长酶标仪(美国Thermo公司)、-80 ℃超低温冰箱(美国Thermo公司)、JJ-2B匀浆机(金坛市环宇科学仪器厂)、电热恒温水槽(上海锐析仪器设备有限公司)、Leica ASP300S全自动真空组织脱水机。
1.4 生物信息学分析
1.4.1人群验证 运用GEO数据库中的GSE95095数据集,下载UC基因组数据。24个患者的炎症位置的肠道组织以及非炎症的肠道组织,组成一一配对的48个肠道组织标本,然后进行差异基因表达强度检测,筛选在组织中的差异性表达基因。再使用Limma线性拟合方式进行配对样本的炎症过程的差异基因分析,以logFC与P值作为筛选条件,所筛选出的基因被视为明显差异表达基因。
1.4.2靶点通路富集分析 DAVID数据库是整合了生物学数据和分析工具的公开数据库,可对基因和通路进行功能注释。对所有差异基因进行GO与KEGG分析,GO富集分析是对差异表达基因(DEGs)进行细胞组成(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)这3个方面分析。KEGG通路富集分析,是阐明DEGs的基因功能和参与的细胞信号通路,然后以FDR法(FDR<0.05)对P值进行了测试和校正,最终设定阈值P<0.05,获得具有统计学意义的信号通路。并以上述通路中的预测靶标、作用通路联系Tan ⅡA的抗炎作用,构建可行性通路。
1.5 小鼠药效实验验证
1.5.1造模与给药 参考文献[7],随机抽取50只雄性小鼠C57BL/6J,分为5组:正常对照组(Normal)、模型组(Model)、Tan ⅡA低、中、高剂量组,每组10只。除正常对照组自由饮水,其余各组饮水为4%的葡聚糖硫酸钠(DSS)溶液,饮水和造模剂每2天更换一次,以防变质,保持清洁。正常组和模型组腹腔注射等体积的0.5% CMC-Na溶液,Tan ⅡA组腹腔注射低剂量组20 mg·kg-1、中剂量40 mg·kg-1、高剂量组60 mg·kg-1,从造模d 1开始连续7 d给药,每天1次。
1.5.2一般情况与疾病活动指数(DAI)的观测[8]造模期间每天监测食物与水的摄入、体质量、小鼠精神情况、有无死亡、观察大便性状(腹泻、稀便、血便)并进行疾病活动指数(disease activity index,DAI)评分,DAI=(体质量下降分数+粪便性状分数+隐血分数)/3。小鼠结肠炎DAI具体评分标准见Tab 1。

Tab 1 DAI scoring criteria
1.5.3取材 造模开始后d 8,末次给药后禁食不禁水12 h,颈椎脱臼法处死小鼠,摘取眼球法取血,将收集了血液的EP管置于冰上,静置2 h以上,4 ℃,1 500 r·min-1,离心10 min,分离血清,-20 ℃保存。从回盲肠交界处到直肠远端区域解剖其结肠,PBS冲洗去除粪便,分离出完整的结肠。取相同部位10%福尔马林溶液固定,其余组织-80 ℃冻存备用。
1.5.4苏木精-伊红染色(HE)病理观察 用10%甲醛固定,48 h后,石蜡包埋、切片4 μm,60 ℃烘烤1 h,脱蜡至水:二甲苯(Ⅰ、Ⅱ)各10 min,梯度乙醇脱水各5 min;双蒸水冲洗10 min;苏木素染色2-3 min,流水冲洗多余染料,盐酸酒精分化数秒后流水冲洗,伊红染色2 min,蒸馏水稍洗、上行梯度酒精脱水各1-2 min,二甲苯(Ⅰ、Ⅱ)透明各2 min;封片、镜检,观察小鼠结肠黏膜组织形态学变化并评分,评分标准参照Obermeier等[9]制定的标准。
1.5.5ELISA法检测TNF-α、IL-6、IL-1β炎症因子 血液离心取上清液检测,将样品与标准品加入96孔板中并按说明书加入相应试剂,37 ℃孵育30 min,拍板、洗板5次,加入酶标试剂,再同样操作,加入显色液,37 ℃避光显色15 min。加入终止液,于15 min内450 mm波长测量各孔OD值并处理数据。
1.5.6免疫组化检测 NF-κB和PPARγ 取病变结肠组织,用4%多聚甲醛固定。石蜡包埋,二甲苯脱蜡,梯度乙醇脱水,磷酸盐缓冲液(PBS)洗涤。抗原修复后加入一抗,孵育后加入二抗,用DAB染色、脱水、透明等方法干燥、密封切片。根据组织切片进行组织学评分。
1.5.7Western blot检测结肠Δ9去饱和脱氢酶、PPARγ和IκBα的表达 取结肠组织,于冰上剪碎,加入RIPA裂解液,提取蛋白后离心取上清,采用BCA蛋白定量法测定各样本蛋白浓度,调整各样本蛋白浓度煮沸变性,电泳1.5-2 h,然后转至PVDF膜,接着加入封闭液室温封闭60 min,加入对应稀释好的一抗、二抗。一抗根据说明书比例稀释,4 ℃孵育过夜,TBS洗膜后加入稀释好的二抗37 ℃摇床1 h,再TBS洗膜,最后加ECL显影、定影、扫描。用ImageJ软件分析各条带灰度值分析。

2 结果
2.1 UC患者差异基因分析Limma线性拟合方式,进行配对样本的炎症过程的差异基因分析,比较得出数据中炎症组与非炎症组明显影响和改变的差异表达基因共有170个,分别对炎症组与非炎症组数据进行GEO2R分析,以|log2FC|>1以及FDR<0.05为筛选差异基因的标准,其中logFC≥1.5代表基因表达上调,logFC≤-1.5代表基因表达下调,结果其中有109个基因表达上调,30个基因表达下调,根据所筛选出的差异基因作火山图(Fig 1)。其中红色代表基因表达上调,绿代表基因表达下调。
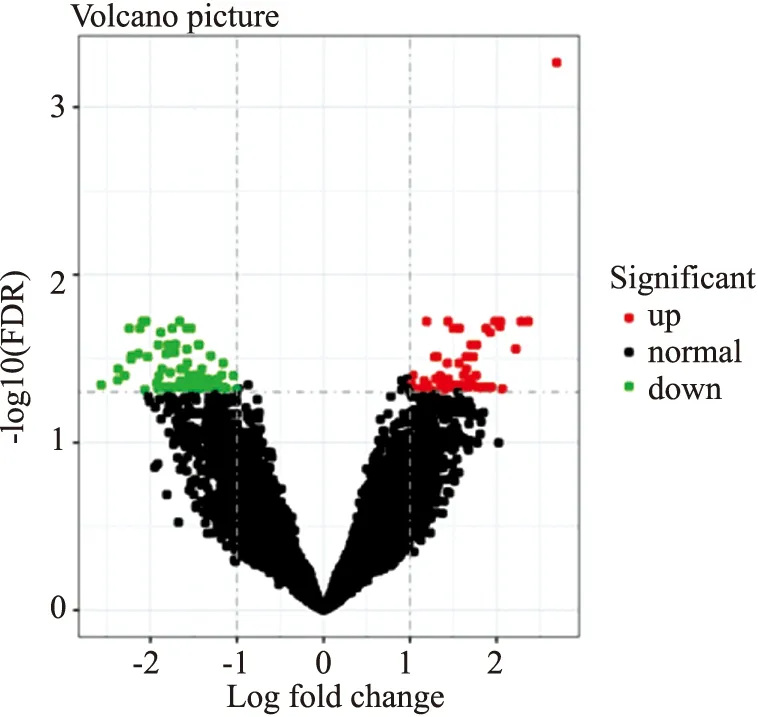
Fig 1 Volcano map of DRGs
2.2 GO富集分析和KEGG通路分析采用DAVID数据库对预测的差异基因进行GO功能注释和KEGG通路分析。可得GO富集分析分为3类:CC、MF和BP。其主要富集的CC是细胞顶端、顶端质膜、基地侧膜、血小板α颗粒等区;分子功能是参与有机阴离子转运、细胞外结构、基质组织、血管发育的正向调节等生物学过程。将基因GO本体条目按P值进行排序,分别选取CC、MF和BP的前10绘制气泡图(Fig 2A-C)。Pathway分析靶点基因主要富集参与到的5条最关键的信号通路(P<0.005))分别为蛋白质的消化与吸收途径、视黄醇途径、PI3K-Akt通路、青少年后期糖尿病醇途径与与亚油酸途径(Fig 3)。

Fig 2 Bubble chart of GO function analysisA:Cell composition;B:Molecular function;C:Biological process.
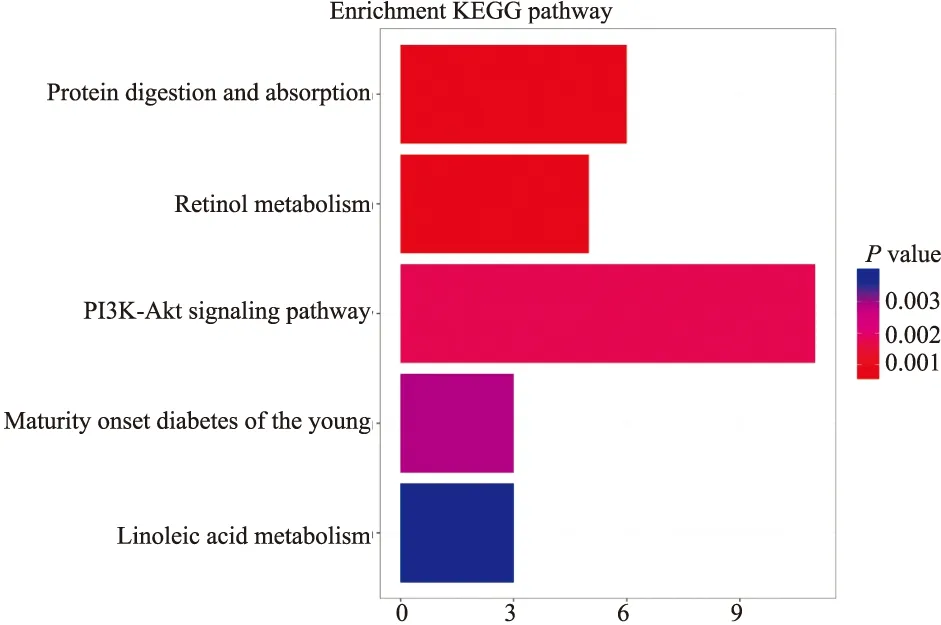
Fig 3 Bubble diagram of KEGG pathway enrichment analysis
2.3 小鼠一般状态的影响建立DSS诱导的UC小鼠模型,进行初步研究评估Tan ⅡA对UC小鼠的治疗作用。实验期间,正常对照组小鼠体重增加、饮食大便均正常。其余各组小鼠在饮用4% DSS后,造模组小鼠3 d后出现精神不振、体质量下降,d 4普遍出现稀便、肉眼血便。Tan ⅡA给药组从d 4开始也出现精神不佳、食欲下降、稀便,但各项指标与模型组相比较好。如Tab 2所示,与对照组相比,模型组的DAI评分为(3.41±0.52)明显上升(P<0.001)。给药之后,Tan ⅡA各组的DAI评分分别为3.27±0.45、2.9±0.24和2.45±0.28明显低于模型组(P<0.05),Tan ⅡA高剂量组与低、中剂量相比评分更低,说明Tan ⅡA对UC小鼠具有一定的治疗作用。

Tab 2 Score of disease activity index in each
2.4 结肠组织病理学观察通过HE染色进一步分析Tan ⅡA对小鼠结肠黏膜组织病理学改变的影响。正常组对照组小鼠结肠上皮屏障完整,腺体排列规则,未见水肿、溃疡,无炎症细胞浸润,隐窝结构完整。与正常对照组相比,模型组炎症累及肠壁全层,上皮破坏、结构不清,隐窝消失,单核、中性粒细胞等炎性细胞浸润。Tan ⅡA治疗后呈剂量依赖性地减轻DSS诱导的病理改变(Fig 4A)。此外,组织学分析显示Tan ⅡA改善了结肠黏膜的损伤,评分均低于模型组(Fig 4B)。

Fig 4 Effect of Tan ⅡA on pathological morphology of colon tissues in UC mice (× 200)A:HE staining (× 200).B:Histopathological score of colon in IBD mice by Tan ⅡA.##P<0.01 vs Normal;**P<0.01vs Model.
2.5 对结肠炎性细胞因子表达的影响采用ELISA试剂盒检测小鼠血清中的炎症因子TNF-α、IL-6、IL-1β 的水平。结果如Fig 5所示,正常对照组小鼠血清中的TNF-α、IL-6和IL-1β的含量均值分别为467、203、65 ng·L-1,模型组各组小鼠血清中TNF-α、IL-6和IL-1β的含量明显上升,分别
达到了711、248和121 ng·L-1,各组间比较差异有统计学意义(P<0.05)。与模型组相比,Tan ⅡA给药后TNF-α、IL-6和IL-1β水平明显降低,且与低剂量组相比,高剂量组下降趋势更为明显。表明Tan ⅡA对DSS诱导的小鼠UC具有一定的改善作用,能减少促炎细胞因子的释放且具有剂量依赖性。
2.6 对小鼠结肠组织的免疫调控机制的影响NF-κB p65在正常组织中无或者表达低,在UC活动期表达较高。如Fig 6A所示,无活性时NF-κB p65一般表达于胞质中,有活性后转移到细胞核中。与正常对照组相比,模型组结肠组织细胞核中NF-κB p65表达量高,Tan ⅡA给药组表达量较模型组低,高剂量细胞核中数量尤为明显。经统计学分析,空白对照组、模型组和Tan ⅡA给药组小鼠结肠组织中NF-κB之间的表达差异都具有统计学意义(P<0.05)(Fig 6B)。使用Western blot方法检测了各组小鼠结肠组织中的IκBα磷酸化(p-IκBα)的蛋白的表达量。研究发现如Fig 7所示,与正常对照组相比,模型组p-IκBα的表达量明显增加,Tan ⅡA治疗后p-IκBα表达量下降,表明Tan ⅡA可抑制NF-κB信号通路激活,从而起到抗炎作用。

Fig 5 Effect of Tan ⅡA on TNF-α,IL-1β and IL-6 in serum of UC mice#P<0.05,##P<0.01 vs Normal;*P<0.05,**P<0.01 vs Model.
有报道显示,在饮食中添加CLA可以预防肠道炎症,所以我们用Western blot方法检测了结肠组织中的Δ9去饱和脱氢酶,在体内CLA可通过Δ9脱氢酶由内源途径产生[7],结果如Fig 7所示,随着Tan ⅡA给药量的增加,Δ9去饱和脱氢酶的表达增加,说明了Tan ⅡA含量越多,CLA的含量也随之上升。CLA诱导的肠上皮细胞凋亡又属于PPARγ依懒型[10],在CLA刺激下,PPARγ能够诱导抗炎基因的转录[11]。我们接着对UC小鼠结肠组织进行PPARγ免疫组化方法,PPARγ在正常组织中表达含量低或者无,有活性时主要表达于结肠黏膜上皮细胞的细胞核中,并与病变的严重度相关,炎症越重,表达量越低。反之,相反。结果如Fig 6所示,在空白对照组中PPARγ表达量高,模型组结肠组织细胞核中PPARγ表达量低,Tan ⅡA给药组表达量较模型组高,且高剂量细胞核中数量尤为明显。Fig 7结果显示,与正常对照组相比,模型组小鼠结肠组织中的PPARγ的蛋白水平明显降低,给药低、中、高组PPARγ的蛋白水平上升,高剂量组较为明显。说明对NF-κB信号通路的作用可能是由通过CLA与PPARγ介导的。

Fig 6 Effect of Tan ⅡA on NF-κB activation and PPARγ expression in colonic tissues of UC mice#P<0.05 vs Normal;*P<0.05,**P<0.01 vs Model.

Fig 7 Effect of Tan ⅡA on expression of Δ9 dehydrogenase and PPARγ protein in colon tissues of UC miceA:The band diagram detected by Western blot.B:Comparison of the gray value of Western blot results,with β-actin as the internal reference.##P<0.01 vs Normal;*P<0.05,**P<0.001 vs Model.
3 讨论
UC是一种自身免疫性疾病,病因尚未明确,目前多认为与遗传、感染、免疫失调、环境等因素相关。基于与UC相关的途径与调节的靶标,我们先从GEO数据库下载UC患者的表达数据库GSE95095,利用GPL14951进行差异基因表达强度检测,然后对差异基因进行GO功能注释和KEGG通路富集分析,发现了这些靶基因主要富集的通路,并且这些通路都有可能参与了抑制炎症调控。近年来,对于细胞内重要信号转导通路PI3K-Akt在肠道炎症反应过程发挥的作用研究较多,但亚油酸对肠道炎症反应的有益作用报道较少,所以我们基于上面的生物信息学探讨CLA与宿主抗炎机制之间的关系。
CLA的同分异构体有20多种,通过对免疫细胞、免疫细胞因子、免疫应答和过氧化物酶体增殖物激活受体PPARγ途径的影响调节宿主的免疫功能,从而延缓动物以及人类机体免疫力的衰退[12]。研究发现,CLA诱导的肠上皮细胞凋亡属于PPARγ依赖型。CLA能增加脂肪细胞、骨骼肌、结肠黏膜和巨噬细胞中PPARγ的表达和活性[13]。CLA对促炎症细胞因子的调控与活化型的核转录因子PPARγ有关,PPARγ在抑制炎症因子生成方面起很重要的作用[14-15]。在UC中,PPARγ可以通过抑制诱导抑制因子IκB激酶的产生抑制NF-κB活性,进而抑制TNF-α、IL-6、IL-1β等相关炎症因子的表达,减轻UC炎症反应。CLA与PPARγ的配体过氧化物酶体增殖物的生理特性结构与结构生理特性都比较相似,这有可能是CLA激活PPARγ实现抗炎机制的关键因素。所以,探索CLA与PPARγ介导的调控下游NF-κB信号通路为靶点的治疗药物,将为UC治疗提供新思路与方法。
本研究采用4%的DSS法建立的UC小鼠模型,观察不同剂量的Tan ⅡA对于小鼠一般状态、炎症因子及肠道黏膜损伤的改善作用,以及是否可以通过CLA和PPARγ介导的抗炎机制调控。研究发现Tan ⅡA确实缓解了小鼠体质量减轻、粪便出血等情况,结肠组织病理切片表现出Tan ⅡA对于DSS小鼠可保护结肠黏膜、减少炎性细胞浸润。验证了Tan ⅡA确实可以改善小鼠UC状况。接着,我们进一步探讨了Tan ⅡA在结肠细胞中CLA激活PPARγ实现抗炎途径所涉及的机制。与正常对照组相比,模型组CLA和PPARγ蛋白表达量下降,p-IκBα蛋白表达明显升高,血清TNF-α、IL-6、IL-1β水平也高于正常组,但治疗7 d后,Tan ⅡA处理将其趋势逆转,CLA和PPARγ蛋白表达量上升,p-IκBα、TNF-α、IL-6、IL-1β水平下降,有明显差异(P<0.05)。
据此,本研究可以推断Tan ⅡA对DSS诱导的UC疾病具有保护作用,且其作用机制可能与CLA激活PPARγ基因,阻断下游NF-κB信号通路,下调炎症因子的表达,上调肠黏膜屏障保护因子的蛋白表达有关。本课题组接下来将通过体外实验和代谢组学对其药效与通路机制做进一步研究,证明其有效性,为开发新药提供安全、有效的药理学证据。