重度抑郁症啮齿类动物模型研究进展
2021-12-15许向阳张长青胡一桥
周 珺,许向阳,张长青,罗 欢,张 玲,蒋 钰,胡一桥
(1.南京大学医学院,江苏 南京 210093;2.江苏恩华药业股份有限公司,江苏 徐州 221000)
重度抑郁症(major depressive disorder,MDD)是一种情绪性功能障碍,以持久的自发性情绪低落为主,表现为社交能力障碍、情绪低落、躯体不适、食欲不振等一系列抑郁症状,严重可伴有自杀。目前临床诊断主要基于患者的症状描述、精神状态检查和临床行为观察,筛查和基线汉密尔顿抑郁量表17(HAMD-17)评分≥24分的患者被诊断为MDD[1]。根据WHO在2015年的数据,预计MDD患者人数已超过3亿,是全球疾病负担的主要因素之一,是自杀死亡的主要原因[2]。
基于单胺假说的传统抗抑郁药,包括选择性5-羟色胺(5-hydroxytryptamine,5-HT)或去甲肾上腺素再摄取抑制剂,或三环类抗抑郁药物,或单胺氧化酶抑制剂,它们通过增加机体内单胺类神经递质发挥抗抑郁药效。然而,经过2-3个月的治疗后,缓解率很低(20%-60%)。此外,30%患者对两种以上的传统抗抑郁药物治疗无效,被称为难治性抑郁症(treatment-resistant depression,TRD)[2-3]。一些临床/非临床研究发现,女性更容易受到社会压力的影响,更容易发展出抑郁行为,但偏向女性抑郁症的动物模型仍然严重缺乏。因此,旺盛的临床需求,使得MDD新药开发成为国内外研发热点,而基于单胺类神经递质机制建立的动物模型已不能满足新机制抗MDD的新药开发。
近年来,神经生理学系统细胞和分子水平的特征发现和分子靶点的机制研究,MDD发病机理、脑-神经回路的研究都取得了一定进展,包括应激轴的异常调节或神经炎症的发生等等[2-3]。一些新型的非单胺抗MDD药物,如s-氯胺酮(NMDA的拮抗剂)和治疗产后抑郁症的布雷沙诺酮(GABA-A受体的正性变构调节剂)已被美国食品和药物管理局(FDA)批准上市。
本综述总结了国内外MDD啮齿类动物模型,介绍不同模型的原理和制备方法,通过对模型的表型特征、发病机制、能否被抗抑郁药物治疗或逆转几个方面综合分析模型有效性(临床MDD模拟性)以及其优缺点。模型总结如Tab 1所示。
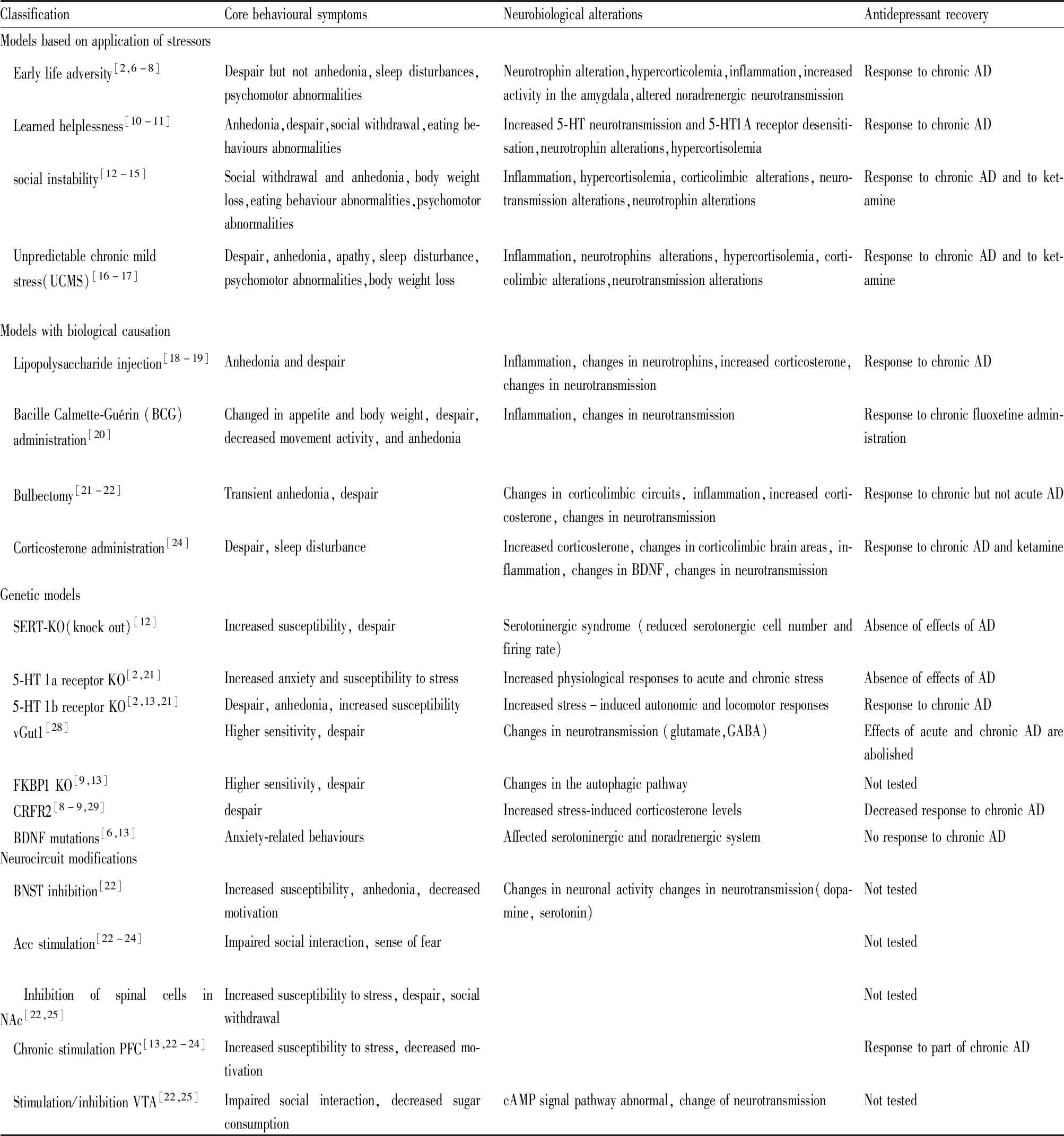
Tab 1 Summary of most commonly used rodent models of MDD
1 应激刺激诱导的模型
大量研究认为,诸如压力等逆境的刺激可诱发MDD的发生。因此,模拟幼年生活中的逆境刺激和成年后不良生活刺激,可成功诱导MDD动物模型。
1.1 发育期逆境早期母婴分离作为一种压力应激,可影响后代成年后的行为和生物表型。从产后d 2到d 12每天分离3 h,模型幼鼠表现为学习和记忆缺陷(BALB/c小鼠,Wistar大鼠)、抑郁和焦虑样行为(BALB/c和C57BL/6小鼠,Wistar和SD大鼠)[4-6]。
然而,该模型动物较少表现出快感缺失,表明其并不能概括MDD的所有方面[3]。在生物水平上,神经营养因子如脑神经营养因子(brain-derived neurotrophic factor,BDNF)发生改变(以减少为主),皮质酮水平增加,促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)减少,参与压力调节的一些大脑区域的活动增强,如杏仁核中的c-fos增加,室旁核(PVN)和杏仁核的FosB增加,以及神经递质的变化,如去甲肾上腺素能受体的改变等[5-7]。在恶劣环境下生活的母鼠孕育的后代,以及在自发的母性照护缺失的啮齿动物身上也有类似发现[7]。需要注意的是,啮齿动物新生儿幼崽,其发育阶段更符合人类出生前的阶段,因此,使用幼年啮齿类动物应当更能模拟临床研究。
1.2 成年期应激对成年啮齿动物施加不可预知的应激源可诱导不同MDD模型,应激源分别有持续几个小时(习得性无助)、几天(社交失败)或几周[不可预测的慢性轻度应激(unpredictable chronic mild stress,UCMS)],可以是轻微的(如在UCMS中),也可以是强烈(社交失败或习得性无助感)的。
1.2.1习得性无助 1967年,Seligman等[8]研究发现,当狗受到无法躲避的足部电击时,将无法学会躲避可避免的足部电击,这种行为被称为习得性无助。同时,动物表现出快感缺失和绝望行为。后来,这些研究扩展应用到啮齿动物。Maier和Seligman对神经生物学基础进行了总结[9]:首先,不可避免的休克诱导中缝背核5-HT神经元的强烈激活,导致(a)5-HT在其投射结构(如杏仁核、背导水管周围灰质和伏隔核)中的急性释放,(b)中缝背侧5-HT1A自身受体的长期持续脱敏。动物模型还具有神经营养素的变化,以及皮质酮水平升高。MDD患者功能性神经影像学也发现了类似的神经生物学改变[3],说明该模型的拟临床相似性。然而,并不是所有的啮齿动物都表现出获得性无助:一些动物在造模后可自行恢复的,而另一些则相对易感。
1.2.2社交缺陷 试验鼠被放置在一只攻击性的常驻老鼠的笼子里,每天10 min。受试动物受到寄居动物的攻击,甚至受伤。此外,受试鼠被迫在恐惧的视觉、嗅觉和听觉中度过剩余的1 d,并不与攻击者进行身体接触。这个试验方案重复10 d,每天都有一个新的对手。10 d后,受试动物表现出社交退缩和快感缺失的行为特征,即社交缺陷,伴随与MDD相关的神经生物学变化,如PFC调节失调,导致杏仁核活动增加,促炎细胞因子的释放,高皮质醇血症,以及神经营养素的变化。慢性社交失败模型对长期SSRIs敏感[10-11]。氯胺酮急性治疗也可改善[3,12]。
但社交失败模型不能有效地诱导雌性动物抑郁样行为,因为雌性啮齿动物的攻击性较低。有研究采用隔离/拥挤阶段交替出现,持续1-48 h,可在雌鼠建立维持数周的慢性社会不稳定模型[12-13],表现为蔗糖偏好的降低,悬尾试验中的不动时间增加,以及生理异常,如皮质酮增加和体重下降,肾上腺激素水平的异常变化[13]。
1.2.3UCMS UCMS是指让啮齿动物承受各种各样的社会环境压力源,这些压力源具有以下特点:(1)刺激强度较轻(即不会引起身体疼痛、饥饿,不会对动物表型产生不可逆的影响);(2)诱导周期较长,在数周内重复出现,急性给药对这些轻微的应激无效;(3)根据计划表以不可预测的方式出现(即在数天/周内,每个单独应激刺激的持续时间不同,1 d中给与应激刺激的时刻不同等)。几周后,模型表现出被毛状态恶化,快感缺失(饼干试验或蔗糖偏好试验)。传统抗抑郁药物治疗可逆转[14]。该模型诱导了多种神经生物学变化,包括下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴调节缺陷,海马神经发生减少,小胶质细胞活化增加,前脑5-HT神经传递减少,额叶区域AC-cAMP-PKA信号降低,海马中的BDNF等神经营养素减少,海马体和一些额叶区域的树突状分支减少,海马体-伏隔神经通路的LTP受损等[15]。
2 生物学诱导模型
大量临床研究证实,MDD患者普遍存在神经生物学的改变,如大脑功能网,包括前扣带皮层(anterior cingulate cortex,ACC)和前额叶皮层(prefrontal cortex,PFC)的其他部分、杏仁核、海马体、伏隔核(nucleus accumbens,NAc)和缰核的活动增强,神经炎症,HPA轴调节失调导致高皮质醇血症,一些神经递质如5-HT水平的变化,或者某些特定基因的多态性[3,5]。研究人员通过生物学方式在啮齿动物中诱导这些生物学异常变化,成功建立了有效的MDD动物模型。
2.1 脂多糖注射模型单次注射细菌内毒素—脂多糖(lipopolysaccharide,LPS)0.5-0.83 mg·kg-1,可成功诱导MDD的炎症相关模型,该模型表现为,蔗糖偏好降低和绝望行为,同时促炎性细胞因子如白介素-1β和肿瘤坏死因子-α的表达增加,其他神经生物学的改变,包括PFC和海马中BDNF水平的降低,皮质酮水平升高,以及皮质结构中单胺类的变化[11,16-17],传统抗抑郁药物治疗均可逆转这些变化。
2.2 卡介苗-盖林(Bacille Calmette-Guérin,BCG)给药模型类似LPS注射液,单次注射BCG 107-108CFU,可诱发神经炎症相关的慢性抑郁样行为。卡介苗是一种减毒活疫苗的病原体,接种动物产生慢性炎症反应,这种持续1个月的慢性炎症可引起(1)食欲和体重的变化,(2)绝望,反映在强迫游泳实验和悬尾实验中不动时间的增加,(3)运动活力降低和(4)快感缺失(蔗糖偏好试验)。慢性氟西汀治疗可逆转此类抑郁样症状[18]。
2.3 嗅球切除术嗅球切除术即手术切除啮齿动物的双侧嗅球。手术两周后,啮齿类动物进入一个新环境会表现出过度活跃,压力敏感度增加,睡眠节律扰乱,体重减轻,短暂的无精打采和绝望,类似临床MDD患者的症状。在神经生物学水平上,嗅球切除术可引起皮质结构的神经退行性变。同时,炎症和皮质酮水平增加,5-HT能神经传递改变[19-20]。慢性(2-4周)经典抗抑郁药物可抵消行为学改变,而亚慢性或急性治疗则无效[20]。
2.4 皮质酮给药应激刺激诱导HPA轴激活,导致皮质类固醇释放增加。正常生理情况下,应激刺激发生时HPA轴可自我调节维持体内稳态。然而,病理条件下,HPA轴调节紊乱,糖皮质激素浓度异常升高,可导致脑损伤,如海马神经发生减少、CA3和PFC区树突状分支减少[4,9,11-12]。通过注射皮质类固醇激素诱导的慢性应激动物模型表现出高皮质类固醇水平,HPA轴功能失调,这与MDD患者观察到的情况类似。动物模型还表现出行为学改变,如强迫游泳试验中的不动时间增加,被毛状态恶化,旷场试验和明暗试验中的焦虑样行为,快感缺失。此外,动物对应激刺激反应迟钝,应激敏感脑区(如PFC和海马体)的活化增强,神经炎症,一些种属动物的海马BDNF减少,5-羟色胺能神经传递改变[4,21]。
3 基因模型
抑郁症有很强的遗传成份,因此,许多研究试图改变易感基因的表达从而诱发出MDD。目前,已建立的基因模型涉及血清素能、去甲肾上腺素能系统,以及HPA轴调控的靶向基因。建立基因模型的方法之一是根据它们对压力的敏感性筛选繁殖,例如根据对皮质酮释放的敏感性(即竞争),选择出对压力反应情绪性和反应性更高动物,称为高反应性动物,进行进一步培育繁殖。行为测试实验证实,高反应性动物比低反应性的同龄动物表现出过度活跃,类似于一些抑郁症患者中的精神亢奋[3,12]。另一种造模方法是使用基因敲除/敲进技术诱导基因突变(5-HT系统:敲除5-HT转运体,5-HT1A、5-HT1B、5-HT2B;HPA轴:FKBP1或CRHR1;其他系统:CB1、OCT2、DBH、vGlut或MIF),部分模型总结见表1。这些动物表现出压力敏感性的增加[2,12]。在研究过程中,研究人员应当基于机制的不同,建立不同的基因模型。但是基因模型有很大的局限性,因为其一般是基于单一蛋白的改变,不能涵盖MDD发病的复杂改变,另外若靶蛋白分布全身,则基因变异常会影响机体整体而非单一病理相关脑组织的生理改变。
4 神经环路修饰(光遗传学调控)模型
光遗传学技术结合光学与遗传学手段,精确控制特定神经元活动,近年来成为研究神经科学的重要工具。研究者将光敏蛋白通过基因融合引入细胞,利用光控系统调控神经活动,在亚细胞水平定位蛋白活动,调控蛋白功能,促进或抑制基因表达,或者诱导蛋白降解。
一些光遗传学实验通过调控修饰神经环路,可以加剧应激/压力易感性,有效地诱导抑郁样行为,包括抑制终纹床核前腹部体(bed nucleus of the stria terminalis,BNST),抑制伏隔核(nucleus accumbens,NAc)表达多巴胺1受体的中型棘状神经元,慢性刺激内侧前额叶皮层(medial prefrontal cortex,mPFC),或刺激来源于前扣带皮层(anterior cingulate cortex,ACC)的锥体神经元等。此外,针对中脑腹侧被盖区(ventral tegmental area,VTA)的实验发现:慢性社交失败时VTA-NAc环路的慢性相刺激,VTA抑制,应激敏感小鼠VTA的相性刺激,VTA-NAc神经元的相性刺激和VTA-内侧PFC神经元的抑制都可诱导应激敏感表型。这些模型,表现出对应激刺激敏感性增加,皮质激素水平显著升高,杏仁核体积增大,绝望,社交障碍,类似临床抑郁患者的生理学改变[11,22-24]。但这些模型仅概括了与MDD相关的特定脑回路的功能障碍,但并不能体现MDD相关的综合缺陷。目前,光遗传学调控作为无创性深部脑刺激,也被用作治疗抑郁症的一种潜在疗法,同时,光遗传学对动物模型中的电路研究,可以揭示相关神经网络的分子特性,并作为工具用于设计药理学策略来调节特定回路或细胞群的活动,对研究抑郁症的分子机制至关重要。
5 其他特殊类型MDD动物模型
5.1 抑郁症亚型的动物模型重度抑郁症是异质性疾病,目前较为公认的抑郁症亚型包括忧郁型抑郁和非典型抑郁症。
忧郁型抑郁的定义是严重且广泛的快感缺失。临床表现为精神运动障碍(躁动或减退),营养缺乏,体重减轻,睡眠障碍(失眠)和性欲降低;情绪对正向刺激反应性降低;认知障碍,伴随精神异常,如内疚感[1]。Swartz等[25]根据皮质酮释放抑制应激(即竞争)选择性繁殖,分离出的高反应小鼠体重较低,睡眠节律紊乱,认知障碍,情绪反应性增强,反应亢奋,情绪激动,类似临床忧郁型抑郁。同时,小鼠的“忧郁样”特征可被传统抗抑郁药物所改善。Lüscher等[26]建立了γ-氨基丁酸受体缺陷小鼠模型,表现出更高的焦虑、抑郁样行为和HPA轴高活性,类似临床忧郁患者。此外,长期使用传统抗抑郁药物治疗,如地昔帕明(desipramine)可以逆转该模型抑郁样症状,使HPA轴调节趋于正常。这些模型可以提高对忧郁型抑郁症生物标志物的理解,并有助于制定新的靶向治疗策略。
非典型抑郁症是抑郁症的另一个常见亚型,临床约有15%-25%的抑郁症患者被诊断为非典型抑郁症。相比忧郁症亚型,非典型抑郁症患者表现出嗜睡、体重增加、食欲旺盛、嗜睡和对环境的更高反应性。患者的生物学指标显示HPA轴活性和CRH浓度显著的降低,表明压力调节的异常。如前所述,根据抑制应激的反应选择性培育的低反应性小鼠,可能符合一些非典型抑郁症的有效标准,如体重增加,HPA轴活动减少。然而,非典型抑郁症缺乏明确完善的动物模型评价数据,导致对这些抑郁亚型的生物学标志物了解的欠缺[27]。
5.2 “经前烦躁症”动物模型的建立激素的波动,可导致与女性经前周期相关的抑郁障碍,如女性经前性激素紊乱(premenstrual dysphoric disorder,PMDD)。有以下至少5种症状就可诊断PMDD:情绪波动、抑郁或悲伤、愤怒或易怒、焦虑、无精打采、注意力不集中、嗜睡、食欲异常、感知失控以及身体症状(紧张、关节或肌肉疼痛)。PMDD影响妇女的日常生活功能,现有干预措施都是基于SSRIs和激素治疗。由于尚不清楚症状发生的确切机制,目前关于PMDD的动物模型、疾病机制研究,治疗药物研究都很匮乏[28,13]。
有研究发现,激素波动(如卵巢切除,给与外源性类固醇激素雌二醇和睾酮)可影响雌性大鼠PMDD,表现为雌鼠对入侵者的攻击行为,FST中静止时间增加等抑郁样症状,临床表现为女性患者的易怒。氟西汀可有效改善PMDD[28]。此外,孕酮戒断或黄体酮戒断是雌性大鼠突然停止长期服用外源性类固醇的模型,可引起显著的、可重复的抑郁样行为,如绝望和无精打采症状增加,此类症状可被阿米替林和伏罗西汀逆转[29]。
5.3 难治性抑郁症和复发性抑郁症动物模型的建立
5.3.1难治性抑郁症 难治性抑郁症,也称抗治疗性抑郁症(treatment resistant depression,TRD),即对药物治疗的不充分反应,包括对传统抗抑郁药物的无反应和抗药性。诊断标准为两个或两个以上传统抗抑郁药物治疗无效。传统的动物模型不适于TRD的研究。
有研究采用UCMS、社交失败或慢性皮质酮给药模型,筛选对传统抗抑郁药物无反应的动物个体。研究发现食用高脂肪饮食的UCMS动物对氟西汀治疗可产生抗药性[14]。谷氨酸能调节剂如氯胺酮和AMPA受体调节剂,或深部脑刺激在UCMS啮齿类动物中产生类似抗抑郁的作用[16]。这些研究为TRD的发生机制提供了一个可能的分析工具。
5.3.2复发性抑郁症 MDD易复发,几乎50%的抑郁症患者有复发经历,复发性抑郁症的定义是完全康复后出现另一个发作[16]。研究发现,当大鼠最初的慢性应激经历在恢复期后,再次暴露于应激时会诱发易感性和抑郁样行为的快速发作。而恢复期增加的蔗糖消耗量回到基线水平,符合复发性抑郁症的标准[30]。而当同时高脂肪饮食时,连续两次发作的UCMS诱发了一种对抗抑郁药有抵抗力的表型,类似于临床复发性抑郁症[14]。
6 讨论与结论
综上所述,大多数常用的抑郁症动物模型都达到有效性标准,它们模拟临床抑郁症的表型,并诱导类似于人类的神经生物学变化,而这些改变可部分性的被经典抗抑郁药物所逆转。然而,由于抑郁症是多种因素组合的结果,是病理生理学中多种神经回路组成的复杂网络的多重改变。基于单一神经回路诱导的神经元对特定投射物/大脑区域调控的动物模型只能呈现某些表型异常,而不能对抑郁症的病理机制提供统一全面的诠释。因此,传统的抑郁症动物模型未能促进新治疗方法的发展,对抑郁症的生物学机制的了解尚不完善。未来的研究,我们不仅要关注抑郁症状表型的存在与否,还应当更加准确的了解临床症状背后的生物学特征,发生机制和恢复机制,并准确地识别生物标志物。更重要的是,动物模型应该尊重人类的异质性,开发基于不同病理机制的更精确的动物模型,通过定义准确的目标来改进对MDD及其亚型的治疗,有助于新型有效的抗抑郁药物研发。