杜鹃花总黄酮对急性脑缺血/再灌注损伤大鼠STIM-Orai调控的G蛋白偶联SOCE通路的影响
2021-12-15赫玉香陆嘉珺王书凡姜晨晨尹秀云沈学彬
赫玉香,陆嘉珺,王书凡,姜晨晨,施 磊,尹秀云,陈 卓,曹 迪,沈学彬,韩 军
(国家中医药管理局中药药理三级实验室,安徽省皖南地区植物药活性物质筛选与再评价工程实验室,安徽省多糖药物工程技术研究中心,皖南医学院药物研发中心,药学院药理学教研室,安徽 芜湖 241002)
缺血性脑卒中是一种常见的脑血管疾病,是世界上第二大死亡原因。由于脑血管突然阻塞,限制了对脑组织相关区域的血液供应,从而对人类健康造成了严重的负面影响。快速再灌注可最大程度地减少脑组织的结构和功能损伤,是最有效的缺血治疗方法之一。然而,脑血流的恢复也会导致再灌注损伤。因此,深入研究缺血性脑卒中损伤修复机制对脑功能的重建具有十分重要的意义。
研究表明,Ca2+内流可导致神经元内Ca2+浓度升高,破坏离子平衡,而缺血性损伤引起的神经元内钙超载,可导致不可逆性的细胞损伤[1]。其中G蛋白偶联钙库操作性钙离子通道(store-operated calcium entry,SOCE)是介导细胞外Ca2+进入细胞内的重要通道之一,其核心蛋白由位于内质网上的基质相互作用分子(stromal interaction molecule,STIM)和钙释放激活钙通道调节分子(calcium release-activated calcium modulator,Orai)构成[2]。在急性缺血损伤中,STIM2基因敲除后,H9c2细胞内质网钙释放减少,线粒体钙超载减轻[3]。在暴露于全脑缺血大鼠的海马中,STIM1和Orai1表达的增加被认为是导致过度钙内流的最主要原因,SOCE通路代表了缺血性神经元死亡的一个重要的非兴奋性毒性机制[4]。
杜鹃花总黄酮(total flavones ofRhododendronsimsiiPlanch,TFR)是从中药杜鹃花中提取的黄酮类有效部位,其主要成分为金丝桃苷、芦丁、映山红素等黄酮化合物[5]。研究表明[6],TFR可以舒张大鼠的基底动脉和大脑中动脉,改善脑血液循环。我们课题组前期研究已经证实[5],TFR对全脑缺血/再灌注大鼠脑损伤具有明显的改善作用,其机制可能与TFR作用于脑基底动脉,激活瞬时受体电位香草醛亚家族4通道(transient receptor potential vanilloid channel 4,TRPV4),继而激活小电导钙激活钾通道与中电导钙激活钾通道,阻滞Ca2+内流,促使脑基底动脉舒张有关。尽管SOCE与脑缺血性损伤有关,但TFR改善大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠脑损伤是否与SOCE通路有关,尚未见相关文献报道。
本实验通过大脑中动脉闭塞建立局灶性脑缺血/再灌注损伤模型,探究TFR减轻大鼠急性脑缺血/再灌注损伤与STIM-Orai调控的G蛋白偶联SOCE通路之间的关系,将有助于对缺血性脑卒中机制的进一步认识,为其防治提供新的思路和候选药物。
1 材料与方法
1.1 试剂TFR购自上海源叶生物科技科技有限公司(批号:A0276);2-氨基乙基联苯基硼酸酯(2-APB,批号:D9754)购自美国Sigma公司;IL-1检测试剂盒(批号:E08055r)、IL-6检测试剂盒(批号:E04640r)及TNF-α检测试剂盒(批号:E11987r)均购自Cusabio公司;STIM1抗体(批号:ab108994)、STIM2抗体(批号:ab59342)、Orai1抗体(批号:ab175040)、蛋白激酶B(protein kinase B,PKB)抗体(批号:ab179463)均购自美国Abcam公司;GAPDH(批号:AF7021)、半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase 3,caspase-3)抗体(批号:AF7022)购自美国Affinity公司;RevertAid First Strand cDNA Synthesis Kit(批号:K1621)、PowerUp SYBR Green Master Mix(批号:A25742)均购自Thermo Fisher公司。
1.2 仪器脑定位仪(美国哈弗公司);ST8R高速冷冻离心机(Thermo Fisher科技公司);Model 550酶标仪(美国BIO-RAD公司);生理检测仪(美国哈弗公司);Mini PROTEAN电泳系统(美国BIO-RAD公司);逆转录PCR仪(美国ABI公司);Mini PROTEAN转膜系统(美国BIO-RAD公司);实时荧光定量PCR(美国ABI公司)。
1.3 动物成年雄性SD大鼠(280-320)g,由南京青龙山动物繁殖场提供。许可证号为SCXK(苏)2017-0001。本实验已通过皖南医学院实验动物伦理委员会批准。将大鼠饲养在塑料笼子中,控制环境,温度:(23±2)℃,湿度:60%±5%,模拟12 h交替光暗周期。所有动物均可获得标准饮食和自由饮水。
1.4 分组与给药将40只SD雄性大鼠随机分为5组,分别是Sham组、MCAO组、TFR(100 mg·kg-1)组、TFR(100 mg·kg-1)+2-APB(2.5 mg·kg-1)组、2-APB(2.5 mg·kg-1)组,每组各8只。Longa评分1-3分纳入实验,除Sham、MCAO组大鼠给予生理盐水灌胃外,TFR(100 mg·kg-1)采用术后立即尾静脉注射给药,2-APB(2.5 mg·kg-1)术前30 min腹腔注射给药。
1.5 模型建立及改良Longa评分[7]大鼠用3 %戊巴比妥钠(40 mg·kg-1)麻醉。分离右侧颈总动脉、颈外动脉和颈内动脉。在颈总动脉分叉处上方约4 mm处切开颈外动脉。通过残端将4.0单丝尼龙栓线插入颈内动脉直到产生阻力。2 h后取出,结扎切口,Sham组不阻断血流。24 h后按改良Longa评分系统进行评分:0,无神经功能缺损;1,提起尾巴,左前爪紧贴胸口处;2,向左转圈;3,向左倒下;4,意识低迷,不能自主行走;5,死亡。评分1-3分为造模成功。
1.6 ELISA法检测血清中IL-1、IL-6、TNF-α含量的变化分组同1.4,再灌注24 h后,将大鼠麻醉,腹主动脉取血置于采血管中,37 ℃烘箱中静置30 min,离心(4 ℃,10 min),吸取上清液置于EP管中,-80 ℃保存。严格按照IL-1、IL-6及TNF-α试剂盒说明书测定。
1.7 HE染色检测大鼠缺血脑组织的病理变化分组同1.4,再灌注24 h后,处死大鼠,取脑组织在4%多聚甲醛中固定、脱水、二甲苯清洗、石蜡包埋、切片(5 μm厚)。脱蜡、染色、0.3%盐酸分化、氨水稀释、0.5%曙红溶液复染。显微镜下观察大鼠脑组织的病理变化。
1.8 TTC染色法检测大鼠大脑梗死面积分组同1.4,再灌注24 h后,以3%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉后处死大鼠,取脑组织在-20 ℃下冷冻20 min后作冠状切片。之后在1% TTC中,37 ℃避光染色30 min,4%多聚甲醛溶液固定。在光学显微镜下拍摄图像。梗死面积的比例/%=梗死面积(浅色区)/横切面总面积×100%。
1.9 Western blot法检测大鼠脑组织中STIM1、STIM2、Orai1、caspase-3及PKB蛋白表达水平用蛋白裂解缓冲液提取约100 mg脑组织梗死侧的总蛋白。12 000 r·min-1离心15 min后,用BCA蛋白浓度试剂盒测定上清液中蛋白质浓度。以10 %十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜后牛奶封闭2 h,加入STIM1(1 ∶3 000)、STIM2(1 ∶400)、Orai1(1 ∶200)、caspase-3(1 ∶1 000)及PKB(1 ∶10 000)一抗,4 ℃孵育过夜。再用相应的二抗(1 ∶1 000)室温孵育2 h,用增强化学发光法测量条带信号的强度,并用软件Image J 1.43进行密度分析。
1.10 RT-qPCR法检测大鼠脑组织中STIM1、STIM2、Orai1、caspase-3及PKB mRNA表达水平用TRIzol从大鼠脑组织梗死侧提取总RNA,微量紫外可见分光光度计纯化和定量RNA,取约2 μg总RNA合成cDNA。每组选取的均是梗死侧相同部位的脑组织。然后用PowerUp SYBR Green Master Mix试剂盒进行实时聚合酶链反应。RT反应在95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s下进行,共40个循环,GAPDH为内参。相关基因表达数据用2-ΔΔCt法分析。引物为:GAPDH正向:5′-CTGGAGAAACCTGCCAAGTATG-3′ 反向:5′-GGTGGAAGAATGGGAGTTGCT-3′;STIM1正向:5′-CACCAACACCACCATGACAG-3′;反向:5′-TGCTCCTTGGAGTAACGGTT-3′;STIM2正向:5′-CAAGTTGCCCTGCGCTTTAT-3′ 反向:5′-ATTCACTTTTGCACGCACCG-3′;Orai1正向:5′-TGGCCGTGCACCTGTTC-3′ 反向:5′-TTGCTCACAGCCTCGATGTT-3′;caspase-3正向:5′-ATGTCGATGCAGCTAACC-3′ 反向:5′-GTCTCAATACCGCAGTCC-3′ ;PKB正向:5′-CGCCGCCTGATCAAGATGAC-3′ 反向:5′-TCTGGCCTCAAATCGGATGA-3′。

2 结果
2.1 各组大鼠的神经功能评分结果以改良Longa评分为基础进行神经功能缺损评定,结果如Tab 1所示,与Sham组相比,MCAO组大鼠神经功能评分明显升高(P<0.01);与MCAO组相比,TFR组大鼠神经功能评分明显下降(P<0.05);与TFR组或2-APB组相比,TFR+2-APB组大鼠神经功能评分略有降低,但差异无统计学意义(P>0.05)。
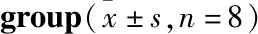
Tab 1 Comparison of neurological function scores of rats in each
2.2 TFR及SOCE通道抑制剂对MCAO大鼠血清IL-1、IL-6及TNF-α含量的影响如Fig 1所示,与Sham组相比,MCAO组大鼠血清IL-1、IL-6及TNF-α含量明显升高(P<0.01)。而TFR组大鼠血清IL-1、IL-6及TNF-α含量明显低于MCAO组(P<0.01)。与TFR组或2-APB组相比,TFR+2-APB组IL-1、IL-6及TNF-α的含量明显降低(P<0.05)。

Fig 1 Effects of TFR and SOCE channel inhibitor on contents of IL-1,IL-6 and TNF-α in serum of MCAO **P<0.01 vs Sham;##P<0.01 vs MCAO;&P<0.05,&&P<0.01 vs TFR;$$P<0.01 vs 2-APB
2.3 HE染色观察MCAO大鼠脑组织的病理变化结果如Fig 2显示,Sham组大鼠脑组织细胞排列规则,核仁清晰,而MCAO组形态不规则,炎性浸润,表现为空泡形成、核溶解、细胞坏死。与MCAO组相比,TFR组大鼠脑组织仍有神经元固缩,但梗死侧细胞坏死明显减少;与TFR组或2-APB组相比,TFR+2-APB组大鼠脑组织病理学损伤得到进一步改善。

Fig 2 Effects of TFR and SOCE channel inhibitor on pathological changes of brain tissue in MCAO rats(HE staining,×400)A:Sham;B:MCAO;C:TFR;D:TFR+2-APB;E:2-APB
2.4 TTC染色观察TFR及SOCE通道抑制剂对大鼠脑组织梗死面积的影响如Fig 3、4显示,与Sham组比较,MCAO组大鼠脑组织出现大量梗死灶(P<0.01)。与MCAO组相比,TFR组大鼠脑组织梗死灶明显减少,脑梗死率明显降低(P<0.01);与TFR组或2-APB组相比,TFR+2-APB组大鼠脑梗死灶进一步减少,脑梗死率进一步降低(P<0.05)。

Fig 3 Photographs of brain sections with TTC stainingA:Sham;B:MCAO;C:TFR;D:TFR+2-APB;E:2-APB

Fig 4 Effects of TFR and SOCE channel inhibitor on cerebral infarction in MCAO **P<0.01 vs Sham;##P<0.01 vs MCAO;&P<0.05 vs TFR;$$P<0.01 vs 2-APB
2.5 TFR及SOCE通道抑制剂对MCAO大鼠脑组织中STIM1、STIM2、Orai1、caspase-3、PKB蛋白表达水平的影响如Fig 5所示,与Sham组相比,MCAO组大鼠脑组织STIM1、STIM2、Orai1、caspase-3蛋白表达明显上调(P<0.01),PKB蛋白表达明显下调(P<0.01);TFR组相较于MCAO组STIM1、STIM2、Orai1、caspase-3蛋白表达明显下调(P<0.05),PKB蛋白明显上调(P<0.05);与TFR组或2-APB组相比,TFR+2-APB组STIM1、STIM2、Orai1及caspase-3蛋白表达明显下调(P<0.05),PKB蛋白表达明显上调(P<0.05)。

Fig 5 Effects of TFR and SOCE channel inhibitor on expression of STIM1,STIM2,Orai1,caspase-3 and PKB protein in brain of MCAO 1:Sham;2:MCAO;3:TFR;4:TFR+2-APB;5:2-APB;**P<0.01 vs Sham;#P<0.05,##P<0.01 vs MCAO;&P<0.05,&&P<0.01 vs TFR;$$P<0.01 vs 2-APB

Fig 6 Effects of TFR and SOCE channel inhibitor on expression of STIM1,STIM2, Orai1,caspase-3 and PKB mRNA in brain of MCAO **P<0.01 vs Sham;#P<0.05,##P<0.01 vs MCAO;&P<0.05 vs TFR;$P<0.05,$$P<0.01 vs 2-APB
2.6 TFR及SOCE通道抑制剂对MCAO大鼠脑组织中STIM1、STIM2、Orai1、caspase-3、PKB mRNA表达水平的影响如Fig 6所示,与Sham组相比,MCAO组脑组织STIM1、STIM2、Orai1、caspase-3 mRNA表达明显升高(P<0.01),PKB mRNA表达明显降低(P<0.01);TFR组相较于MCAO组脑组织STIM1、STIM2、Orai1、caspase-3 mRNA表达明显降低(P<0.05),PKB mRNA明显升高(P<0.05);与TFR组或2-APB组相比,TFR+2-APB组脑组织STIM1、STIM2、Orai1、caspase-3 mRNA表达明显降低(P<0.05),PKB mRNA表达明显升高(P<0.05)。
3 讨论
卒中是造成全球成年人永久残疾的最常见原因之一,可能会导致视觉、感觉和运动行为障碍。尽管组织型纤溶酶原激活剂已被批准用于卒中治疗20多年,但很少有卒中患者真正得到根本性治愈[8]。因此,研究脑卒中的病理分子机制与筛选出具有神经保护作用的新型抗脑卒中药物已成为现代中医药的重要课题之一。TFR是一种黄酮类化合物,本课题组前期研究表明,TFR具有减轻脑水肿、舒张血管、增加脑血流量等抗缺血性脑卒中作用[5]。
脑缺血可引发炎症反应,导致小胶质细胞活化,从而产生更多的细胞毒物质,包括IL-1、IL-6、TNF-α和其他促炎症介质,进一步导致神经元损伤[9]。研究表明,无论何种原因导致内质网中Ca2+水平下降而引起细胞Ca2+内流的方式被称为SOCE[10]。SOCE可以利用内质网Ca2+耗竭作为激活信号,促进Ca2+内流,以响应内质网Ca2+的释放。并且导致缺血/缺氧性神经元死亡的主要机制之一是钙超载[11]。2-APB是G蛋白偶联SOCE通路特异性阻断剂[12]。本课题组研究结果显示,用药TFR后,原本升高的MCAO大鼠神经功能评分及血清中IL-1、IL-6及TNF-α含量明显降低,脑组织病理损伤明显改善,核溶解减轻,梗死灶明显减少,脑梗死率明显降低。而联用SOCE抑制剂2-APB阻断SOCE信号通路后,MCAO大鼠神经功能评分及血清中上述生化指标进一步降低,脑组织损伤进一步得到改善。表明,TFR与SOCE通道抑制剂2APB联用可以有效改善大鼠神经功能损伤,减少炎症因子的释放,进而保护受损神经元。
研究发现,SOCE通路由STIM和Orai共同介导[2]。目前已知STIM蛋白存在STIM1和STIM2两种亚型。Orai有三种异构体,即Orai1、Orai2和Orai3,它们形成介导Ca2+进入细胞的通道[10]。研究表明,与野生型小鼠相比,STIM1-/-和Orai1-/-骨髓嵌合体在MCAO诱导后24 h的梗死体积均明显减小[13]。而STIM2的上调引发了SOCE的增加,线粒体Ca2+超载[14]。在短暂MCAO模型中,用SOCE特异性阻滞剂2APB预处理可减轻野生型小鼠的脑损伤,与Orai1-/-骨髓嵌合体小鼠相似[12]。STIM1、STIM2、Orai1与缺血性脑损伤密切相关,而Orai2和Orai3尚不清楚[15-16]。PKB能够影响细胞的存活、增殖和抑制细胞的凋亡,以维持神经系统正常功能。caspase-3作为细胞凋亡的执行者,在细胞凋亡途径中发挥重要作用,它的激活预示着细胞的死亡。为了进一步研究TFR减轻大鼠脑缺血/再灌注损伤作用与SOCE信号通路之间的关系。我们通过Western blot和RT-qPCR分别观察了TFR对大鼠脑组织中SOCE信号通路相关信号分子STIM1、STIM2、Orai1的蛋白与mRNA表达及caspase-3、PKB的表达水平。结果显示,MCAO组相较于Sham组,大鼠脑组织中STIM1、STIM2、Orai1、caspase-3的蛋白及mRNA表达均明显升高,PKB的蛋白及mRNA表达明显降低,此结果与Lang等[17]报道基本一致。而用药TFR后,TFR明显下调了大鼠脑组织中STIM1、STIM2、Orai1、caspase-3的蛋白及mRNA表达,上调了PKB的蛋白及mRNA表达。而联用2-APB后,STIM1、STIM2、Orai1、caspase-3的基因表达进一步下调,PKB的基因表达进一步上调。表明,TFR与SOCE通道特异性阻断剂2-APB联用可增强抑制SOCE通道基因表达的作用。提示,TFR减轻MCAO大鼠缺血/再灌注脑损伤的作用可能与其抑制脑组织SOCE信号通道,减少细胞凋亡,促进细胞存活有关。
综上,在急性脑缺血损伤发生时,TFR可能通过抑制脑组织SOCE信号通路,降低钙超载,减少炎症介质释放和细胞凋亡,促进细胞存活,从而发挥脑神经保护作用。鉴于中药复方制剂的作用机理多为多靶点、多通道、多层次,结合课题组前期研究成果[18],我们推测,TRPV4通道、SOCE信号通路或一些其他信号通路可能均参与了TFR减轻MCAO大鼠脑缺血/再灌注损伤的保护作用,其深入的机制还有待于进一步研究。