四君子汤含药血清对IEC-6细胞增殖及多胺调控NPM及p53表达的影响
2021-12-15涂小华杨光勇徐萌萌何光志
涂小华,杨光勇,杨 欣,徐萌萌,邓 颖,何光志,王 慧
(贵州中医药大学 1.机能实验室,2.微生物教研室,贵州 贵阳 550025)
胃肠黏膜屏障对机体有很重要的保护作用,胃酸、非甾体类抗炎药、氧化应激、炎症等均可引起胃肠黏膜损伤。黏膜损伤后,机体将启动黏膜快速修复过程,包括黏膜损伤早期修复(细胞迁移),细胞增殖、黏膜重构等过程,该过程受到多个信号通路的调控,多胺(包括腐胺、精脒及精胺)为其重要调控因素之一。众多研究表明,不管是生理还是病理情况下,多胺对胃肠道黏膜生长过程中是必不可少的,减少细胞内多胺将抑制上皮细胞增殖并破坏上皮黏膜的完整性[1-2]。核仁磷酸蛋白(nucleophosmin,NPM)是一种细胞核仁的磷蛋白,对细胞增殖有重要的调控作用;p53基因主要调控细胞周期,细胞凋亡等过程;多胺可通过下调NPM及p53表达而促进小肠上皮细胞增殖[3-5]。
四君子汤为临床常用方,源于宋代《太平惠民和剂局方》,由人参、白术、茯苓、甘草等比例组方,具有益气健脾之功效,该方为临床治疗脾虚证的代表方剂。目前研究发现,四君子汤可调控多胺信号通路钙离子上下游指标而促进小肠上皮细胞迁移[6-8],可影响多胺及黏膜屏障相关蛋白而发挥防治胃肠黏膜损伤作用[9]。上皮细胞增殖是黏膜损伤后修复的重要环节之一,四君子汤可上调c-Myc而促进小肠上皮细胞增殖[10],但其促进上皮细胞增殖的具体作用机制尚未明确,本研究通过观察四君子汤对IEC-6细胞增殖、细胞内多胺含量、多胺信号通路NPM、p53 mRNA及蛋白表达的影响,探讨四君子汤促进小肠上皮细胞增殖的作用机制,为研究四君子汤修复胃肠黏膜损伤作用提供参考。
1 材料与方法
1.1 材料
1.1.1细胞株 IEC-6细胞(大鼠小肠上皮细胞),购自上海中乔新舟生物科技有限公司(生产单位:美国Sciencell公司),货号:ZQ0783。
1.1.2实验动物 健康SD大鼠20只,♀♂各半,体质量(200±20)g,由长沙市天勤生物技术有限公司提供,实验动物质量合格证号:11072622011001638,实验动物生产许可证号:SCXK(湘)2019-0014,所有动物实验研究均符合中国伦理委员会有关动物研究指导原则,实验动物饲养在避光、通风环境中,实验温度(22±2)℃,相对湿度45%-50%,饲料由长沙市天勤生物技术有限公司提供。适应性喂养1 周后用于制备含药血清。
1.1.3药物及试剂 人参、茯苓、炒白术、炙甘草等实验用中药材均购自北京同仁堂(贵阳分店);胎牛血清(批号:1606F,澳大利亚Bovogen Biological公司);青霉素-链霉素双抗(批号:20200211),高糖DMEM(批号:20200310),胰酶(批号:20191030),均为赛澳美细胞技术(北京)有限公司产品;腐胺(putrescine,PUT,货号:D13208-25G),精脒(spermidine,SPD,货号:S2626-1G),均为美国sigma公司产品;α-二氟甲基鸟氨酸(α-Difluoromethylornithine,DFMO,货号:288500-25MG-M,德国Calbiochem公司),MTT(批号:1015D058),BCA蛋白浓度测定试剂盒(货号:PC0020),彩虹180广谱蛋白Marker(批号:1120B021),均为北京索莱宝科技有限公司产品;RIPA裂解液(货号:P0013B),PMSF(货号:ST506),SDS-PAGE凝胶试剂盒(货号:P0012A),5×蛋白上样缓冲液(货号:P0285),均为碧云天生物技术公司产品;ECL化学发光液(货号:1705060,美国 Bio-Rad公司);β-actin一抗(货号:4970S),GAPDH一抗(货号:5174S),p53一抗(货号:2524S),NPM一抗(货号:3542S),均为美国CST公司产品;山羊抗兔二抗(批号:GR3321256-7,英国abcam公司);RNA提取试剂盒(货号:9767),逆转录试剂盒(批号:AJ92011A),PCR荧光染料(批号:AJE1687A),宝日医生物技术(北京)有限公司。
1.1.4主要仪器 RE-5203旋转蒸发器(上海亚荣生化仪器厂);3111 CO2培养箱,Multiskan go酶标仪,Nanodrop lite超微量紫外可见光分光光度计,Multifuge X1R离心机,均为美国Thermo Scientific公司产品;N-EVAP-111氮吹仪(美国 Organomation公司);ZORBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),Agilent 1260高效液相色谱系统,均为美国Agilent technologies公司产品;DMil倒置相差显微镜(德国徕卡公司);TC-96/G/H(b)梯度PCR仪(杭州博日科技有限公司);CFX96荧光定量PCR仪,Power PacTMBasic电泳仪,ChemicDocTMXRS+凝胶成像仪,均为美国 Bio-Rad公司产品。
1.2 方法
1.2.1四君子汤含药血清的制备 人参、茯苓、炙甘草、炒白术各75 g,药材打粉(不宜过细),12倍量水浸泡2 h后文火煎煮提取2 h,纱布过滤,收集滤液;同法再煎煮1次;2次滤液合并后减压浓缩至含生药量为1 mg·L-1的四君子汤水提液。将SD大鼠随机分为四君子汤组(灌胃四君子汤水提液,给药剂量13 g生药·kg-1·d-1)及空白组(灌胃等体积生理盐水),每组10只。每天灌胃2次,连续4 d,d 4一次性灌胃全天剂量,给药2 h后乙醚麻醉,腹主动脉采血,血样静置2 h后,3 000 r·min-1离心15 min,分离血清,混匀同组血清,56 ℃灭活30 min,以0.22 μm 微孔滤膜过滤后分装,得空白血清及四君子汤含药血清,-20 ℃低温冰箱保存备用。临用前以含0.5%胎牛血清的DMEM将空白血清稀释成10%(体积分数)空白血清培养基,将SJZDS分别稀释成5%、10%及20%四君子汤含药血清培养基备用。
1.2.2IEC-6细胞培养及MTT法检测细胞增殖 参照文献方法[6]进行细胞培养,IEC-6细胞以浓度为5×107个·L-1接种于96孔板,每孔200 μL,培养基为5%胎牛血清的DMEM,培养24 h,弃培养液,参照文献方法[11-12]加入无血清的DMEM血清饥饿24 h后,空白对照组每孔加入200 μL含10%空白血清培养基,阳性对照组加入200 μL含PUT(终浓度10 μmol·L-1)的10%空白血清培养基,SJZDS低、中、高剂量组分别加入200 μL 5%、10%及20% SJZDS含药血清培养基;DFMO负荷实验中,除空白对照组外,其余各组均在上述给药方法基础上加入2.5 mmol·L-1的DFMO,DFMO组加入含DFMO(终浓度2.5 mmol·L-1)的10%空白血清培养基;分别培养24、48及72 h,每孔加入20 μL MTT(5 g·L-1),37 ℃避光孵育4 h后,弃培养液,各孔加入150 μL DMSO,室温振荡10 min,酶标仪490 nm 波长检测吸光度A值,计算细胞增殖率,细胞增殖率/%=实验组A值/对照组A值×100%。每组5-6个复孔,重复3次独立实验。
1.2.3HPLC法检测细胞内多胺(PUT及SPD)含量 IEC-6细胞以浓度为8×107个·L-1接种于6孔板,每孔2.5 mL,血清饥饿及给药方法同“1.2.2”(培养基体积为2.5 mL),每组6个复孔,2个复孔合并为一个样品;给药24 h后,参照文献方法[7]收集细胞内多胺并将其衍生化,按其色谱条件检测细胞内PUT及SPD含量,多胺含量=细胞样品中多胺含量(nmol)/细胞样品中细胞数。重复3次独立实验。
1.2.4荧光定量PCR法检测NPM及p53 mRNA表达 IEC-6细胞以浓度为8×107个·L-1接种于6孔板,每孔2.5 mL,血清饥饿及给药方法同“1.2.2”(培养基体积为2.5 mL);给药培养48 h后,RNA提取试剂盒提取各组细胞总RNA,立即检测RNA纯度及浓度,采用逆转录试剂盒(去基因组DNA)将各组样品逆转录为cDNA,其反应条件:37 ℃ 15 min,85 ℃ 5 s,所得cDNA样品加入荧光染料及引物后,在荧光定量PCR仪上进行PCR反应,反应条件为:25 μL反应体系,95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。结果以β-actin作为内参基因,采用2-ΔΔCT法计算NPM及p53 mRNA相对表达量。每组3个复孔,重复3次独立实验。引物合成由生工生物工程(上海)股份有限公司完成,见Tab 1。

Tab 1 Primer sequence for qPCR
1.2.5Western blot 法检测NPM及p53蛋白表达 IEC-6细胞以浓度为8×107个·L-1接种于6孔板,每孔2.5 mL,血清饥饿及给药方法同“1.2.2”(培养基体积为2.5 mL);给药培养48 h后,刮取细胞并用RIPA裂解液(临用前加PMSF)提取各组细胞总蛋白,BCA法测定总蛋白浓度,蛋白样品(加入上样缓冲液)沸水浴5 min制备蛋白印迹上样样品并进行SDS-PAGE凝胶电泳;电泳结束后,将胶及PVDF膜制备“三明治”,放入电转液中恒流300 mA转膜90 min;根据PVDF膜上的marker切膜,将膜放入5%脱脂奶粉中封闭1 h;分别用β-actin一抗,NPM一抗4 ℃孵育过夜(p53蛋白表达同法操作),洗膜3次,加入山羊抗兔二抗孵育1 h,洗膜3次;将PVDF膜浸没在ECL发光液中5 min后置于Chemic DocTMXRS+成像仪上成像,以β-actin或GAPDH作为内参,Image Lab软件分析NPM,p53蛋白条带灰度值。每组3个复孔,重复3次独立实验。

2 结果
2.1 SJZDS对正常或DFMO负荷下IEC-6细胞增殖的影响无负荷下实验结果见Fig 1,与空白对照组比较,给药24 h后,PUT及10%,20% SJZDS均可增加细胞增殖率(P<0.01),给药48 h、72 h后,PUT及5%、10%、20% SJZDS均可增加细胞增殖率(P<0.01),提示SJZDS对正常小肠上皮细胞增殖有促进作用,其药效与PUT相似。DFMO负荷实验结果见Fig 2,与空白对照组比较,给药48、72 h后,多胺合成抑制剂DFMO可降低细胞增殖率(P<0.01),表明多胺减少可抑制IEC-6细胞增殖;与DFMO组比较,给药48 h后,PUT及5%、10%、20% SJZDS均可逆转DFMO所致的细胞增殖率降低(P<0.01);给药72 h后,PUT及10%、20% SJZDS均可逆转DFMO所致的细胞增殖率降低(P<0.01),提示SJZDS可促进小肠上皮细胞增殖,该作用与影响多胺有关。
2.2 SJZDS对正常或DFMO负荷下PUT及SPD含量的影响无负荷下实验结果见Tab 2及Fig 3,与空白对照组比较,PUT及5%、10%、20%SJZDS可提高PUT含量(P<0.01),PUT及10%、20% SJZDS可增加SPD含量(P<0.05,P<0.01),提示SJZDS可增加正常小肠上皮细胞内PUT及SPD含量,其药效与PUT相似。DFMO负荷实验结果见Tab 3及Fig 4,与空白对照组比较,多胺合成抑制剂DFMO可降低PUT及SPD含量(P<0.01),表明多胺合成抑制剂可降低细胞内多胺含量;与DFMO组比较,PUT及10%、20% SJZDS可逆转DFMO所致的PUT及SPD含量的减少(P<0.01),提示SJZDS可提高小肠上皮细胞内多胺含量。

Tab 2 Effect of Sijunzi decoction-containing serum on contents of cellular PUT and n=3)

Tab 3 Effect of Sijunzi decoction-containing serum on contents of cellular PUT and SPD loaded by n=3)

Fig 1 Effect of Sijunzi decoction-containing serum on **P<0.01 vs Control group

Fig 2 Effect of Sijunzi decoction-containing serum on IEC-6 cell proliferation loaded by n=6)**P<0.01 vs Control group;##P<0.01 vs DFMO group

Fig 3 Effect of Sijunzi decoction-containing serum on contents of cellular PUT and n=3)
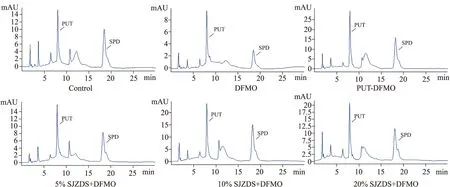
Fig 4 Effect of Sijunzi decoction-containing serum on contents of cellular PUT and SPD loaded by n=3)
2.3 SJZDS对正常或DFMO负荷下NPM mRNA及蛋白表达的影响Fig 5结果显示,与空白对照组比较,PUT,5%、10%、20% SJZDS均可降低NPM mRNA及蛋白表达(P<0.05,P<0.01)。Fig 6结果显示,与空白对照组比较,DFMO可提高NPM mRNA及蛋白表达(P<0.01);与DFMO组比较,PUT,5%、10%、20% SJZDS可逆转DFMO所致的NPM mRNA及蛋白表达升高(P<0.01)。提示SJZDS可降低NPM mRNA及蛋白表达,且该作用与影响多胺有关。
2.4 SJZDS对正常或DFMO负荷下p53 mRNA及蛋白表达的影响Fig 7结果显示,与空白对照组比较,PUT,10%、20% SJZDS可降低p53 mRNA表达(P<0.01),PUT,5%、10%、20% SJZDS可抑制p53蛋白表达(P<0.01)。Fig 8结果显示,与空白对照组比较,DFMO可提高p53 mRNA及蛋白表达(P<0.01);与DFMO组比较,PUT,5%、10%、20% SJZDS可逆转DFMO所致的p53 mRNA及蛋白表达升高(P<0.05,P<0.01)。提示SJZDS可降低p53 mRNA及蛋白表达,且该作用与影响多胺有关。

Fig 5 Effect of Sijunzi decoction-containing serum on expression of NPM mRNA and n=3)1:Control;2:PUT;3:5%SJZDS;4:10%SJZDS;5:20%SJZDS;*P<0.01,**P<0.01 vs Control group

Fig 6 Effect of Sijunzi decoction-containing serum on expression of NPM mRNA and protein loaded by n=3)1:Control;2:5%SJZDS+DFMO;3:10%SJZDS+DFMO;4:20%SJZDS+DFMO;5:PUT+DFMO;6:DFMO;**P<0.01 vs Control group;##P<0.01 vs DFMO group
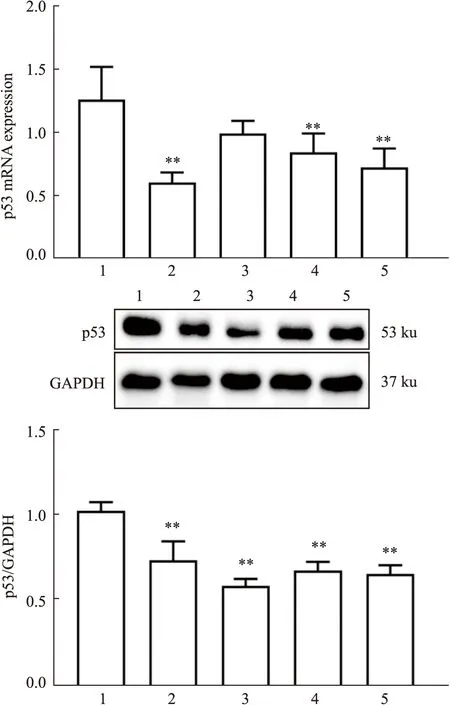
Fig 7 Effect of Sijunzi decoction-containing serum on expression of p53 mRNA and n=3)1:Control;2:PUT;3:5%SJZDS;4:10%SJZDS;5:20%SJZDS;**P<0.01 vs Control group

Fig 8 Effect of Sijunzi decoction-containing serum on expression of p53 mRNA and protein loaded by n=3)1:Control;2:5%SJZDS+DFMO;3:10%SJZDS+DFMO;4:20%SJZDS+DFMO;5:PUT+DFMO;6:DFMO;**P<0.01 vs Control group;#P<0.05,##P<0.01 vs DFMO group
3 讨论
四君子汤为治疗脾虚证的经典方剂,临床常用其加减方或结合其他药物治疗脾虚证相关的黏膜病变,该方可显著改善患者的脾胃功能,缓解消化性溃疡患者症状,促进病灶愈合[13-14]。四君子汤上述功效的发挥与其修复胃肠黏膜损伤的作用有关。有研究表明,四君子汤可通过促进上皮细胞迁移而修复胃肠黏膜损伤,其作用机制与影响多胺信号通路有关[7],该通路是维持胃肠黏膜完整性的重要信号通路之一。本研究从上皮细胞增殖角度探讨四君子汤的作用机制,给药24、48及72 h后,SJZDS可促进正常小肠上皮细胞(非分化、非瘤性)增殖,该作用与文献[10]结果相似;多胺合成抑制剂DFMO可阻断鸟氨酸脱羧酶(多胺合成限速酶)活性,降低多胺的生物合成,DFMO对IEC-6细胞增殖具有明显的抑制作用,给药48 h及72 h后,SJZDS可逆转DFMO对细胞增殖的抑制作用,表明四君子汤促进小肠上皮细胞增殖的作用可能与影响多胺有关。为进一步探讨在细胞增殖过程中四君子汤与多胺信号通路的关系,本研究采用高效液相色谱法检测给药24 h后细胞内多胺含量,结果发现SJZDS可提高细胞内PUT及SPD含量,且还可逆转DFMO所致的PUT及SPD含量的降低,进一步表明四君子汤促进小肠上皮细胞增殖作用与影响多胺有关。
在转录水平,p53蛋白对影响细胞生长及细胞凋亡的相关基因有重要的调控作用,多胺对转录后p53基因的表达有负调控作用,p53蛋白下调可促进小肠黏膜生长。多胺减少可稳定p53 mRNA而提高p53 mRNA及蛋白的表达,此外,多胺合成减少还可抑制Mdm2的表达,减少Mdm2与p53复合物的形成而降低p53蛋白的降解,p53蛋白表达升高可提高细胞周期阻滞基因(如p21)转录而抑制上皮细胞增殖,最终抑制小肠黏膜的生长[3,5,15]。本研究结果发现,SJZDS不仅可降低p53 mRNA及蛋白表达,还可逆转DFMO所致的p53 mRNA及蛋白表达升高,提示四君子汤可负调控p53 mRNA及蛋白的表达,该作用与影响多胺有关。NPM是一个多功能磷蛋白,具有组装核糖体及转运蛋白的作用,通过与细胞内不同蛋白结合而调控这些蛋白的活性。天然多胺类对小肠上皮细胞生长有重要调控作用。已有研究表明,NPM为小肠上皮细胞增殖的负调控因子之一,多胺合成减少可提高NPM基因及蛋白表达,NPM与p53相互作用而增加NPM/p53复合物的形成,最终稳定p53表达而抑制肠上皮细胞增殖。此外,靶向NPM的小分子干扰RNA抑制NPM表达后,p53蛋白稳定性下降,最终抑制p21活性而促进上皮细胞增殖[4]。本研究结果发现,SJZDS对NPM mRNA及蛋白表达具有抑制作用,且可逆转多胺合成抑制剂DFMO所致的NPM mRNA及蛋白表达增加,提示四君子汤对NPM有负调控作用,该作用与影响多胺有关。
有研究采用HPLC-MS分析四君子汤水煎液及其含药血清化学成分,发现四君子汤水煎液及其含药血清中的有效成分主要来源于人参及甘草,人参主要以原型化学成分,甘草则以水解产物的形式存在于在血液中[16]。结合前期研究结果,四君子汤多糖可通过影响多胺而促进胃肠黏膜损伤修复[7],四君子汤多糖、人参及甘草的主要有效成分等可能是四君子汤促进小肠上皮细胞增殖的药效物质基础,有待进一步明确。另有研究表明,甘草可通过影响HuR介导的转录后调控,降低p21及p53 mRNA的稳定性而促进IEC-6细胞增殖[17]。RNA结合蛋白HuR是转录后调节中的重要调节因子之一,对许多基因的mRNA稳定性有调节作用,复方四君子汤下调p53 mRNA表达的作用是否与影响HuR介导的转录后调控,降低p53 mRNA稳定性有关,有待进一步探讨。
综上所述,四君子汤可通过增加细胞内多胺含量,下调生长相关基因NPM及p53表达而促进小肠上皮细胞增殖;多胺合成抑制剂DFMO则降低细胞内多胺含量,上调NPM及p53 mRNA及蛋白表达而抑制小肠上皮细胞增殖,四君子汤可逆转DFMO的作用。结合前期研究表明,四君子汤可通过促进小肠上皮细胞迁移及细胞增殖而修复胃肠黏膜损伤,多胺信号通路为其作用靶点之一。后续考虑考察四君子汤对多胺信号通路NPM与p53相互作用及其他生长相关基因的调控机制及药效物质基础,并结合胃肠黏膜损伤动物实验,进一步探讨四君子汤促进胃肠黏膜上皮细胞增殖的作用机制,为研究四君子汤修复胃肠黏膜损伤作用提供参考。