白藜芦醇苷通过MAPK和Nrf2/HO-1通路减轻LPS引起的炎症反应
2021-12-15沙前坤李玉先
杨 君,沙前坤,李玉先,陈 瑾,龙 馨,颜 丽,张 华
(1.重庆市妇幼保健院宫颈疾病诊治中心,重庆 400021;2.重庆央都生物研究院药学部,重庆 408000;3.重庆医科大学北碚附属医院,重庆 400700;4.重庆市中医院药剂科,重庆 400011;5.重庆医科大学附属第一医院皮肤科,重庆 400016)
炎症是天然免疫反应的关键因素,可以减轻组织损伤。但是炎症持续时间过长,组织损伤程度会加重[1-2]。研究表明LPS是革兰氏阴性菌外膜内毒素的致病成分,能够激活多种信号通路,如免疫和炎症反应的紊乱等[3]。白藜芦醇苷(piceid,PD)是从传统中药虎杖中提取的单体化合物,近年来研究发现,PD具有多种重要的生物学功能,如抗氧化、抗血栓形成等。以PD作为主要活性成分的虎黄烧伤搽剂(生产厂家:重庆喜旋生物科技有限公司,规格:50 mL/瓶,批准文号:国药准字Z20010151)能够促进创面愈合,调控机体免疫能力。然而其在抗炎作用中的研究机制尚未阐明。本研究旨在探究PD在LPS引起的炎症反应中的影响及分子机制,为揭示PD的治疗机制以及其在临床用药中的运用提供理论基础。
1 材料与方法
1.1 材料PD(批号:09042022)购自美国LKT实验室,用二甲基亚砜(DMSO)(购自国药集团化学试剂有限公司)溶解配制成10 mmol·L-1的贮存液储藏于-20 ℃冰箱。抗体Anti-JNK1/2兔抗人单克隆抗体、Anti-ERK1/2鼠抗人单克隆抗体购自Abcam公司,Anti-p38MAPK、Anti-p-JNK1/2、Anti-p-ERK1/2和Anti-p-p38MAPK兔抗人单克隆抗体购自美国Cell Signaling公司。ELISA试剂盒购自Abcam公司;RPMI 1640培养液、DMEM培养液和胎牛血清均购自美国Gibco公司,BCA蛋白定量检测试剂盒购自Bio-Rad公司,细胞裂解液RIPA购自碧云天生物技术有限公司。羊抗兔IgG、羊抗鼠IgG均购自美国Santa Cruz公司,引物序列由上海生物工程有限公司合成。
1.2 方法
1.2.1细胞培养 RAW264.7(小鼠巨噬细胞)细胞系来自中国科学院细胞库。细胞系在DMEM高糖正常培养基(包括10% FBS、100 kU·L-1青霉素和100 g·L-1链霉素)在加湿5% CO237 ℃培养箱中培养。
1.2.2MTT 采用MTT法测定细胞活力。将1×105RAW264.7细胞接种于96孔板中,培养过夜,然后用PD(0、1.0、3.0、5.0 μmol·L-1)处理48 h,每孔加入MTT(5 g·L-1),培养3 h。然后去除培养基,用DMSO(100 μL/孔)溶解结晶紫,最后用酶标仪在570 nm处测定。
1.2.3Western blot 将RAW264.7细胞接种,过夜培养。LPS(1 mg·L-1)诱导2 h,在指示时间点PD(20、40、80 μmol·L-1)进行预处理。用RIPA (1% PMSF和1% DTT)提取总细胞蛋白,提取细胞质和核蛋白。采用BCA蛋白试剂盒测定蛋白质浓度,变性蛋白用SDS-PAGE凝胶分离并转移到PVDF膜。用5%脱脂牛奶室温封闭PVDF膜1 h,PVDF膜与一抗(1 ∶1 000)4 ℃过夜孵育。之后用TBST洗涤,并与二抗(1 ∶5 000)在室温下孵育2 h。利用Bio-Rad发光试剂盒与Chemi DocTMMP成像系统采集图像。
1.2.4 流式细胞仪检测密度为1.5×105RAW264.7细胞接种于24孔板过夜。用PD预处理细胞1 h,然后用LPS(1 mg·L-1)处理2 h。用不同的探针检测相应的指标,包括NO检测器DAF-FM (5 μmol·L-1,1 h),ROS检测器DCFH2-DA(10 μmol·L-1,30 min),Ca2+检测器Fluo-3/AM(1 μmol·L-1,1 h)或MMP 检测器JC-1(10 mg·g-1,30 min)。探针孵育后,用流式细胞仪(BD,美国)采集细胞并进行检测。
1.2.5免疫荧光染色 RAW264.7细胞以1.5×108个·L-1的密度接种到共聚焦培养皿中过夜,用PD预处理4 h,并用LPS刺激(1 mg·L-1)预处理2 h。固定、打孔、封闭后,将培养皿中的细胞与抗体在4 ℃下孵育过夜。最后将细胞与Alexa Fluor 594二抗孵育1 h。Hoechst 33342染色显示细胞核。在共聚焦显微镜系统(Leica,Wetzlar,德国)下收集荧光图像。
1.2.6ELISA 按照说明书准备所有试剂,工作标准液和样品。将50 μL所有样品或标准液加到适当的孔中。在每个孔中加入50 μL抗体混合物。密封板并在设置为400 r·min-1的振荡器上于室温孵育1 h。用350 μL 1×Wash buffer PT清洗3次。晾干以除去多余的液体。每孔中加入100 μL TMB显影液,并在避光中在设置为400 r·min-1的平板振荡器上孵育10 min。每孔中加入100 μL终止溶液。在平板振荡器上将平板摇晃1 min以进行混合记录450 nm处的OD。
1.2.7荧光测定 RAW264.7细胞以4×108个·L-1的密度过夜接种于96孔板中。用PD预处理细胞1次,然后在有或没有LPS的情况下再孵育2 h。用JC-1(10 mg·L-1)和DCFH2-DA(100 μmol·L-1)染色30 min。最后通过荧光显微镜捕获荧光图像。
2 结果
2.1 PD减少LPS引起的炎症反应利用MTT试验,计算不同浓度的PD(1.0、3.0、5.0 和7.0 μmol·L-1)处理后的细胞生存率,结果提示不同浓度的PD处理细胞48 h后,细胞的存活率分别为(98.56%、96.51%、96.56%、87.24%)。因此,在后续实验中将选用浓度1.0-5.0 μmol·L-1。
利用流式细胞术检测PD对于上述指标的影响,发现PD预处理呈剂量依赖性的方式抑制LPS刺激的亚硝酸盐水平和iNOS蛋白的表达。如Fig 1所示,LPS处理的细胞亚硝酸盐水平急剧升高。流式细胞术检测表明,PD可以减少细胞NO生成。COX-2蛋白的表达无影响。
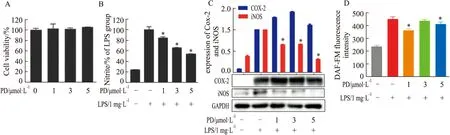
Fig 1 PD reduced LPS-induced inflammatory A:PD cytotoxicity in RAW264.7 cells;B:PD reduced the inflammatory response;C:Effect of PD on the expression of COX-2 and iNOS;D:Flow cytometry detection and analysis.*P<0.05 vs LPS group
2.2 PD减少LPS诱导的促炎细胞因子的表达利用ELISA检测PD处理后相关因子的水平,结果显示,LPS诱导促炎细胞因子TNF-α和IL-6的产生(Fig 2)。同时,用PD预处理可明显抑制LPS处理后TNF-α和IL-6的产生。
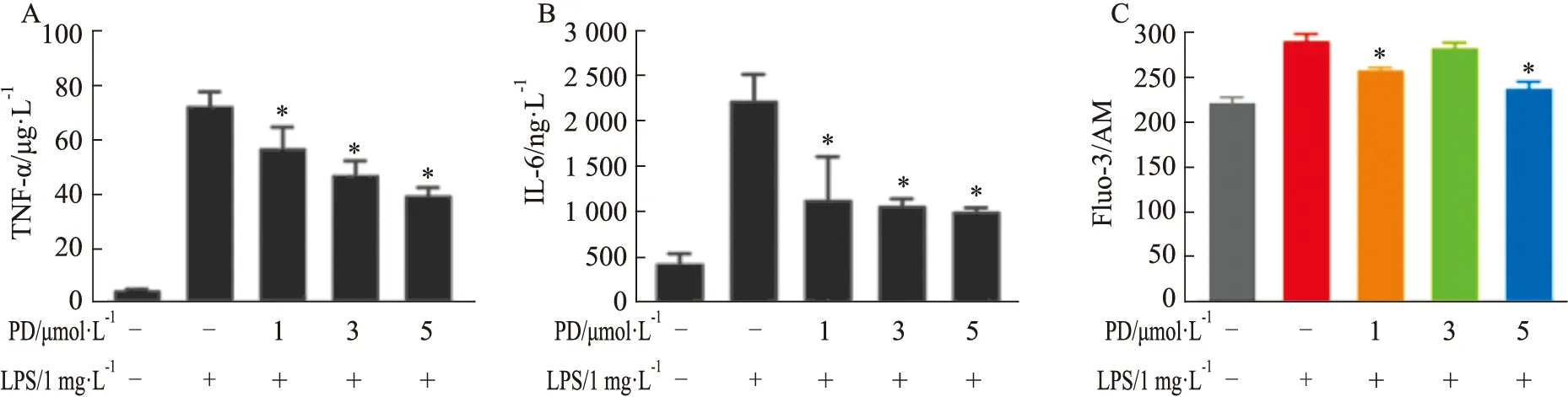
Fig 2 PD reduced expression of LPS-induced pro-inflammatory A、B:ELISA of TNF-α and IL-6 levels;C:Flow cytometry analysis of Fluo-3/AM labeled cells.*P<0.05 vs LPS group
2.3 PD对于MAPK和Nrf2/HO-1通路的影响利用蛋白印记方法检测MAPK和Nrf2/HO-1通路相关蛋白表达,如Fig 3所示,PD明显抑制 p-JNK1/2、p-ERK1/2和p-p38MAPK的蛋白水平,但对JNK1/2、ERK1/2和p38MAPK总量的表达无影响。

Fig 3 Effect of PD on MAPK and Nrf2/HO-1 *P<0.05 vs LPS group
2.4 PD抑制活性氧的生产和降低线粒体膜电位利用DCFH2-DA检测ROS的产生,结果表明,PD明显抑制LPS诱导的RAW264.7细胞ROS生成(Fig 4A)。

Fig 4 PD inhibited production of reactive oxygen species and reduced mitochondrial membrane A、B、C:Immunofluorescence and intracellular ROS kit to detect intracellular ROS production;D:JC-1 probe to detect cell mitochondrial membrane potential (MMP).*P<0.05 vs LPS group.
另外还采用免疫荧光法和细胞内ROS试剂盒检测细胞内ROS的产生。结果表明,PD降低了细胞内ROS水平(Fig 4B、C)。LPS破坏线粒体膜电位(MMP)的稳定性,不利于维持细胞正常的生理功能。本研究利用免疫荧光染色发现通过LPS刺激(绿色染色)增加JC-1单体,但PD的预处理降低了JC-1单体,使其恢复为聚集体(红色荧光)(Fig 4D)。
2.5 PD对Keap1-Nrf2信号通路的影响研究表明,LPS可激活巨噬细胞中的Nrf2信号通路。在本研究检测PD对Keap1-Nrf2信号通路的影响。如Fig 5所示,LPS刺激可诱导Keap1表达上调,而PD预处理则Keap1蛋白表达略有下调。用PD预处理可增加RWA264.7细胞中Nrf2和HO-1蛋白的表达。与NC和LPS刺激组相比,PD的预处理提高了细胞核中Nrf2蛋白水平,但降低了细胞质中的蛋白水平。

Fig 5 Effect of PD on Keap1-Nrf2 signaling A:Keap1,Nrf2y and HO-1 level detection;B:Nuclear and cytoplasmic Nrf2 level detection;C:Quantitative analysis of differences in Keap1,Nrf2y and HO-1 level of each group).*P<0.05 vs LPS group
2.6 Toll样受体参与PD的抗炎过程在多个细胞上特异性发现的TLR4在炎症过程中起着重要的作用。在LPS和MD2存在下,TLR4二聚,调节NF-κB、MAPK和其他信号级联,通过促炎细胞因子释放诱导病原体特异性天然免疫反应。为了评价TLR4是否参与PD的抗炎过程,采用蛋白印迹检测不同浓度PD处理后TLR4的表达情况。我们的结果表明,PD减弱了LPS诱导的TLR4的表达(Fig 6)。

Fig 6 Toll-like receptors involved in anti-inflammatory *P<0.05 vs LPS group
3 讨论
炎症反应是生命中常见的病理反应,存在于各种组织和器官中[1]。炎症与许多疾病的发生和发展过程有关,包括中风、关节炎、神经退行性疾病和心血管疾病等[2]。因此,抑制炎症在炎症相关疾病治疗中起关键作用。PD具有多种重要的生物学功能,如抗氧化、抗血栓形成等,然而其抗炎作用的研究还相对较少。基于传统中药研究的经验,PD的药用价值使其被添加到越来越多的成药中。具有代表性的成药虎黄烧伤搽剂,以PD为主要活性成分,其治疗烧伤效果显著,主要的适应症为严重烧伤引起的休克和细菌感染等。本文旨在进一步探索PD抗炎作用的分子机制,为拓展其临床应用打下理论基础。
本研究采用LPS诱导的RAW264.7细胞炎症模型,发现PD减少LPS引起的炎症反应,并减少LPS诱导的促炎细胞因子的表达。而且大量证据表明与TLR4结合的LPS可以激活许多炎症途径,如MAPKs途径[2-6]。据报道TLR4和MAPKs信号通路参与炎症反应[6]。在LPS诱导的RAW264.7细胞中增强JNK1/2、p38、ERK1/2的磷酸化[7]。本研究显示PD明显抑制了JNK1/2、p38、ERK1/2的磷酸化,而没有改变总JNK1/2、p38、ERK1/2蛋白质水平的激活。此外,我们的结果表明TLR4参与PD的抗炎过程。综上所述,PD通过介导NF-κB和MAPKs途径表现出抗炎作用。
文献报道ROS的产生介导了各种炎症信号通路,从而促进了炎症反应[8]。MMP以及ROS45也是重要的炎症反应信号。因此抑制ROS或促进MMP可能也是炎性疾病最重要的治疗靶点[9]。本研究发现,PD明显降低了ROS的产生并恢复了线粒体膜电位,从而减轻了炎症反应。
越来越多的证据表明,HO-1是一种抗氧化酶,在血红素降解中起着至关重要的作用,是氧化应激和炎症细胞病理生理条件的重要机制[8]。本研究结果表明,用PD预处理可降低Keap1表达,促进Nrf2核易位并在体外诱导HO-1。更有文献报道Nrf2作为调节HO-1表达的主要蛋白,通常与Keap1一起分布在细胞质中。但是,当Keap1在氧化应激下降解时,Nrf2释放并迁移到细胞核,然后诱导HO-1表达[9-11]。
LPS诱导其下游通路的活化可导致细胞分泌大量的炎症因子,同时使iNOS和NO表达增加。然而MAPKs在LPS诱导的细胞反应中起重要作用,研究发现LPS能够诱导激活MAPK通路。此外HO-1对于降低促炎COX-2和iNOS水平至关重要,这有助于减少COX-2衍生的PGE2和iNOS衍生的NO的产生[12]。HO-1是由Nrf2介导的,通过调节抗氧化反应,Nrf2在改善细胞氧化应激和炎症损伤方面起着至关重要的作用。在正常情况下,Nrf2位于细胞质中,其抑制蛋白是Keap1[13-14]。在应激条件下,Nrf2与Keap1解离,转运到细胞核中,与抗氧化反应元件结合,从而诱导Ⅱ期解毒酶和细胞保护基因,如HO-1[11,15-17]。综上,PD可能通过MAPK和Nrf2/HO-1通路对RAW264.7细胞表现出抗炎和抗氧化作用。因此,PD可以作为研究和开发炎性疾病的潜在药物。