羟基红花黄色素A通过激活自噬抑制ANG Ⅱ诱导的VAFs迁移
2021-12-15崔清卓刘博宇李颖云郑玉光安胜军李爱英赵京山
崔清卓,刘博宇,李颖云,郑玉光 ,安胜军,刘 玉,李爱英,赵京山,
(1.河北中医学院药学院,河北省中药炮制技术创新中心,2.河北中医学院科技处,3.河北省心脑血管病重点实验室,石家庄 050200)
动脉粥样硬化、冠心病、高血压、PTCA术后血管再狭窄等心血管疾病是威胁人类健康的头号杀手,致死率高,现已呈年轻化趋势[1],发病机制有待进一步研究。心血管疾病有相似的病理基础—血管重构,又称为血管重构性疾病,常表现为血管壁细胞异常活化、增殖及迁移。通常动脉粥样斑块出现在血管内膜,造成血管内膜狭窄,引发一系列病变,故一般认为血管病变“从内膜开始”,随着研究的深入,发现血管外膜也在血管病变中发挥着重要作用,有观点认为血管病变“由外而内”发生[2]。血管外膜成分复杂,包括成纤维细胞、间充质干细胞、祖细胞、巨噬细胞等,血管外膜成纤维细胞(vascular adventitial fibroblasts,VAFs)是血管外膜中最主要的细胞成分,对血管损伤最早做出反应,表现为异常活化,通过分泌多种细胞因子,如成纤维特异性因子1、血管紧张素转换酶1等参与血管重构,促进内膜增生,甚至迁移至血管内膜,直接参与血管重构[3-4]。抑制VAFs迁移有望成为治疗血管重构性疾病的新靶点。近年研究发现自噬与心血管疾病密切相关,研究显示自噬激活抑制内皮细胞或平滑肌细胞增殖、迁移进而改善动脉粥样硬化[5],然而自噬激活对血管外膜成纤维细胞迁移的作用未见报道。
心血管疾病如冠状动脉粥样硬化性心脏病,在中医中属于胸痹的范畴,是心脉痹阻所致,临床常用活血化瘀药治疗。而红花是常用的活血化瘀药之一。羟基红花黄色素A(hydroxysafflor yellow A,HSYA)是药典规定鉴定红花的标志物,是其活血化瘀的主要有效成分,在临床治疗心血管疾病中发挥着重要作用[6-7],研究显示HSYA对Ang Ⅱ诱导的大鼠VAFs增殖和胶原合成有抑制作用[8]。本实验主要探讨HSYA是否通过调控自噬抑制Ang Ⅱ诱导的VAFs迁移作用,为临床新药研发提供实验基础。
1 材料与方法
1.1 实验材料
1.1.1实验动物 6周龄雄性SD大鼠,清洁级,体质量160 g左右,购买于河北省实验动物中心,动物生产编号:IP07187。
1.1.2药品与试剂 羟基红花黄色素A(S26799,上海源叶生物科技有限公司);angiotensin Ⅱ(A9290-10,北京索莱宝公司);DMEM/F12培养基(01447,美国Gibco公司);胎牛血清(20050405,杭州四季青生物科技有限公司);CCK-8溶液(SB-CCK8S,上海圣尔生物有限公司);MDC染色试剂盒(南京凯基生物科技有限公司);GAPDH兔抗大鼠抗体(ab8245,英国Abcam公司);α-SMA兔抗大鼠抗体(CY5295,Abway抗体公司);Vimentin兔抗大鼠抗体(CY5134,Abways抗体公司);LC3(00084321,武汉三鹰生物技术有限公司);Beclin1兔抗大鼠抗体(00073614,武汉三鹰生物技术有限公司);p62兔抗大鼠抗体(00069958,武汉三鹰生物技术有限公司);IgG(H+L)HRP羊抗兔抗体(ab0101,Abway抗体公司)。
1.1.3实验仪器 超净工作台(SW-CJ-2FD,苏州安泰空气技术有限公司);细胞培养箱(311,赛默飞世尔科技有限公司)、酶标仪(VICTOR Nivo,德国Perkln Elmer公司);倒置显微镜、荧光显微镜(ECLIPSE Ts2,日本Nikon公司);高速离心机购于Eppendorf(Germany)公司;电泳、电转膜仪(1645050,美国Bio-Lad公司);多功能成像系统(Fusion FX5 Spectra,法国Vilber公司);
1.2 实验方法
1.2.1贴块法培养 VAFs 25%乌拉坦麻醉SD大鼠(腹腔注射给药:10 μL·g-1),使用高压灭菌的手术器械在无菌条件下剪去皮毛,逐层开腹,剪取胸主动脉,PBS清洗干净后,浸泡于培养基中,显微器械剪去周围脂肪组织及结缔组织剥净血管,纵向剖开,洗去血管内残留血迹,弯镊轻轻刮去内膜及中膜,将血管外膜剪成约1 mm2的小块贴于无菌培养皿中,待组织块贴牢且不能干透时,加入15%胎牛血清培养基(85% DMEM/F12培养基+15%胎牛血清+1%青霉素链霉素混合物),置于37 ℃,5% CO2细胞培养箱中培养,2-3 d即可爬出细胞,待细胞融合度达90%以上,去除组织块,采用胰酶消化法进行传代,选用第3代第6代细胞用于实验。
1.2.2免疫荧光鉴定VAFs 将细胞以5×104个/孔铺于提前放置有盖玻片的24孔板中,待细胞贴壁后,弃去上清,用PBS清洗两遍;加入0.25%Triton X 100,孵育5 min进行细胞打孔;PBS摇洗3遍,每次5 min;山羊血清封闭液37 ℃孵育30 min;兔抗鼠Vimentin、α-SMA抗体(1 ∶200)分别37 ℃孵育1 h;PBS摇洗3遍,每次5 min;驴抗兔CY3荧光抗体37 ℃避光孵育30 min;PBS摇洗3遍,每次5 min;用含DAPI的抗淬灭封片剂封片;于倒置荧光显微镜下观察,并拍照。
1.2.3CCK-8法建立Ang Ⅱ 量效和时效曲线 将细胞以3 000个/孔铺于96孔板,待细胞贴壁,长势稳定后,饥饿培养12 h,设置不同浓度梯度的Ang Ⅱ(0、10-4、10-5、10-6、10-7、10-8、10-9mol·L-1),每个浓度设置6个复孔,另外设置空白对照组(即不加细胞的溶剂对照组),各组加入100 μL含对应浓度Ang Ⅱ的培养基,细胞培养箱中孵育24 h,依据CCK-8试剂盒说明书,每孔加入10 μL CCK-8试剂,37 ℃孵育1 h后,酶标仪中测490 nm处吸光度值,并计算细胞活力(cell viability)。
细胞活力=(A给药组-A空白组)/(A正常组-A空白组)
将细胞以3 000个/孔铺于96孔板,待细胞贴壁,长势稳定后,饥饿培养12 h,采用含有量效曲线所确定最佳Ang Ⅱ浓度的培养基培养细胞,设置不同时间梯度,每个时间点设置6个复孔,另外设置空白对照组,分别于0、12、24、48 h后,每孔加入10 μL CCK-8,继续培养1 h后,于490 nm处检测吸光度值,计算细胞活力。
1.2.4CCK-8法建立HSYA量效和时效曲线 将细胞以3 000个/孔铺于96孔板,待细胞贴壁,长势稳定后,饥饿培养12 h,设置不同浓度梯度的HSYA(0、5、10、20、40、80、160、320 μmol·L-1),每个浓度设置6个复孔,另外设置空白对照组(即不加细胞的溶剂对照组),各组加入100 μL含不同浓度HSYA的含药培养基,于细胞培养箱中孵育24 h,每孔加入10 μL CCK-8试剂,37 ℃孵育1 h后,酶标仪中测490 nm处吸光度值,计算细胞活力。
将细胞以3 000个/孔铺于96孔板,待细胞贴壁后,饥饿培养12 h,设置不同时间梯度(0、12、24、48 h),每个梯度设置6个复孔,另外设置空白对照组,各组加入含有量效曲线所确定最佳HSYA浓度的培养基培养细胞,分别于0、12、24、48 h后,每孔加入10 μL CCK-8试剂,37 ℃继续培养1 h后,于490 nm处测吸光度值,计算细胞活力。
1.2.5细胞分组 细胞分为NC组,Ang Ⅱ组,Ang Ⅱ+HSYA组,Ang Ⅱ+ HSYA+Baf组,Ang Ⅱ+Baf组。各组细胞处理如下:除NC组给予正常培养基,余组均以含Ang Ⅱ 10-7mol·L-1培养基培养24 h,各给药组建立Ang Ⅱ诱导模型后,Ang Ⅱ组恢复正常培养基,3个药物治疗组分别给予含40 μmol·L-1HSYA,40 μmol·L-1HSYA+100 nmol·L-1Baf,100 nmol·L-1Baf的培养基,继续干预24 h。
1.2.6细胞划痕实验检测HSYA对Ang Ⅱ诱导的VAFs迁移的作用 将细胞以2×105个/孔铺于6孔板中,待细胞融合度达100%,饥饿培养12 h后,用黄枪枪头在6孔板中划痕,并拍照记录,记0 h,细胞处理如“1.2.5”,处理结束后,拍照记录,记24 h,随机取3个划痕视野计数单位面积内迁移的细胞个数,拍照后收集各组细胞提蛋白用作Western blot实验。
1.2.7MDC法检测自噬小体 将细胞以5×104个/孔铺于提前放置有盖玻片的24孔板,细胞处理如“1.2.5”,参照MDC试剂盒说明书进行,4%多聚甲醛室温固定25 min;1×Washing buffer清洗3遍;MDC染色工作液室温染色45 min;1×Washing buffer 清洗3遍;将Collection buffer滴于盖玻片上,于荧光显微镜下观察,并计数单位面积自噬斑点数量。
1.2.8Western blot实验 收集各组细胞,加入一定量蛋白裂解液(蛋白裂解液为RAPI ∶蛋白酶抑制剂=100 ∶1),冰上裂解30 min;离心:4 ℃,12 000 r·min-1,15 min;取上清,利用Lowrry法测定蛋白含量;按比例加入一定量4× Loading buffer,98 ℃,煮沸5 min;配制12% SDS-Page胶,每组蛋白上样约20 μg进行电泳,电泳条件设置为80 V,35 min,120 V,50 min;湿转法将蛋白电转至PVDF膜上,设置为300 mA,1 h 10 min;5%脱脂奶粉,常温孵育2 h;兔抗鼠一抗4 ℃孵育过夜;TBST洗膜,10 min/次,洗3次;山羊抗兔二抗常温孵育50 min;TBST洗膜,10 min/次,洗3次;条带浸泡于ECL发光液(A液 ∶B液=1 ∶1),进行化学发光,用Vision Capt进行数据分析。

2 结果
2.1 细胞培养与鉴定本实验成功从大鼠胸主动脉血管外膜中培养出VAFs,VAFs成梭形(Fig 1),并通过免疫细胞荧光实验检测VAFs的标志蛋白Vimentin表达阳性,平滑肌细胞标志蛋白α-SMA表达阴性(Fig 2)。
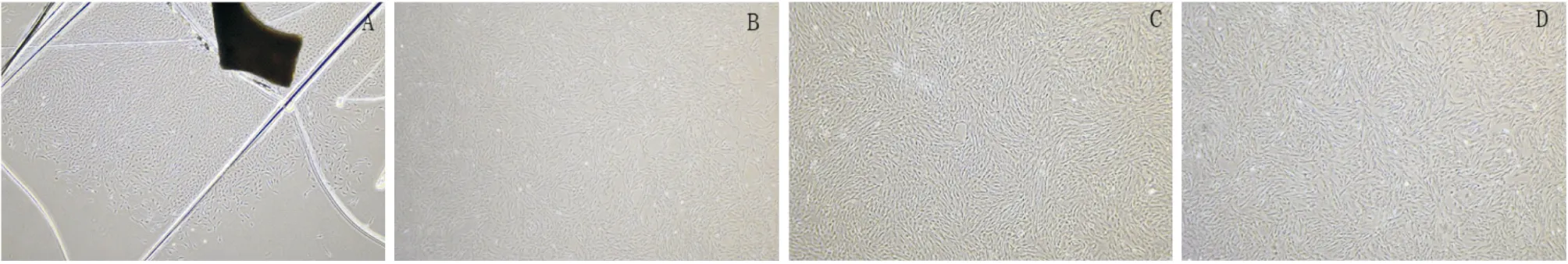
Fig 1 Pictures of cell cultures (×40)A:P0 generation;B:P1 generation;C:P2 generation;D:P3 generation

Fig 2 Expression of vimentin and α-SMA proteins in VAFs (×100)(n=3)Vimentin or α-SMA:Red;The nucleus:Blue
2.2 Ang Ⅱ的时效量效曲线采用CCK-8法检测不同浓度、不同时间Ang Ⅱ对VAFs增殖活力的影响,Fig 3A结果显示,随着剂量的增加,Ang Ⅱ对VAFs的增殖活力,先呈剂量依赖性增大,后呈剂量依赖性减小,在10-7mol·L-1浓度时,Ang Ⅱ对VAFs的增殖作用最明显(P<0.01),后续实验Ang Ⅱ 的浓度采用10-7mol·L-1。10-7mol·L-1的Ang Ⅱ对不同时间的VAFs增殖作用的结果显示(Fig 3B),随着时间的延长,Ang Ⅱ对VAFs的增殖活力呈现先升高后降低的趋势,其中12 h、24 h对VAFs细胞活力增强最明显(P<0.01)。
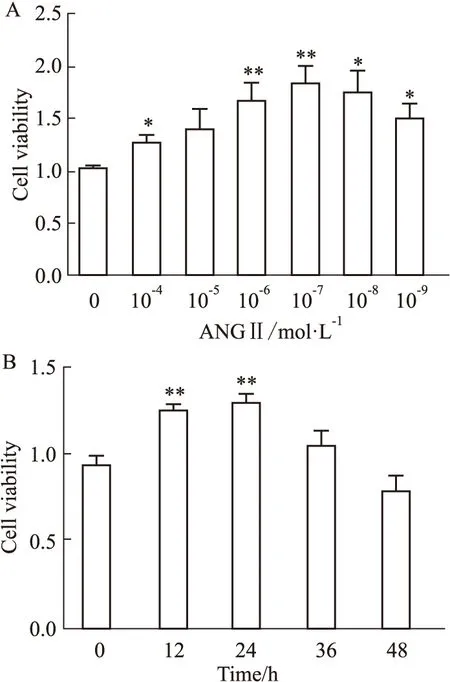
Fig 3 Effect of Ang Ⅱ on VAFs cell n=6)A:Effects of different concentrations of Ang Ⅱ on VAFs cell viability;B:Effects of different time of Ang Ⅱ on VAFs cell viability.*P<0.05,**P<0.01 vs 0 group.
2.3 HSYA的时效量效曲线采用CCK-8法检测不同浓度HSYA对VAFs增殖活力的作用,结果显示(Fig 4A),随着剂量的增加,VAFs增殖活力呈剂量依赖性降低,且浓度>20 μmol·L-1时,HSYA对VAFs增殖抑制,差异具有显著性(P<0.05),当浓度大于80 μmol·L-1时,HSYA对细胞产生毒副作用(Fig 4C),本实验采用对VAFs增殖活力抑制最明显,且对细胞无细胞毒性的浓度,即40μmol·L-1进行后续实验。采用CCK-8法检测不同时间HSYA(40 μmol·L-1)对VAFs增殖活力的影响,Fig 4B结果显示,随着时间的延长,40 μmol·L-1的HSYA对VAFs的增殖活力呈时间依赖性降低,在作用48 h时出现细胞毒(Fig 4D),选择对细胞增殖活力抑制作用明显(P<0.05)且没有毒性作用的24 h进行后续实验。
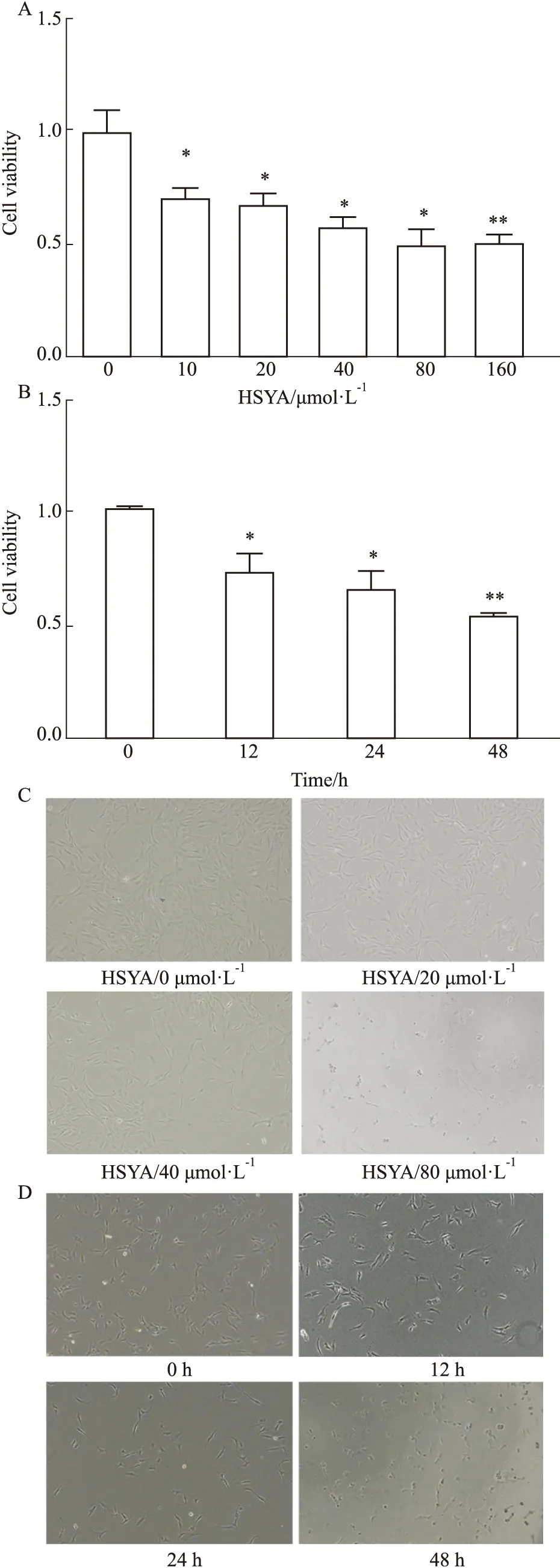
Fig 4 Effect of HSYA on VAFs cell n=6)A:Effects of different concentrations of HSYA on VAFs cell viability;B:Effects of different time of HSYA on VAFs cell viability;C and D.Images of different concentrations and time of HSYA on VAFs (×40);*P<0.05,**P<0.01 vs 0 group.
2.4 HSYA对Ang Ⅱ诱导的VAFs迁移的作用为初步探究HSYA对Ang Ⅱ诱导的VAFs迁移的作用,细胞分为3组:NC组、Ang Ⅱ组、Ang Ⅱ+HSYA组。采用细胞划痕实验检测HSYA对Ang Ⅱ诱导的VAFs迁移的作用,Fig 5结果显示,与NC组相比,Ang Ⅱ明显促进VAFs的迁移(P<0.01),HSYA干预24 h后,能有效抑制VAFs的迁移(P<0.01)。
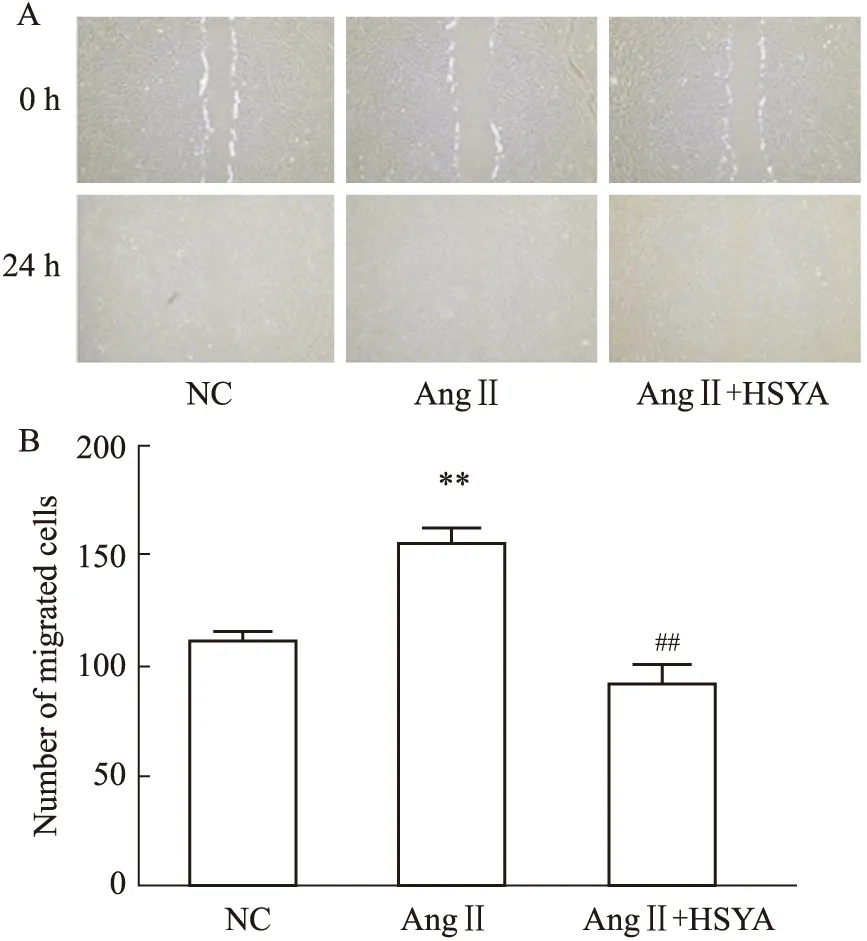
Fig 5 Effect of HSYA on migration of A:HSYA inhibited Ang Ⅱ-induced VAFs migration(×40);B:**P<0.01 vs NC group,##P<0.01 vs Ang Ⅱ group.
2.5 HSYA对Ang Ⅱ诱导的VAFs的自噬小体形成的影响采用MDC法检测HSYA对Ang Ⅱ诱导的VAFs自噬小体形成的作用,Fig 6结果显示,与NC组相比,Ang Ⅱ 刺激24 h后,VAFs中自噬小体增加(P>0.05);与Ang Ⅱ组相比,HSYA刺激24 h后,明显增加VAFs中自噬小体的数量(P<0.01)。
2.6 自噬抑制剂Baf对Ang Ⅱ诱导的VAFs迁移的作用采用划痕实验检测自噬抑制剂Baf对Ang Ⅱ诱导的VAFs迁移,Fig 7结果显示,与NC组相比,Ang Ⅱ 组细胞迁移数量明显增加(P<0.01),HSYA干预24 h后,VAFs细胞迁移数量明显减少(P<0.01)。与HSYA组相比,Baf组VAFs迁移数量明显增加(P<0.05),与Baf组相比,Baf与HSYA共处理组VAFs细胞迁移数量明显减少(P<0.05)。
2.7 自噬抑制剂Baf对Ang Ⅱ诱导VAFs自噬小体形成的影响采用MDC实验检测自噬抑制剂Baf对Ang Ⅱ诱导的VAFs自噬小体数量的影响,Fig 8结果显示,与NC组相比,Ang Ⅱ组自噬斑点数量明显增加(P<0.05);与Ang Ⅱ相比,HSYA明显增加了自噬荧光斑点的数量(P<0.05),HSYA与Baf共处理组呈相同趋势,与HSYA和Baf共处理组相比,Baf处理自噬小体数量明显降低(P<0.05)。
2.8 HSYA对Ang Ⅱ诱导的VAFs中自噬相关蛋白表达的作用采用Western blot实验检测自噬相关蛋白表达,Fig 9结果显示,与正常组相比,Ang Ⅱ处理组自噬相关蛋白表达无明显影响;与Ang Ⅱ组相比,HSYA处理明显增加自噬相关蛋白Beclin 1、LC3 Ⅱ的表达,降低p62蛋白表达(P<0.05);与HSYA处理组相比,HSYA和Baf共处理后自噬相关蛋白Beclin 1、LC3 Ⅱ表达明显升高(P<0.05);与HSYA和Baf共处理组相比,Baf单独处理组自噬相关蛋白Beclin1、LC3 Ⅱ/Ⅰ 表达明显降低(P<0.05),p62蛋白表达升高(P>0.05)。

Fig 7 Effect of HSYA and autophagy inhibitor on migration of Ang Ⅱ-induced n=3)A:Wound healing assay(×40);B:The number of migrated cells.1:NC;2:AngⅡ;3:AngⅡ+HSYA;4:AngⅡ+HSYA+Baf;5:AngⅡ+Baf;**P<0.01 vs NC group;#P<0.05,##P<0.01 vs Ang Ⅱ group;△P<0.05 vs Ang Ⅱ+HSYA group.
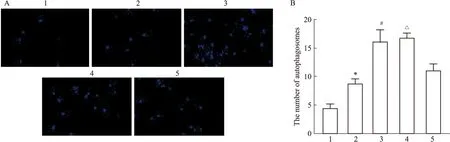
Fig 8 Effect of HSYA and autophagy inhibitor on number of autophagosomes in Ang Ⅱ-induced n=3)A:The autophagosomes are shown in blue(×100);B:The number of autophagosome;1:NC;2:AngⅡ;3:AngⅡ+HSYA;4:AngⅡ+HSYA+Baf;5:AngⅡ+Baf;*P<0.05 vs NC group;#P<0.05 vs Ang Ⅱ group;△P<0.05 vs Baf group.

Fig 9 Effect of HSYA on protein expression of LC3,Beclin1 and p62 in Ang Ⅱ-induced n=3)1:NC;2:AngⅡ;3:AngⅡ+HSYA;4:AngⅡ+HSYA+Baf;5:AngⅡ+Baf;**P<0.01 vs Ang Ⅱ group;#P<0.05,##P<0.01 vs Ang Ⅱ+HSYA group;△P<0.05,△△P<0.01 vs Ang Ⅱ+HSYA+Baf group.
3 讨论
21世纪初,Li等[9]利用LacZ标记追踪发现了大鼠颈动脉球囊损伤模型中外膜成纤维细胞迁移至血管内膜的直接证据,研究表明在内膜出现增生之前,LacZ标记的成纤维细胞已经迁移至内膜;血管外膜成分复杂,与内膜的距离较远,然而越来越多的研究显示血管外膜是血管损伤的最早启动者,甚至是主导者[10]。Kadota等[11]研究发现,在肺纤维化中,成纤维细胞的外囊泡促进上皮细胞衰老,推动疾病进程;Tong等[3]研究显示,来自原代培养自发性高血压大鼠(spontaneously hypertensive rats,SHR)血管外膜成纤维细胞的外泌体,促进WKY大鼠血管平滑肌细胞迁移,其机制可能是SHR大鼠VAFs通过分泌血管紧张素转换酶促进中膜平滑肌细胞迁移,加剧血管重构。越来越多的证据显示,常被忽略的VAFs在疾病发生发展过程中发挥重要作用。
细胞自噬是目前的研究热点,自噬通过降解受损细胞器或细胞质蛋白等维持细胞稳态,多种疾病均与自噬相关[12],心血管疾病也与自噬有着密切关系[13],研究表明,激活自噬可减轻动脉粥样硬化,抑制内皮细胞增殖、迁移,机制可能是通过调控自噬抑制NLRP3炎性小体[14],提示自噬对细胞稳态的调控至关重要。自噬是把双刃剑,另有研究表明,抑制自噬可抑制血管平滑肌细胞增殖,进而改善血管重构[15],延缓动脉粥样硬化的进程。自噬与心血管疾病密切相关,有望成为改善或治疗疾病的新靶点。
红花活血化瘀,临床常用于治疗心血管疾病[16],HSYA是活血化瘀中药红花中的主要有效成分,具有多种药理活性,Zhang等[17]研究发现HSYA通过抑制缺氧/复氧心肌细胞氧化应激反应,减少心肌细胞损伤;另有研究显示HSYA通过激活自噬抑制炎症反应缓解大鼠心脏缺血/再灌注损伤[18]。HSYA是否通过调控自噬抑制VAFs异常迁移,从而改善血管重构尚未见报道。
本实验以原代培养的胸主动脉外膜成纤维细胞为研究对象,通过Ang Ⅱ诱导建立VAFs活化模型,探究HSYA对VAFs迁移的影响。Vimentin和α-SMA分别是VAFs和血管平滑肌细胞(VSMCs)的标志蛋白,免疫荧光实验结果显示(Fig 2),所培养细胞Vimentin蛋白表达阳性,说明贴块法培养得到的细胞是VAFs;α-SMA蛋白表达阴性,说明培养得到的细胞中不含有VSMCs,该结果表明原代培养的VAFs获得成功。采用CCK-8法检测不同浓度、不同时间Ang Ⅱ对VAFs细胞活力的影响,建立Ang Ⅱ对VAFs细胞活力影响的量效时效曲线(Fig 3),确定Ang Ⅱ对VAFs细胞活力影响的最佳浓度和时间分别为10-7mol·L-1和24 h,因此,后续实验选用10-7mol·L-1Ang Ⅱ刺激24 h进行试验;同样方法建立HSYA和VAFs细胞活力影响的量效时效曲线(Fig 4A),确定HSYA最佳浓度和时间分别为40 μmol·L-1和24 h,后续实验选用40 μmol·L-1HSYA刺激24 h进行试验。
划痕实验结果显示(Fig 5),Ang Ⅱ诱导VAFs迁移活性增加,经HSYA处理后明显抑制迁移;MDC实验结果显示(Fig 6),HSYA处理后明显增加自噬荧光斑点数量,以上两个结果初步表明HSYA可能通过激活自噬抑制Ang Ⅱ诱导的VAFs迁移。为了确证HSYA对VAFs自噬和迁移的作用,课题组在上述实验的基础上,加入自噬抑制剂Baf,Baf抑制自噬小体和溶酶体的结合,加入Baf后,自噬小体无法与溶酶体结合降解自噬小体,造成自噬小体堆积,进而抑制自噬的进程。加入Baf的划痕实验结果显示(Fig 7),Ang Ⅱ+HSYA+Baf组较Ang Ⅱ+HSYA组迁移细胞数增多,两组结果差别明显,说明抑制自噬后VAFs迁移增强,证明了HSYA通过激活自噬,抑制Ang Ⅱ诱导的VAFs迁移,结果提示HSYA通过激活自噬抑制Ang Ⅱ诱导的迁移。为了进一步确认此结果,采用同样的分组,用MDC法检测自噬小体的数量,结果显示(Fig 8),与Ang Ⅱ组相比,HSYA处理后自噬小体明显增加,HSYA和HSYA与Baf共处理均进一步增加了自噬小体数量,提示自噬小体堆积增加,验证了HSYA对自噬起促进作用,进一步验证了HSYA通过激活自噬抑制Ang Ⅱ诱导的VAFs迁移。
自噬小体的形成是自噬发生的关键环节,自噬小体的形成分为三个阶段:自噬小体成核、自噬小体延伸、自噬小体成熟,自噬小体在形成过程中将受损的细胞器或蛋白包裹进来,然后成熟的自噬小体与溶酶体结合,形成自噬溶酶体,利用溶酶体中的溶解酶将自噬小体裂解,清除受损的细胞器或蛋白,最终完成自噬整个过程。Beclin1与Vps34和Vps15复合物结合完成自噬小体的延伸,再经过两个泛素化样系统,分别为Atg5-Atg12系统和LC3系统,进一步形成成熟的自噬小体,LC3 Ⅰ转化为LC3 Ⅱ是自噬小体成熟的标志。p62也是参与自噬小体形成的关键分子,通常与自噬活动呈负性相关。为了确证HSYA通过激活自噬抑制VAFs迁移的初步机制,采用Western blot实验检测自噬相关蛋白Beclin1、LC3及p62蛋白表达,结果显示,HSYA处理后Beclin1、LC3 Ⅱ蛋白表达明显升高,表明自噬活动增强。Baf抑制自噬是通过抑制自噬小体与溶酶体的结合实现的,HSYA与Baf共处理后Beclin1、LC3 Ⅱ蛋白表达和LC3Ⅰ/LC3Ⅱ转化进一步升高,p62蛋白表达降低,提示自噬小体增多,自噬作用增强,进一步验证了HSYA对自噬起促进作用,进而抑制Ang Ⅱ诱导的VAFs迁移。
综上所述,HSYA通过激活自噬,抑制Ang Ⅱ诱导的VAFs迁移,改善血管重构,有望成为治疗心血管疾病的新靶点。后续试验将进一步在细胞水平探究HSYA调控自噬的机制,在整体水平探究 HSYA改善血管重构的作用机制。