胡椒碱抗ApoE-/-小鼠动脉粥样硬化活性及作用机制
2021-12-15王俊如姚卫云牛银波张光伟李晨睿
王俊如,张 树,姚卫云,李 瑜,牛银波,张光伟 ,余 琦,李晨睿
(1.西北工业大学生命学院,陕西 西安 710072;2.西安医学院基础医学部,3.西安医学院基础与转化医学研究所,陕西 西安 710021)
动脉粥样硬化(atherosclerosis,AS)是由于血清胆固醇附着于动脉内膜或动脉壁,造成凹凸不平的粥样脂质沉积。由坏死核心、钙化区域、脂质和发炎的平滑肌组成的动脉粥样硬化斑块细胞、内皮细胞泡沫细胞,以及大动脉中脂质和纤维素的积累是动脉粥样硬化的病理特征[1-2]。《中国心血管报告2017》数据显示,现阶段我国心血管疾病患者约有2.9亿人次,占居民死亡人数的40%以上,在我国各种疾病死亡率中居于首位[3]。
他汀类药物作为目前治疗AS的一线药物,副作用相对较大,长期服用会导致肝酶异常、肌肉毒性及糖尿病的发生[4-5]。另外,治疗AS的用药周期较长,因此研发副作用较小的抗动脉粥样硬化药物成为医药工作者面临的重大挑战之一。有研究报道,多种天然产物能够有效对抗动脉粥样硬化的形成,如姜黄、丁香和银杏叶等药物提取物以及丹参酮IIA(tanshinone IIA,Tan IIA)、广藿香醇(patchouli alcohol,PA)、黄芪总黄酮(total flavonoids of astragalus,TFA)和淫羊藿苷(icariin)等天然单体[6-11]。胡椒碱(piperine,PIP)是胡椒科植物胡椒(PipernigrumL.)和荜拔(PiperlongumL.)中含量最高的生物碱单体,具有广泛的药理活性,如抗炎、抗氧化、抗抑郁和抗肿瘤等作用[12]。据报道脂质异常和氧化应激是AS形成的关键因素,PIP能有效降低镉引起的小鼠脾细胞的氧化损伤,以及降低高脂肪喂养(high-fat diet,HFD)的C57BL/6N小鼠体内脂质的过氧化水平[13]。然而,PIP在体内水平是否能够对抗AS的发生、发展目前尚未见报道。本研究拟利用高脂高胆固醇喂养的ApoE-/-小鼠研究PIP对AS的治疗效果,并利用人脐静脉内皮细胞探讨PIP的作用机制,以期为AS的治疗提供新的候选药物。
1 材料与方法
1.1 实验材料8周龄雄性ApoE-/-小鼠24只,体质量(21.0±0.5)g,购自西安交通大学医学院动物实验中心,动物生产许可证号SYXK(陕)2020-001。人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)购自中国科学院上海细胞库。
1.2 药物与试剂胡椒碱(批号:MCP510928)(上海友思生物科技有限公司,上海);胆固醇检测试剂盒(批号:20191201)、甘油三酯检测试剂盒(批号:20190428)、LDL-C检测试剂盒(批号:20190808)、HDL-C检测试剂盒(批号:20190819)、Ox-LDL检测试剂盒(批号:20190608)(中生北控生物科技有限公司,北京);白介素6检测试剂盒、肿瘤坏死因子α检测试剂盒(华美生物工程有限公司,武汉);SanTaq PCR试剂盒(批号:MK3829)(TaKaRa Bio,美国);油红O染色试剂盒(批号:MGC20191201)(无锡恒缘生物医药,无锡);BCA蛋白定量试剂盒(批号:20191223)(南京建生物工程有限公司)、ECL生物发光显色试剂盒(批号:20191120)(Pirece,美国);CCK-8、NO检测试剂盒(批号:120718190315)、MDA检测试剂盒(批号:030819190614)、ROS检测试剂盒(批号:030918191024)、SOD活性检测试剂盒(032219190614)、Western及IP细胞裂液(批号:20200108)(上海碧云天生物技术有限公司,上海);RT-qPCR试剂盒(批号:P5019)(北京天根生化科技有限公司,北京);脂多糖(批号:MC0738)(Sigma,美国)。
1.3 主要仪器InAlyzer-DXA人体成分分析仪(韩国Medikors公司);台式高速冷冻离心机(美国Thermo公司);酶标仪(美国Bio Tek公司);PCR仪、垂直电泳槽、转膜槽、凝胶成像仪(美国Bio-Rad公司)。
1.4 动物分组与给药小鼠于SPF级洁净动物房中适应性饲养1周后,随机分为3组:对照组(con)、胡椒碱高剂量组(PIP-H,50 mg·kg-1)、胡椒碱低剂量组(PIP-L,10 mg·kg-1),每组8只。小鼠普通饲料适应性喂养2周后,给予含0.15%胆固醇(Wako;Japan)及21%脂肪的高脂饲料,同时给予小鼠PIP灌胃。小鼠饲养于SPF级洁净动物房中,自由饮水,12 h明暗循环照明。
1.5 样本采集给药结束后,用0.3%的戊巴比妥钠溶液麻醉小鼠,剂量为0.02 mL·g-1。采用心脏穿刺的方法取血,全血于4 ℃静置2 h,4 000 r·min-1离心20 min,分离上层血清后,置于-80 ℃冰箱保存待测。分离小鼠肝脏,用生理盐水润洗后-80 ℃冰箱保存待测。
1.6 血清生化指标测试取40 μL血液上清应用氧化酶法,通过Synergy HT酶标仪检测血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesaterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)的浓度。采用ELISA试剂盒对小鼠血清中肿瘤坏死因子α(tumor necrosis factor,TNF-α)和C反应蛋白(C-reaction protein,CRP)浓度进行检测,并根据说明书绘制标准曲线。
1.7 主动脉油红O染色ApoE-/-小鼠麻醉后,剥离胸主动脉并用4%多聚甲醛固定24 h。固定液中取出后,PBS清洗2次,沿血管壁将主动脉纵向剖开并浸入油红O染液中,室温下染色1 h。75%乙醇镜下分化至管腔内脂肪斑块呈橘红色或红色,间质清晰。之后用蒸馏水清洗2 min,85%异丙醇清洗3遍,再用蒸馏水洗3遍。平铺好主动脉,用数码相机拍照,用于观察AS斑块面积。使用ImageJ图像分析软件进行双盲定量分析主动脉内脂肪斑块面积,并计算斑块面积占总面积的百分比,即斑块面积/总面积×100%。
1.8 细胞培养液中NO、丙二醛和超氧化物歧化酶含量测定将HUVEC细胞以2×108L-1的密度接种在6孔板中,并用1 mg·L-1LPS诱导HUVECs 24 h。之后用不同浓度(0.01、0.05 μmol·L-1)的PIP预处理2 h,然后加入LPS和PIP共同孵育24 h。随后用Griess Reagent法以及MDA和SOD检测试剂盒对细胞培养液中的NO、丙二醛(malonic dialdehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)含量进行测定。
1.9 实时定量PCR测定将HUVECs以2×108L-1的密度接种在6孔板中,用1 mg·L-1LPS诱导HUVECs 24 h,然后用不同浓度(0.01、0.05、0.1 μmol·L-1)的PIP预处理2 h,之后加入LPS和PIP共同孵育细胞24 h。根据说明书提取RNA,使用分光光度计检测RNA的浓度后,按照反转录试剂盒说明书获得cDNA。使用SYBR Green的非专一型qPCR技术检测HUVECs内相关基因的表达。使用的PCR引物序列见Tab 1。

Tab 1 PCR primer sequence
1.10 免疫印迹试验100 mg肝组织样本加入裂解液,使用匀浆机进行匀浆,离心提取组织蛋白。如“1.9”中处理细胞后,6孔板每孔加150 μL裂解液,提取细胞总蛋白。BCA测蛋白浓度后,统一每个样本总蛋白上样量。配制浓缩胶和分离胶,上样后接上电泳仪,随后将蛋白湿转到PVDF膜上,依次进行脱脂奶粉封闭以及一抗、二抗孵育,之后加发光液曝光处理,进而分析实验结果。

2 结果
2.1 PIP对ApoE-/-小鼠血脂的影响PIP在不同剂量下对高脂、高胆固醇喂养ApoE-/-小鼠血脂影响的结果如Fig 1所示。结果表明,PIP-H和PIP-L组ApoE-/-小鼠血清中TC浓度与con组相比差异无显著性;而高、低剂量的PIP能明显降低ApoE-/-小鼠血清中TG和LDL-C的水平(P<0.05),并明显增加HDL-C的水平。结果表明,PIP能够明显降低高脂喂养ApoE-/-小鼠的血脂浓度,从而具有抗AS的活性。

Fig 1 Effects of PIP on plasma levels of LDL-C,HDL-C,TC and TG in ApoE-/-mice after oral administration of low and high doses of PIP n=8)*P<0.05 vs control group.
2.2 PIP对ApoE-/-小鼠血清中TNF-α和CRP水平的影响AS与炎症相关,用ELISA法对ApoE-/-小鼠血清中的TNF-α和CRP炎症因子水平进行检测。与con组比较,PIP-H和PIP-L组ApoE-/-小鼠血清中炎症因子TNF-α和CRP的水平均明显降低(P<0.05)。结果表明,PIP能有效降低ApoE-/-小鼠血清中的炎症水平,从而抑制AS的发展(Fig 2)。
2.3 PIP对ApoE-/-小鼠主动脉树斑块面积的影响ApoE-/-小鼠经高脂喂养建立AS模型,灌胃给予高、低剂量的PIP 20周后,分离小鼠主动脉并进行油红O染色,通过统计主动脉斑块面积来反映AS的发展程度。结果如Fig 3所示,与con组相比,PIP-H和PIP-L组ApoE-/-小鼠主动脉树AS的面积百分比明显降低(P<0.05),并且PIP-H组小鼠主动脉树AS的面积百分比低于PIP-L组的AS面积百分比。结果表明,PIP可以有效改善高脂饮食喂养的ApoE-/-小鼠主动脉树AS斑块的形成。

Fig 2 Effects of PIP on serum levels of TNF-α and CRP in ApoE-/- mice after oral administration of low and high doses of PIP n=8)*P<0.05 vs control group.
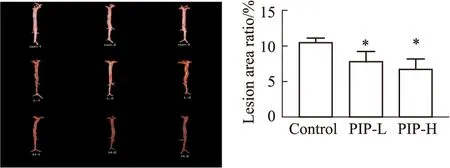
Fig 3 Effects of PIP on formation of atherosclerotic lesion areas in ApoE-/- mice after oral administration of low and high doses of PIP n=8)Aortic trees were stained with oil red O,and lesion areas were calculated in total aorta.*P<0.05 vs control group.
2.4 PIP对HUVECs细胞上清液中NO含量的影响通过Griess Reagent方法测定HUVECs细胞经LPS和不同浓度PIP处理后上清液中亚硝酸盐含量,从而间接计算NO的浓度。结果如Fig 4所示,LPS在1 mg·L-1的浓度下可以明显降低HUVECs内NO的产生(P<0.05)。加入0.01 和0.05 μmol·L-1浓度的PIP可以提高细胞上清液中NO的含量(P<0.05)。结果表明,PIP能够促进HUVECs内NO的产生,从而发挥保护内皮细胞的功能。
2.5 PIP对HUVECs细胞内脂质氧化水平的影响基于丙二醛(MDA)和硫代巴比妥酸反应产生的红色产物测定脂质氧化水平,检测HUVECs细胞内MDA含量。结果如Fig 5所示,1 mg·L-1LPS可以明显提高HUVECs细胞内脂质氧化水平(P<0.05)PIP在0.01 μmol·L-1和0.05 μmol·L-1浓度下可明显降低细胞中MDA的产生(P<0.05及P<0.01)。结果表明,PIP处理可以降低LPS诱导的HUVECs细胞内脂质氧化水平升高,从而具有抗氧化应激的作用。

Fig 4 Effects of PIP at various concentrations on production of NO in supernatant of LPS induced HUVECs n=6)HUVECs were cultured treated with LPS and/or PIP.#P<0.05 vs control group,*P<0.05 vs LPS group.

Fig 5 Effects of PIP at various concentrations on production of MDA in HUVECs n=3)HUVECs were cultured and treated with LPS and/or PIP.##P<0.01 vs control group;*P<0.05,**P<0.01 vs LPS group.
2.6 PIP对HUVECs细胞内SOD酶活力的影响超氧化物歧化酶(superoxide dismutase,SOD)是一种能够催化超氧化物转化为氧气和过氧化氢的酶,防御生物体免受氧化损伤。使用WST-8法通过对WST-8产物的比色分析测定HUVECs细胞内SOD酶活力。结果如Fig 6所示,LPS在1 mg·L-1浓度下可以明显降低HUVECs细胞内SOD酶活力水平(P<0.05)。PIP在0.01 μmol·L-1和0.05 μmol·L-1浓度下可明显提高细胞内SOD酶活力水平(P<0.05,P<0.01)。结果表明,PIP可明显抑制因LPS导致的HUVECs细胞内SOD酶活力的降低,从而表现出抗氧化应激的作用。

Fig 6 Effects of PIP at various concentrations on SOD activity in HUVECs n=3)HUVECs were cultured and treated with LPS and/or PIP.#P<0.05 vs control group;*P<0.05 vs LPS group.
2.7 PIP对Akt/eNOS通路相关信号分子的影响HUVECs细胞经LPS诱导后,给予不同浓度的PIP处理,细胞内Akt/eNOS通路相关信号分子的基因水平如Fig 7所示。经LPS诱导24 h后,细胞内Akt、eNOS和Bcl-2基因水平明显下调(P<0.05),而NF-κB和Bax水平明显上调(P<0.05)。给予HUVECs细胞0.01 μmol·L-1和0.05 μmol·L-1浓度的PIP处理,明显增加Akt、eNOS、Bcl-2基因的水平(P<0.05及P<0.01),同时降低NF-κB和Bax的水平(P<0.05)。RT-qPCR结果表明,PIP可以上调Akt基因,促进eNOS的表达,从而提高细胞内NO含量,起到保护内皮细胞的作用。

Fig 7 Effects of PIP at various concentrations on gene levels of Akt/eNOS signals in HUVECs n=3)#P<0.05 vs control group;*P<0.05,**P<0.01 vs LPS group.
2.8 PIP对ApoE-/-小鼠肝脏中炎症及应激相关蛋白表达的影响通过Western blot实验检测ApoE-/-小鼠肝脏中各种炎症因子和X-盒结合蛋白1(XBP1)的表达,结果如Fig 8所示,高剂量和低剂量PIP能明显降低ApoE-/-小鼠肝脏中白细胞介素-6(interleukin 6,IL-6)的表达(P<0.05,P<0.01)。低剂量PIP明显降低白细胞介素-18(Interleukin-18,IL-18)的水平(P<0.05),高剂量PIP对IL-18蛋白含量的降低差异无显著性。与con组相比,Bcl-2同源相关蛋白(Bcl-2 associated X protein,Bax)经高、低剂量PIP处理后,表达降低但差异无显著性。XBP1、细胞间黏附分子1(intercellular cell adhesion molecule-1,ICAM1)和单核细胞趋化因子1(monocyte chemoattractant protein-1,MCP1)的蛋白水平经高、低剂量PIP处理后与con组相比差异无显著性。结果表明,PIP能够明显降低高脂喂养ApoE-/-小鼠肝组织中炎症因子(IL-6和IL-18)的水平,初步推测PIP抗AS的活性与抑制炎症水平相关。

Fig 8 Effects of PIP on protein expressions related to oxidative stress in liver of ApoE-/- mice after oral administration of low and high doses of PIP n=3)*P<0.05,**P<0.01 vs control group.
2.9 PIP对HUVECs细胞PI3K/Akt/eNOS通路相关蛋白表达的影响通过Western blot实验检测PI3K/Akt/eNOS信号通路相关因子表达的影响,结果如Fig 9所示,HUVECs细胞经LPS诱导后,eNOS、Akt和Bcl-2蛋白水平比con组明显增加(P<0.05);iNOS蛋白表达明显升高(P>0.05);PI3K有降低的趋势,但差异无显著性。给予高剂量PIP(0.05 μmol·L-1)处理后,与LPS组相比,HUVECs中eNOS、PI3K和Akt蛋白的表达明显增加(P<0.05);低浓度PIP(0.01 μmol·L-1)明显增加Akt和Bcl-2的水平(P<0.05)。PIP在0.01和0.05 μmol·L-1浓度均能明显降低iNOS的蛋白水平(P<0.05)。结果表明,PIP能够上调LPS诱导的HUVECs细胞中PI3K/Akt/eNOS信号水平,通过提高内皮细胞产生的NO的含量,发挥抗AS的作用。

Fig 9 Effects of PIP on protein expressions related to PI3K/Akt/eNOS signaling pathway in HUVECs n=3)HUVECs were cultured and treated with LPS and/or PIP.#P<0.05 vs control group;*P<0.05,**P<0.01 vs LPS group.
3 讨论
AS作为一种成因复杂的心血管疾病,常伴有冠状动脉和脑血管疾病等,涉及大动脉中脂质和纤维素的积累。普遍认为AS是由于脂肪、血栓、结缔组织和碳酸钙等在血管(主要是动脉)沉积所造成。ApoE-/-小鼠可以发生自发性AS,是一种广泛地用于AS研究的经典动物模型。高脂饲料喂养加速小鼠的AS病变,与人类的AS斑块分布高度相似。本研究通过高脂喂养ApoE-/-小鼠,建立小鼠AS模型,研究PIP抗AS的作用及其分子机制。体内动物实验结果表明,PIP给药改善了小鼠的血脂异常,降低小鼠主动脉树病变斑块的面积百分比以及小鼠血清中TNF-α和CRP炎症因子的水平。已有研究显示,AS的发生发展与体内炎症水平和氧化应激密切相关,如IL-6、IL-18、TNF-α和XBP1等[14]。ApoE-/-小鼠体内实验数据表明PIP可以降低血脂和炎症因子水平,具有抗AS的药理活性;PIP对血管的保护作用可能与PIP抑制胆固醇合成,降低炎症水平作用相关。目前研究表明,氧化应激可以直接损伤血管壁细胞,或者通过影响血管壁细胞转录因子的水平,调节相关基因的表达,参与AS的发生发展[15],但本实验中PIP处理对XBP1、ICAM1和MCP1等氧化应激作用的蛋白水平差异无显著性。此外,体内和体外研究表明,高剂量PIP抗AS的效果与低剂量相比未表现出剂量依赖性。我们前期药动学研究发现PIP的体内药物动力学呈现非线性动力学的特征,推测这可能是导致抗AS药效学不具有剂量依赖性的原因[16]。
AS的发生发展涉及多种细胞,内皮细胞的功能失调是其中重要的原因之一。内皮细胞不仅是循环血液和血管平滑肌细胞之间的屏障,还能够调节血管张力、生长及血小板功能。通过LPS诱导血管内皮细胞、平滑肌细胞和巨噬细胞炎症反应的发生,以及增加细胞凋亡来促进AS的发生发展。其中脂多糖诱导的炎症损伤HUVEC模型是常被用来研究AS发展分子机制的模型之一。NO作为细胞间信息传递的重要调节因子,是由血管内皮细胞合成并释放的舒张因子;MDA和SOD水平均可反映机体氧化及抗氧化的能力,即检测是否具有保护血管内皮细胞免受脂质过氧化损伤的作用。体外实验显示PIP可以降低HUVECs细胞内氧化状况,明显提高上清液中NO含量,具有保护内皮细胞作用。PIP可改善因LPS诱导的HUVECs中MDA和SOD水平的降低,表明PIP通过降低细胞过氧化水平提高抗氧化能力,改善SOD对具有保护内皮细胞的作用。
循环系统中源于内皮细胞的NO具有多种血管保护功能,如调节血管紧张度,抑制血小板聚集、炎症反应、和血管平滑肌的收缩。血管内皮细胞通过NO发挥多种抗AS作用,内皮细胞功能失调是导致AS起始的关键因素。体内的NO主要由NOS所产生,NOS 包括3种亚型:eNOS、nNOS和iNOS。在完整的血管中,大部分NO由内皮细胞的eNOS产生。PI3K/Akt信号通路在调控细胞增殖、分化和凋亡等细胞功能方面发挥重要作用。近年来的研究表明,PI3K/Akt信号通路与eNOS的磷酸化及活性密切相关[17]。其中PI3K的抑制剂可下调NOS的活性。而黄芪提取物通过激活信号通路而增加eNOS的表达,最终提高NO的含量。LPS诱导后的HUVEC细胞会产生过量的活性氧,使eNOS功能失调从而产生大量有损于内皮细胞的超氧阴离子。与此同时,iNOS被诱导表达产生大量的NO,NO与eNOS产生的超氧阴离子迅速结合生成过氧亚硝基阴离子,进一步导致血管内皮损伤[18]。根据RT-qPCR和Western blot结果,PIP可以一定程度缓解氧化应激相关病理状态下,上调PI3K的表达,从而激活Akt并上调细胞内eNOS的表达,导致激酶活化,参与内皮依赖性的舒张。eNOS作为NO合成的限速酶,是PI3K/Akt信号通路的下游调节因子,在维持血管的正常生理功能中起关键性作用,PIP促进eNOS的表达,从而提高细胞内NO含量,起到保护内皮细胞的作用。本研究已证明PIP可以降低细胞过氧化水平,从根源上缓解过量产生的活性氧对eNOS的作用,减少超氧阴离子的产生,从而抑制iNOS的诱导表达,减少对内皮细胞的损伤,进而促进eNOS正常产生NO。综上所述,推测PIP具有抗AS作用,且其保护内皮细胞作用的机制可能与上调PI3K/Akt/eNOS信号通路表达有关。