BiOBr/UiO-66-(COOH)2复合材料制备及光催化性能研究
2021-12-15邓妮艳刘生鹏孙国锋
熊 芸,陈 新,张 静,邓妮艳,张 权,刘生鹏,孙国锋
(1.武汉工程大学磷资源开发利用教育部工程研究中心,湖北武汉430205;2.武汉工程大学化工与制药学院)
现代科学技术的发展,在满足人类物质需求的同时,也给生态环境带来了许多问题。如工业生产过程中会产生大量废水,含有的高浓度有毒物质若不经过处理直接排放到大自然中,不仅对环境造成危害,还会威胁到人类以及其他生物的生存[1-3]。因此,对工业废水进行净化处理显得越来越重要。光催化技术是指光催化剂吸收太阳能,产生活性分子将有机污染物催化降解为CO2和H2O等物质,同时还可以将废水中的Cr(Ⅵ)、Hg(Ⅱ)、Pb(Ⅱ)等离子还原,从而达到净化废水的目的[4-5]。与已有的生物降解、化学和物理等方法处理废水中污染物的技术相比,光催化技术具有高效、绿色等优点[6]。
BiOBr是一种新型光催化材料,其晶体为四方氟氯铅矿结构,可看作是双Br-层与[Bi2O2]2+层交替形成的层状结构,Br离子层由Br原子之间通过非共价键结合,这就促使Br-层与[Bi2O2]2+层之间产生一个内建电场,可以促进光生电子与空穴的分离,有效地提高光催化降解的效率[7-9]。BiOBr也因其高稳定性,在光催化领域受到越来越多的关注。ZHANG等[10]采用溶剂热法合成了微球状BiOBr,但因其光学带隙较大,对可见光的吸收效率有限,导致产生的光生电子与空穴复合较快,光催化效果并不令人满意。为提高光催化材料的性能,表面复合、构建异质结和光敏化等方法被用于光催化剂的改性[11]。
UiO-66是金属有机框架(MOFs)材料的一种,具有大的比表面积和高孔隙率,同时还拥有高金属配位,对可见光具备响应能力,是一类研究广泛的MOFs光催化材料[12]。WANG等[13]采用机械研磨和热处理的方法将UiO-66与C3N4复合,复合材料不仅保存了MOF的八面体结构,还加快了C3N4的光生电荷转移速率,有效提高了光催化产氢效率。
笔者通过溶剂热法将BiOBr与UiO-66-(COOH)2复合,利用XRD、SEM等手段对所制备样品的结构、形貌等进行表征。并以甲基橙(MO)为被降解物,氙灯为光源,与复合之前材料的光催化性能作对比,研究了制备的复合材料的光催化性能。
1 实验部分
1.1 实验试剂
主要试剂:四氯化锆(ZrCl4)、均苯四酸(H4BTEC)、冰 乙 酸(CH3COOH)、溴 化 钠(NaBr)、五 水 硝 酸 铋[Bi(NO3)3·5H2O]、乙醇(CH3CH2OH),均为分析纯。
1.2 制备催化剂
1.2.1 UiO-66-(COOH)2的制备
称取233 mg四氯化锆、432 mg均苯四酸溶于50 mL去离子水中,超声处理20 min,在100℃回流24 h,离心、水洗后分散于50 mL去离子水中,在100℃回流16 h,离心、水洗,在80℃真空干燥8 h,得到产物。
1.2.2 BiOBr/UiO-66-(COOH)2的制备
称取480 mg NaBr、200 mg UiO-66-(COOH)2溶于50 mL蒸馏水中,超声处理20 min,称取1 940 mg Bi(NO3)3·5H2O溶于10 mL冰乙酸中,将其加入上述溶液中,磁力搅拌30 min,转移到水热反应釜中在100℃反应7 h,离心,用乙醇、蒸馏水清洗,在80℃真空干燥8 h,得到产物。
1.3 分析方法
利用X射线衍射仪(D8 ADVANCE型,CuKα辐射,管电压为40 kV,管电流为40 mA)对材料的物相组成进行分析。利用红外光谱仪(VERTEX70型,采用KBr压片)对材料进行红外光谱分析。利用比表面积测定仪(ASAP2020型)对材料进行N2物理吸附-脱附测试。利用扫描电镜(SU3500型,电压为15 kV)对材料的表面形貌进行分析。利用透射电镜(JEM2100型)对样品进行形貌分析。利用荧光光谱仪(F-7000型)对材料进行荧光光谱分析。利用紫外可见分光光度计(UV2550型)对材料进行紫外-可见漫反射光谱分析。利用电化学工作站(CHI660E型)对样品进行电化学性质分析。
1.4 光催化性能测试
采用氙灯作为光源,在双层玻璃反应器中降解甲基橙,用于评估催化剂的光催化活性。将200 mL质量浓度为10 mg/L的甲基橙溶液加入反应器中,加入20 mg光催化剂,在避光条件下搅拌30 min,以达到催化剂和甲基橙的吸附-解吸平衡。将悬浮液置于氙灯光源下照射,每隔一定时间取出少量悬浮液,离心去除光催化剂,使用紫外可见分光光度计在462 nm处测量溶液的吸光度,从而计算出该时刻甲基橙的降解率(η)。

式中:A0为避光搅拌30 min甲基橙溶液的初始吸光度;A为光照射一定时间甲基橙溶液的吸光度。
2 表征结果与分析
2.1 X射线粉末衍射分析
图1为BiOBr、BiOBr/UiO-66-(COOH)2和UiO-66-(COOH)2的XRD谱图。从图1看出,BiOBr的衍射峰与四方晶系BiOBr的特征峰相匹配(JCPDS 73-2061)[14];UiO-66-(COOH)2在2θ为7.36、8.48°处出现特征峰,分别与(111)(002)晶面相对应(CCDC 837796)[15];BiOBr/UiO-66-(COOH)2既存在BiOBr的特征峰,又存在UiO-66-(COOH)2的特征峰,衍射峰位置大致相同,但峰强都稍有减弱,说明BiOBr与UiO-66-(COOH)2实现了有效复合,没有影响原始材料的晶型。

图1 BiOBr、BiOBr/UiO-66-(COOH)2、UiO-66-(COOH)2的XRD谱图Fig.1 XRD patterns of BiOBr,BiOBr/UiO-66-(COOH)2 and UiO-66-(COOH)2
2.2 傅里叶红外光谱分析
图2为BiOBr、BiOBr/UiO-66-(COOH)2、UiO-66-(COOH)2的FT-IR图。从图2看出,BiOBr/UiO-66-(COOH)2在518 cm-1处的峰和3 431 cm-1处的宽带归因于Bi—O的拉伸、O—H的拉伸和O—H的弯曲振动[16];600~800 cm-1处的峰组与Zr—O2的纵向和横向排列有关;1 753 cm-1处出现的峰对应侧链—COOH;1 852 cm-1处的峰对应酸酐[17],峰强有所减弱,可能是与Bi OBr复合之后对UiO-66-(COOH)2官能团的遮挡减弱了其透光率[18]。复合物的FT-IR图中均出现BiOBr与UiO-66-(COOH)2的官能团特征峰,说明两者复合之后保留了原始材料的结构。
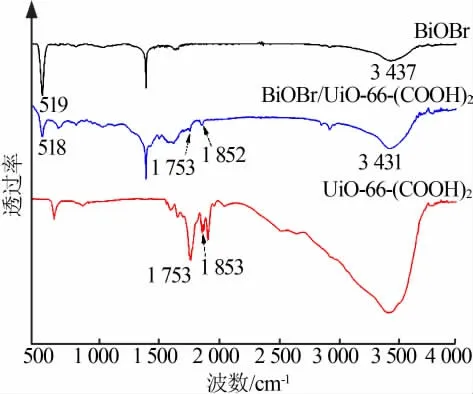
图2 BiOBr、BiOBr/UiO-66-(COOH)2、UiO-66-(COOH)2的FT-IR图Fig.2 FT-IR spectra of BiOBr,BiOBr/UiO-66-(COOH)2 and UiO-66-(COOH)2
2.3 扫描电镜和透射电镜分析
BiOBr/Ui O-66-(COOH)2的SEM和TEM照片见图3。图3a显示复合材料呈团状聚集在一起,可能是在制备过程中分散不够均匀导致的,但相互之间有一定的间隔,这可以提供光催化的反应位点,进而提高光催化效率。从图3b看出,BiOBr/UiO-66-(COOH)2呈圆形结晶纳米片状,平均宽度为700 nm、厚度小于50 nm,保留了原始BiOBr的二维层状结构,而且层与层之间的堆积比较杂乱,保留了一定的空隙,有利于与甲基橙接触进行光催化反应[19]。图3c表明,BiOBr纳米片与UiO-66-(COOH)2纳米片之间相互重叠,紧密堆积在一起。图3d中红圈中的阴影表明,BiOBr与UiO-66-(COOH)2不是简单地吸附在一起,而是相互之间形成了异质结结构,有利于光生电子与空穴的转移。

图3 BiOBr/UiO-66-(COOH)2的SEM(a、b)和TEM(c、d)照片Fig.3 SEM images of BiOBr/UiO-66-(COOH)2(a,b)and TEM images of BiOBr/UiO-66-(COOH)2(c,d)
2.4 氮气物理吸附-脱附分析
UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的氮气物理吸附-脱附等温线见图4。复合材料BiOBr/UiO-66-(COOH)2在相对压力为0.7~1.0处出现了回滞环,其吸附-脱附曲线应该属于第Ⅳ型吸附曲线,主要原因是样品晶体颗粒相互堆积形成了介孔[20]。单纯材料UiO-66-(COOH)2和BiOBr的比表面积分别为253.71、23.56 m2/g,复合之后的比表面积为85.26 m2/g,可能是在合成复合材料的过程中UiO-66-(COOH)2的孔道被堵塞,使得比表面积减小,但是相对于BiOBr,比表面积增大很多。较大的比表面积有利于增大与甲基橙分子的接触面积,给反应提供更多的活性位点,能够牢牢地吸附被降解物质,同时增加光生电荷向甲基橙转移的几率,从而提高光催化效率。
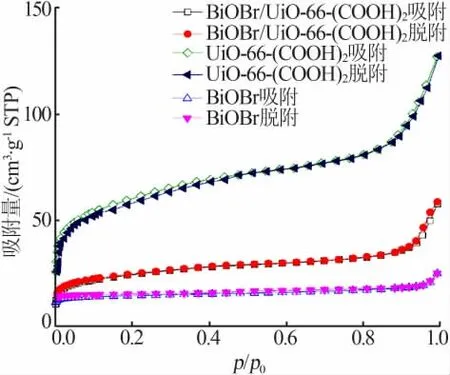
图4 UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的N2物理吸附-脱附等温线Fig.4 N2 physical adsorption and desorption isotherms of UiO-66-(COOH)2,BiOBr and BiOBr/UiO-66-(COOH)2
2.5 紫外可见漫反射光谱与电化学分析
图5为UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的UV-Vis DRS和电化学测试结果。从图5a看出,BiOBr、UiO-66-(COOH)2在可见光范围出现了吸收峰,吸收边界在420~430 nm,复合之后BiOBr/UiO-66-(COOH)2的吸收边界出现红移,且可见光吸收强度也增强。从截距图中可以看出,BiOBr、UiO-66-(COOH)2和BiOBr/UiO-66-(COOH)2所对应的禁带宽度分别为2.73、2.84、2.71 eV,复合之后禁带宽度变化不大。从图5b看出,复合材料BiOBr/UiO-66-(COOH)2的光电流响应强度要高于复合之前的单纯材料BiOBr和UiO-66-(COOH)2。这也表明BiOBr与UiO-66-(COOH)2复合之后,对光的响应强度更高,在受到光激发时光生电子与空穴能够更加有效地分离,从而产生更多的活性分子,光催化性能得到提高。

图5 BiOBr、BiOBr/UiO-66-(COOH)2、UiO-66-(COOH)2的UV-Vis DRS和能带计算通过Tauc方程对应的直线外延截距图(a);光电流响应图(b)Fig.5 UV-Vis DRS of samples;the energy band of the sample calculated by the straight-line epitaxial intercept diagram corresponding to the Tauc equation(a);photocurrent responses of samples(b)
2.6 荧光光谱分析
图6为通过波长为320 nm的光激发UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的PL光谱图。从图6看出,400~600 nm复合材料BiOBr/UiO-66-(COOH)2产生的荧光强度弱于单独材料UiO-66-(COOH)2和BiOBr,说明UiO-66-(COOH)2负载在BiOBr材料上所得到的复合材料产生的光生电子与空穴较难发生复合,从而有效地利用了吸收的光能。主要原因是复合材料中BiOBr与UiO-66-(COOH)2接触的地方生成了异质结,可以快速地转移产生的光生载流电子,从而阻碍了光生电子与空穴的复合,提高了催化剂的活性,使得甲基橙的光催化降解率增加很多[21]。

图6 UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的PL光谱图Fig.6 PL spectra of UiO-66-(COOH)2,BiOBr and BiOBr/UiO-66-(COOH)2
3 光催化测试与分析
3.1 光催化速率测试
图7为UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2光催化降解MO随时间的变化和一级反应动力学曲线。从图7a看出,在没有加光催化剂条件下,光催化反应120 min MO几乎不能降解;加入UiO-66-(COOH)2,MO降解速率比较缓慢,反应120 min降解率为19%;加入BiOBr,MO的光催化降解速率比较稳定,反应120 min降解率为49%;加入BiOBr/UiO-66-(COOH)2,MO降解速率加快,反应120 min降解率达到70%。BiOBr与UiO-66-(COOH)2复合后,对MO的光催化降解效率比复合前有较大的提高,说明两者具有较好的协同作用。
通常有机物光催化降解过程符合一级反应动力学规律,即lnC0/C=kt(式中:C0为有机物的起始浓度;C为有机物在反应t时刻的浓度;k为表观反应速率常数)[22]。为研究制备的光催化剂降解MO的动力学特性,将光催化降解实验数据按照一级反应动力学模型进行拟合,得到相应的标准方程和相关系数(见图7b)。从图7b看到,回归均得到一条直线,UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2的k分别为1.31×10-3、4.71×10-3、8.42×10-3min-1,残差平方和分别为0.002、0.001 68、0.014 05,结果表明所有样品的反应动力学符合一级反应速率模型,复合材料BiOBr/UiO-66-(COOH)2对MO的降解不仅表现出较大的降解率,还具有较快的降解速率,光催化活性最好。

图7 UiO-66-(COOH)2、BiOBr和BiOBr/UiO-66-(COOH)2光催化降解MO速率随时间的变化(a)和一级反应动力学曲线(b)Fig.7 Photocatalytic degradation rate of methyl orange changes with time(a)and the first-order reaction kinetics curve(b)for UiO-66-(COOH)2,BiOBr and BiOBr/UiO-66-(COOH)2
3.2 光催化循环测试
为探究复合材料BiOBr/UiO-66-(COOH)2的催化稳定性,对其进行重复利用实验(结果见图8)。每次完成催化反应后,对反应后的溶液抽滤以收集BiOBr/UiO-66-(COOH)2,真空干燥后用于下一次实验,循环5次,考察其对MO的催化稳定性。从图8看出,5次循环后,BiOBr/UiO-66-(COOH)2对MO的催化降解性能几乎没有下降,说明其催化性能具有良好的稳定性。
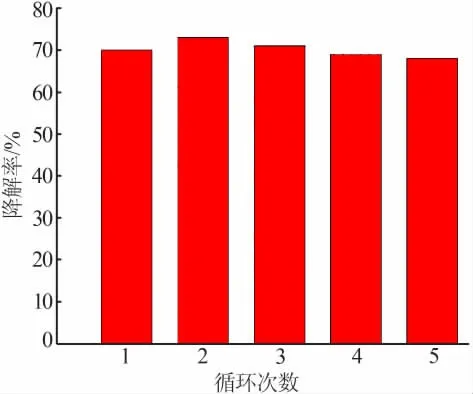
图8 BiOBr/UiO-66-(COOH)2的重复利用实验结果Fig.8 Reuse experiment of BiOBr/UiO-66-(COOH)2
3.3 光催化机理分析
BiOBr/UiO-66-(COOH)2的活性分子捕获实验和可见光下催化降解MO的反应机理见图9。从图9a看出,不加捕获剂时甲基橙在反应120 min的降解率为70%;加入异丙醇(IPA)作为羟基自由基(·OH)捕获剂,甲基橙的降解率为66%,基本没变化;加入苯醌(BQ)作为超氧自由基(·O2-)捕获剂,甲基橙的降解率降为32%,说明·O2-在催化过程中起到辅助作用;加入三乙醇胺(TEOA)作为空穴(h+)捕获剂,甲基橙的降解率降为6%,说明h+是光催化反应中的主要活性物质。

图9 加入不同的活性分子捕获剂后MO的降解率(a);光催化MO机理图(b)Fig.9 Degradation rate of methyl orange with different active molecule capture agents(a);mechanism diagram of photocatalytic methyl orange(b)
根据活性分子捕获实验,推理出光催化机理(见图9b)。当受到光照时,BiOBr中的电子(e-)吸收光子的能量进而被激发,从价带(VB)跃迁到导带(CB)上,同时在价带上产生空穴(h+)。当具有很强氧化性的空穴转移到催化剂表面的时候,能够将与之接触的MO氧化分解成CO2和H2O等物质。此时产生的光生电子迁移到与之相互接触的UiO-66-(COOH)2表面,将Zr4+还原为Zr3+,然后Zr3+与附着在催化剂表面的O2分子相互作用生成超氧根负离子(O2-),此时Zr3+会失去一个电子还原为Zr4+,而超氧根负离子(O2-)会参与MO的氧化分解过程。
4 结论
将BiOBr与UiO-66-(COOH)2复合得到复合材料BiOBr/UiO-66-(COOH)2,其粒径在700 nm左右,比表面积为85.26 m2/g,禁带宽度为2.71 eV,能够被可见光激发,对可见光的响应能力增强。将复合材料用于光催化降解MO,在氙灯照射120 min后,MO的降解率达到70%,比单纯的BiOBr和UiO-66-(COOH)2降解率高,并且在循环使用5次后依然具有较好的光催化性能。这可归因于材料的复合结构之间良好的协同效应,增强了吸光能力,降低了光生电子与空穴的复合速率,从而增强了催化剂的光催化活性。由于MOFs的性能还能够通过不同的配体和金属离子进行合理设计合成,因而更多的BiOBr/MOFs复合光催化剂将能够被开发出来,并广泛应用在处理环境污染中。
