非特异性过氧合酶GmaUPO的重组表达及生化表征
2021-12-14蓝东明乜晓爽马云建王永华
蓝东明 乜晓爽 马云建 王永华
(华南理工大学 食品科学与工程学院,广东 广州 510640)
非特异性过氧合酶(Unspecific Peroxygenase,UPO,EC 1.11.2.1)是一类可利用H2O2实现C—H键催化氧化官能化的血红素氧化酶,其催化反应类型包括羟基化、环氧化以及杂原子氧化等[1- 4]。具有同样功能的P450单加氧酶,其催化过程中需要烟酰辅酶因子NAD(P)H作为电子供体,同时伴有辅因子再生系统,其复杂的电子传递链使得反应难以广泛应用[5]。而UPO能够直接利用H2O2作为氧供体和电子受体,因而具有更高的实际应用价值[6- 11]。
Ullrich等[12]于2004年从茶树菇(Agrocybeaegerita)中首次发现了将过氧化物的氧原子转移到甲苯和萘等底物中的AaeUPO。随后,具有类似催化功能的酶在双核菌亚界(Dikarya)和高等真菌界的子囊菌门(Ascomycota)、担子菌门(Basidiomycota)中被陆续发现[1]。近年来,在遗传数据库和已测序的基因组中已有数千个假定的UPO基因被发现[13],对应于近20个类群的子囊菌和担子菌,以及十几种真菌状卵菌[14]。高效异源表达UPO基因及进行相关酶学性质表征,将有助于挖掘具有应用潜力的候选加氧酶,同时是研究此类氧化酶的结构功能关系的重要前提。然而,真菌来源的血红素氧化酶的异源高效表达一直以来都是制约上述研究的瓶颈[13]。选择适合的表达系统用于该类酶基因的重组表达十分关键。目前已被报道的可以异源表达UPO的表达系统包括毕赤酵母[15]、酿酒酵母[15]、米曲霉[16]及大肠杆菌[17]等。米曲霉高效表达系统是Novozymes公司的专利技术,因知识产权保护的原因,未公开详细的菌株、载体和发酵条件等信息。大肠杆菌表达系统易形成包涵体,虽然可通过体外活化的方式进行变复性,但针对UPO包涵体变复性的方案尚未有报道。酵母表达系统生长快、操作简单、价格低廉,并且具有类似哺乳动物细胞的翻译后修饰过程,其中,以甲醇诱导型为代表的毕赤酵母表达系统具有高表达、可诱导、易纯化分泌蛋白、易于实现高密度发酵等优点[18]。另外,由于含血红素的酶在异源宿主胞内分泌不足,合成效率过低,直接影响血红素与新生重组蛋白的结合,导致该类酶表达量不高。研究发现,通过优化发酵条件及血红素前体氨基乙酰丙酸(δ-Aminolevulinic Acid,ALA)添加量,可提高含血红素重组酶的产率[19]。
有鉴于此,本研究在NCBI上下载了来源于纹缘盔孢伞(Galerinamarginata)假定的UPO基因(GmaUPO),通过序列对比,发现该GmaUPO与报道中的AaeUPO具有67%的相似性,故选择该基因在毕赤酵母中开展了异源表达。随后,优化发酵条件,并进行重组酶的酶学性质及催化应用的初步研究,旨在扩大UPO生物酶的资源库,同时为其催化应用提供一定的研究基础。
1 材料与方法
1.1 材料与试剂
毕赤酵母菌株X- 33、质粒pPICZαA均为笔者所在实验室保存;大肠杆菌DH 5α感受态细胞购自于唯地生物科技有限公司;限制性内切酶EcoRI和SalI均购自TaKaRa大连生物工程公司;无缝克隆试剂盒购自于中美泰和生物技术(北京)有限公司;质粒提取试剂盒购自生工生物工程(上海)股份有限公司;Western blot的一抗为小鼠抗His-tag单克隆抗体,二抗为山羊抗小鼠IgG(H & L)二抗(HRP标记),均购自金瑞斯生物科技公司。
1.2 主要仪器设备
主要仪器设备如下:美国伯乐Bio-rad公司产PCR仪(T100型),德国HERMLE公司产Z216MK冷冻离心机,帝肯(上海)贸易有限公司产Infinite M NANO多功能酶标仪,北京市六一仪器厂产电泳仪(DYY- 8C型),苏州苏洁净化设备公司产SW-CJ- 1F超净工作台,日本Hirayama公司产HVE- 50高压灭菌锅,上海申贤恒温有限公司产恒温培养箱。
1.3 实验方法
1.3.1GmaUPO基因工程菌的构建
来源于Galerinamarginata的UPO编码序列(KDR72024.1)由生工生物工程(上海)股份有限公司合成。应用PCR扩增获得GmaUPO的目的基因片段(上游引物:5′-ATTATTCGAAACGAGGAATT CTTTCCAGCTTACGGATCACTA- 3′;下游引物:5′-AACTCAATGATGATGATGATGATGGTCGAC T TTGCCATAGGGAAAGACTTG- 3′),扩增条件:98 ℃ 5 min,98 ℃ 15 s、55 ℃ 15 s、72 ℃ 30 s,共50个循环,循环结束后于72 ℃下保持5 min。将经内切酶EcoRI和SalI酶切后的pPICZαA载体与扩增得到的目的基因进行连接,转至DH5α大肠杆菌感受态细胞中,并涂布至含有终质量浓度为25 μg/mL博来霉素的LB固体平板上,于37 ℃下培养12~16 h,将单菌落挑至5 mL液体LB培养基中,于37 ℃、200 r/min的条件下培养约12~16 h后,提取质粒,重组质粒进行全基因测序。
将测序正确的重组质粒pPICZαA进行线性化,通过电击穿法转化至毕赤酵母X- 33感受态细胞中,涂布至含有终质量浓度为100 μg/mL博来霉素的YPD固体平板上,于30 ℃下培养36~48 h。随后,将重组子单菌落挑至5 mL YPD液体培养基中,于30 ℃、250 r/min的条件下培养16~18 h,并利用PCR方法筛选阳性重组菌。
1.3.2 重组蛋白GmaUPO的生物信息学分析
从NCBI下载GmaUPO蛋白质FASTA序列。使用DNAMAN软件将GmaUPO基因序列与其他一系列已报道的UPO基因序列进行对比,同时在Multalin网站对GmaUPO基因序列进行同源性比对,随后通过ESPript 3.0做图。
此外,将GmaUPO氨基酸基因序列上传到Swiss-Model官网中进行基因序列识别,选择与GmaUPO同源性最高的模板进行同源建模;随后,将Swiss-Model预测的模型以PBD的格式下载,最后通过PyMOL软件获得GmaUPO的预测结构。
1.3.3 重组蛋白GmaUPO的表达
将阳性单克隆接种至50 mL BMGY培养基中,于30 ℃、250 r/min的条件下培养至菌体吸光度为0.8~1.0,按10%的接种量接种至400 mL BMMY培养基中,同时添加终浓度为45 μmol/L的ALA,于22 ℃、250 r/min的条件下诱导96 h,每24 h添加甲醇(1%)进行诱导,同时以不含目的基因的毕赤酵母菌株作为对照。发酵结束后,将发酵液用冷冻离心机在4 ℃、12 000 r/min的条件下离心10 min,收集上清液进行检测。同时利用Western Blot检测重组蛋白的表达情况,检测的抗体为特异性His标签抗体。同时,在发酵过程中进一步优化了发酵条件,包括诱导温度(28、25、22 ℃)和ALA浓度(5、25、45、65、85 μmol/L)。
1.3.4GmaUPO的酶活力检测
采用5-硝基- 1,3-苯并二恶唑(NBD)作为GmaUPO的酶活力检测底物[19]。具体方法如下:在96孔板中加入100 μL磷酸盐缓冲液(100 mmol/L、pH 7.0)、30 μL NBD(6.6 mmol/L)、20 μL去离子水、30 μL酶液、20 μL H2O2(20 mmol/L),在425 nm 下测定吸光度。所有实验平行3组,同时以高温灭活的上清液作为对照。
酶活力单位定义为:每分钟水解底物NBD生成1 μmol的4-硝基邻苯二酚所需的酶量为1个活力单位(U)。
1.3.5GmaUPO的生化表征
(1)pH值对GmaUPO酶活力的影响
测定GmaUPO的最适pH值及pH耐受性。选择pH值范围为4.0~10.0的7种缓冲溶液对GmaUPO的活性变化进行探讨(pH=4.0,5.0时为100 mmol/L的柠檬酸盐缓冲液;pH=6.0,7.0,8.0时为100 mmol/L的磷酸盐缓冲液;pH=9.0,10.0时为100 mmol/L的Tri-Hcl缓冲液)。将最高酶活力定义为100%,其余以相对酶活力表示。进一步研究了pH值对酶稳定性的影响,将GmaUPO在不同pH值的缓冲溶液中于4 ℃下孵育2 h后,测定酶活力残余值,检测其pH值耐受性。将孵育前的酶活力定义为100%,其余以相对酶活力表示。
(2)温度对GmaUPO活力的影响
测定GmaUPO的最适温度及热稳定性。在最适pH值下,选择不同温度(20~45 ℃)研究GmaUPO酶液的活性变化,将最高酶活力定义为100%,其余以相对酶活力表示。进一步研究温度对酶稳定性的影响,将适量的GmaUPO置于不同温度下,每隔一定时间取样进行酶活力检测,以测定其温度耐受性。将热处理前的酶活力定义为100%,其余以相对酶活力表示。
1.3.6GmaUPO的催化氧化特性研究
采用胆碱氧化酶催化氯化胆碱在线产生H2O2的级联催化反应体系[17],对GmaUPO催化氧化乙基苯底物进行研究。反应产物利用三重串联四极杆气质联用仪GC-MS进行检测分析。具体催化反应步骤如下:将400 μL磷酸盐缓冲液(50 mmol/L,pH=7.0)和100 μL氯化胆碱溶液(1 mol/L)加入反应玻璃瓶中,充氧后,加入50 μL胆碱氧化酶(100 μmol/L,AnChOx)酶液、400 μLGmaUPO酶液和5 mmol/L底物,最后用磷酸盐缓冲液(50 mmol/L,pH=7.0)将反应体积补足到1 mL。将该反应体系置于恒温油浴锅中进行反应,反应温度30 ℃,转速500 r/min。反应结束后,利用1 mL乙酸乙酯萃取,离心后取上层有机层进行检测。
三重串联四极杆气质联用仪GC-MS检测条件:初始温度50 ℃,以10 ℃/min的速率升温至190 ℃,保持3 min,再以5 ℃/min的速率升温至230 ℃,保持6 min。
2 结果与讨论
2.1 GmaUPO的序列分析
经ExPASy官网预测,假定非特异性过氧合酶GmaUPO成熟肽基因长度为1 059 bp,编码353个氨基酸,预测蛋白分子质量为38.3 ku。为进一步探究其序列特征,在MuLtalin网站上对GmaUPO序列与其他已报道的UPO进行序列比对分析(见图1),同时使用ESPript做图,结果显示GmaUPO与目前报道的UPOs序列相似度在15.49%~67.23%范围内,且GmaUPO含有UPO特征的催化保守序列Pro60-Cys61-Pro62、Glu147-Gly148-Asp149和Arg190-Glu197(见图1绿色框)。
为进一步了解GmaUPO催化活性中心的结构特征,将GmaUPO的成熟肽氨基酸序列上传至Swiss-Model官网,选择序列相似度高达67%的AaeUPO为模板(PDB ID:5YO2),结果用PyMOL软件显示,如图2(a)所示。在GmaUPO的催化活性口袋内部,Pro60-Cys61-Pro62(PCP区域)中的半胱氨酸与血红素形成共价键,起到稳定血红素的作用;Glu147-Gly148-Asp149(EGD区域)和Ser151-Met152-Thr153(SMT区域)起到稳定血红素和镁离子的作用。另外,苯丙氨酸被认为是组成血红素口袋的关键氨基酸,与将底物引导至活性位点有关,对催化反应的发生有关键作用[16]。从图2(b)可知,GmaUPO催化活性口袋周围包含10个苯丙氨酸,这进一步说明,假定的GmaUPO具有UPO的催化特性。
2.2 GmaUPO的基因工程菌构建及表达
为了验证GmaUPO的催化活性,将全基因合成的GmaUPO克隆到毕赤酵母表达载体中并转化毕赤酵母。利用PCR技术验证筛选GmaUPO基因毕赤酵母阳性重组子。随后,将阳性重组酵母菌株在甲醇诱导培养基中培养发酵,并利用组氨酸标签单克隆抗体进行Western blot检测分析,结果如图3所示。发酵上清样品中有明显的蛋白表达条带,分子质量约为40 ku,与预测的GmaUPO大小相一致。

上方序号代表氨基酸的位置;绿色框代表UPO催化活性中心保守序列

(a)GmaUPO催化中心结构示意图

(b)GmaUPO催化活性口袋周围苯丙氨酸位置示意图

M—蛋白Marker;1—工程菌发酵上清样品
一般而言,低温条件下新生蛋白在细胞内更容易折叠,同时呈现出更高的生理活性。而高浓度的ALA会抑制细胞的繁殖,呈现一定的毒化作用。经发酵优化可知(如图4所示):同条件下添加85 μmol/L 的ALA,GmaUPO酶活力仅为添加45 μmol/L ALA时的16%~53%;而在诱导温度为22 ℃、ALA终浓度为45 μmol/L的条件下,发酵酶液的酶活力最佳,最高可达6 U/L,因此,优选出最佳的ALA浓度对含血红素蛋白酶的表达尤为重要。

图4 发酵条件优化结果
2.3 GmaUPO的酶学性质
2.3.1 pH值对GmaUPO酶活力的影响
以NBD为检测底物,GmaUPO酶液的最适反应pH值为9.0,溶液pH值为8.0和10.0时酶活力可维持在最高活力的60%左右,而在其他pH值缓冲液中酶活力均受到抑制。随后,研究了GmaUPO在不同pH值缓冲液下孵育2 h的稳定性,结果如图5(b)所示。在pH=7.0以下的缓冲溶液中孵育后,GmaUPO的相对酶活力低于70%,而在pH为7.0~10.0的缓冲溶液中孵育后,GmaUPO的相对酶活力高于70%,说明GmaUPO在碱性环境中的催化活性更佳。

(a)pH值对GmaUPO酶活力的影响

(b)pH值对GmaUPO酶活力稳定性的影响
2.3.2 温度对GmaUPO酶活力的影响
如图6(a)所示,GmaUPO酶液催化NBD的最适温度为35 ℃,而在其他温度(20~40 ℃)下相对酶活力仍保持在60%以上。热稳定性实验结果显示,GmaUPO在25和30 ℃的条件下,1 h内可保持初始活力的80%,而3 h后其活力均低于初始活力的30%。45 ℃下孵育3 h后,GmaUPO酶活已基本无法检出。
2.4 GmaUPO的催化应用初探
β-苯乙醇作为香精香料可应用于食品行业、药物开发等领域[6]。目前的制备方法主要是化学合成法,存在反应过程复杂、能耗高及环境不友好等问题。因此,酶法催化合成是一个有前景的替代方法。为了验证GmaUPO催化乙基苯生成β-苯乙醇的可行性,文中采用胆碱氧化酶与GmaUPO级联催化氧化乙基苯的反应途径,并采用三重串联四极杆气质联用仪GC-MS进行分析,结果如图7所示。乙基苯和β-苯乙醇的保留时间分别为5.071和9.431 min,在4h内β-苯乙醇的转化率达3.2%(见表1),表明重组GmaUPO具有催化底物羟基化的活性。
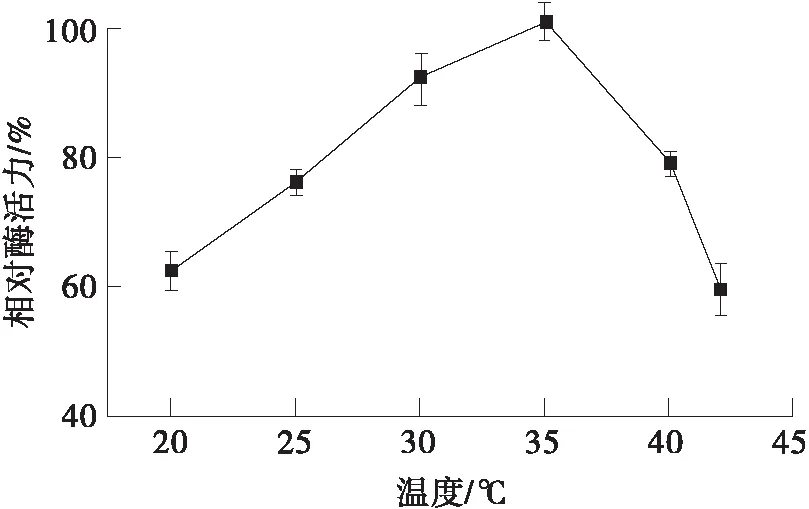
(a)温度对GmaUPO酶活力的影响

(b)温度对GmaUPO酶活力稳定性的影响

(a)反应体系的气相色谱图

(b)保留时间为5.071 min时的质谱图

(c)保留时间为9.431 min时的质谱图

表1 GmaUPO的反应参数
3 结论
本研究从纹缘盔孢伞的基因组中挖掘了一个假定的非特异性过氧合酶(GmaUPO),通过全基因合成技术获得了GmaUPO的基因序列,并实现了在毕赤酵母X- 33中的重组表达,通过研究其催化氧化底物的特性,证实其具有过氧合酶的催化活力,并具有合成香料物质分子的应用潜能。本研究不仅丰富了非特异性过氧合酶的种类,还为GmaUPO在工业催化中的应用提供了理论基础。未来的工作中,需对GmaUPO进行分子定向进化来进一步提高其酶活力和表达量,解析GmaUPO的三维结构,研究其催化底物的偏好性,拓展其应用范围。
