凝结芽孢杆菌13002的安全性及潜在功能特性
2021-12-14刘冬梅赵珊周钦育黄燕燕南树港
刘冬梅 赵珊 周钦育 黄燕燕 南树港
(华南理工大学 食品科学与工程学院,广东 广州 510640)
凝结芽孢杆菌(Bacilluscoagulans)属厚壁菌门(Firmicutes),革兰氏阳性,兼性厌氧,具有非致病性,芽孢端生,可产乳酸[1- 2],其最适生长温度为35~50 ℃,最适生长pH值为5.5~6.5,形成的芽孢具有耐高温、耐酸和耐胆盐等高抗逆性特点[3]。据报道,凝结芽孢杆菌通常从含有牛奶和碳水化合物的产品中分离出来,嗜热性较强,可在pH 6.2、65 ℃的条件下生长,能分解糖类生成L-乳酸,还可产生一些热稳定性淀粉酶,但不能利用麦芽糖、棉子糖、甘露醇和蔗糖发酵产气[4]。与芽孢杆菌属其他物种的中心或亚末端生孢子不同,凝结芽孢杆菌孢子是末端生。此外,由于不存在细胞色素-C氧化酶,它不能将硝酸盐还原为亚硝酸盐[2]。
凝结芽孢杆菌是益生菌中的后起之秀,关于其益生机理的研究较少,但已有研究发现,其可分泌多种代谢产物来调节机体的生理功能,也可与其他菌群相互协同进行机体功能的调节[5],如调节消化道菌群的平衡——凝结芽孢杆菌兼性厌氧菌,当机体摄入并进入肠道后,其生长繁殖会不断消耗游离氧,降低肠道内的氧化还原电势,从而改善厌氧益生菌的生长环境,同时抑制需氧有害菌的生长[6]。此外,凝结芽孢杆菌可分泌产生凝结素(Lectin)抑制链球菌(Streptococcus)、金黄色葡萄球菌(Staphylococcusaureus,S.aureus)等有害菌的生长繁殖,提高机体的抗病毒力,减少疾病的发生[7]。研究还证实,其可在一定程度上抑制病原真菌的生长并减缓麦角固醇类物质的合成[8]。已有研究[9- 11]发现,凝结芽孢杆菌能提高动物机体免疫力,促进生长。例如,王乙茹等[10]发现,凝结芽孢杆菌YNAU 5517能够在一定程度上改善热应激肉鸡的生产性能;王明阳等[11]发现,饲喂凝结芽孢杆菌可有效促进凡纳滨对虾的生长,提高其血清非特异性免疫水平和对副溶血弧菌的抗病力。相关机理研究[12]表明,凝结芽孢杆菌可有效识别消化道内具有免疫佐剂功能的抗原部位,并使相关淋巴组织处于紧张的免疫准备状态,加速免疫器官及免疫系统的发育、T淋巴细胞和B淋巴细胞的增加、单核-巨噬细胞的吞噬和分泌、体液和细胞免疫水平的提高。
近年来,人们越来越主张健康的食品消费方式,益生菌也因其安全、益生作用明显等优势而受到越来越多科研工作者的青睐。我国益生菌菌种研究起步较晚,目前我国市场上流通的益生菌菌种多为国外引进[13]。凝结芽孢杆菌能产生多种酶类,具有促消化吸收及提高饲养动物成活、生长的功能[14],目前已有含凝结芽孢杆菌活菌的相关药物面世,被用于治疗因肠道菌群失调引起的急、慢性腹泻,慢性便秘,腹胀和消化不良等[15],但有关凝结芽孢杆菌潜在功能特性的研究却鲜见报道。有鉴于此,文中对凝结芽孢杆菌的安全性及潜在功能特性进行研究,以期为进一步的应用打下基础。
1 材料与方法
1.1 材料与试剂
凝结芽孢杆菌13002(CGMCC NO.7431)、植物乳杆菌(Lactobacillusplantarum)DMDL 9010(CGMCC NO.5172),由华南理工大学食品质量与安全实验室从中国传统发酵泡菜中分离筛选得到,保存于中国微生物菌种保藏管理委员会普通微生物中心;大肠杆菌(Escherichiacoli,E.coli)ATCC 25922、金黄色葡萄球菌ATCC 12598,均购于广东省微生物保藏中心。
注射用环磷酰胺,国药准字H 32020857,江苏盛迪医药有限公司生产;左旋咪唑,国药准字H37020819,山东仁和堂药业有限公司生产;oligo低聚果糖,量子高科(中国)生物工程有限公司生产;IgA检测试剂盒、IgG检测试剂盒、IgM检测试剂盒,南京建成生物工程研究所生产;SIgA酶联免疫分析试剂盒、IL- 4酶联免疫分析试剂盒、IFN-γ酶联免疫分析试剂盒,上海抚生实业有限公司生产。
1.2 仪器与设备
680型多功能酶标仪,美国Bio-Rad伯乐公司生产;SCIENTZ- 18N型冷冻干燥机,宁波新芝生物科技股份有限公司生产;SIEMENS型血液分析仪,西门子医学诊断产品有限公司生产;AU640型全自动生化分析仪,OLMPUS OPTICAL有限公司生产。
1.3 安全性评价方法
SPF级KM小鼠20只(体质量为18~22 g),由广东省医学实验动物中心提供。根据GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》[16]中的方法并略做改动,进行凝结芽孢杆菌13002的安全性评价。采用限量法,将凝结芽孢杆菌冻干粉稀释为108CFU/mL的淡黄色菌液,只设10.0 g/kg(以小鼠体质量为基准计算,下同)一个剂量组。每天一次空腹灌胃,每次灌胃量为20.0 mL/kg(以小鼠体质量为基准计算),观察14 d。按文献[16]中4.3.2.4节及其附录G所述方法评价并判断毒性分级。
凝结芽孢杆菌冻干粉制备方法为:将凝结芽孢杆菌13002活菌菌液按3%的体积分数接种于其液体培养基中,于45 ℃、120 r/min下活化培养24 h,经2至3次活化培养后,将种子液于发酵罐中扩大培养,将扩大培养后的菌液于4 ℃、8 000 r/min下离心10 min,用无菌生理盐水洗涤离心3次后,取菌泥,按1:3的菌泥:保护剂质量比混匀(保护剂制备方法:10%的脱脂奶粉及10%的海藻糖溶于0.9%的生理盐水,85 ℃下灭菌30 min),于-40 ℃下预冻,冷冻干燥后收集冻干粉,凝结芽孢杆菌冻干粉活菌数为6.15×1010CFU/g;将其于-20 ℃下保存,备用。
1.4 模拟胃液中的耐受性评价方法
根据文献[17]方法进行模拟胃液中的耐受性评价:按10%的接种量(体积分数,下同)将菌悬液接种至模拟胃液中(pH值分别为2.0、2.5、3.0、4.0、5.0),混合均匀,于37 ℃下恒温避光培养0、1、2、3、4 h后取样,进行平板菌落计数,同时设添加与模拟胃液等体积的蒸馏水的样品为空白对照组。
根据文献[17]方法进行模拟肠液中的耐受性评价:按10%的接种量将菌悬液接种至模拟肠液中,混合均匀,于37 ℃下恒温避光培养0、2、4、6、8 h后取样,进行平板菌落计数,同时设添加与模拟肠液等体积的蒸馏水的样品为空白对照组。
根据文献[17]方法进行胆盐耐受性评价:按10%的接种量将菌悬液分别接种至含有0.00%、0.03%、0.10%、0.20%、0.30%、0.50%牛胆盐的水溶液中,混合均匀,于37 ℃下恒温避光培养0、1、2、3 h后取样,进行平板菌落计数,同时设添加与牛胆盐溶液等体积的蒸馏水的样品为空白对照组。
无菌条件下,按10%的接种量将菌悬液接种至pH=3.0的模拟胃液中,混合均匀,于37 ℃下恒温避光培养3 h后,用1 mol/L的NaOH调pH值至8.0,再加入等体积的模拟肠液和0.3%的胆盐溶液,于37 ℃下恒温避光培养4 h后,进行平板菌落计数,同时设添加与消化液等体积的蒸馏水的样品为空白对照组。
1.5 抑菌能力评价方法
将活化后的菌液按5%的接种量接种于其液体培养基中,扩大培养48 h后,得到发酵液。将上述发酵液于4 ℃、8 000 r/min下离心10 min,用无菌生理盐水洗涤离心3次后,重悬,得菌悬液。取部分菌悬液超声破碎30 min,得破碎菌体悬浮液。将上述发酵液于4 ℃、8 000 r/min下离心10 min,取上清,得到上清液。将上述上清液用0.22 μm水系滤膜过滤除菌,得到无菌发酵液。
根据文献[18]的方法进行抑菌能力的评价:以大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 12598为指示菌种,取无菌生理盐水将两株指示菌稀释至106~107CFU/mL后,吸取0.1 mL涂布于LB琼脂培养基表面,将牛津杯中心对称放置于培养基表面,每个牛津杯内注射100 μL上述待测样品液,置于4 ℃下扩散24 h后,于37 ℃下恒温培养24 h,观察并测量抑菌圈直径大小。
取大肠杆菌ATCC 25922和金黄色葡萄球菌ATCC 12598培养液,于6 000 r/min下离心15 min得到菌体,用无菌生理盐水洗涤3次,接种至凝结芽孢杆菌13002上清液,于37 ℃下恒温培养4 h,根据文献[19]方法进行脱水处理后,用SEM电镜扫描观察并拍照。
1.6 体内潜在功能特性评价方法
1.6.1 动物分组及处理
SPF级Balb/c雄性小鼠50只(体质量为18~22 g),由南方医科大学提供。适应性饲养7 d后,随机均分成5组,各组间体质量无显著差异,其中,免疫抑制组(CTX)、阳性对照组(LMS)、凝结芽孢杆菌组(BCS)、凝结芽孢杆菌+低聚果糖组(BCS+FOS)通过连续3 d腹腔注射环磷酰胺(注射量50 mg/kg)建立免疫低下小鼠模型。按图1方式对小鼠进行灌胃,连续灌胃2周,各样品灌胃量为10.0 mL/kg。记录小鼠每天的体质量变化,以便调整灌胃量。具体分组及试验过程如图1所示。

图1 试验分组及过程设计
1.6.2 一般指标的观察方法
试验开始后观察小鼠的食欲、毛发、大便、活动状况及存活情况等,每天记录小鼠的体质量,称量喂食量和剩余食量,计算日摄食量,并计算饲料利用率。相关计算公式如下:
日均体质量增加量(g/d)=平均增重/试验天数,
日均摄食量(g/d)=平均饲料消耗量/试验天数,
饲料利用率(%)=(日均体质量增加量/日均摄食量)×100%。
1.6.3 器官指数的测定方法
末次灌胃24 h后,称量小鼠体质量,处死小鼠,解剖并分离取出肝脏、脾脏和肠道等样本,用生理盐水漂洗后,用测量尺测量小肠的自然长度,滤纸吸干水分,称重。相关计算公式如下:
器官指数(mg/g)=器官质量/体质量,
小肠指数(cm/g)=小肠长度/体质量。
1.6.4 血常规及血清生化指标的测定方法
末次灌胃后,予小鼠禁食不禁水24 h,摘除小鼠眼球取全血50 μL,通过血液分析仪对小鼠全血进行检测。全血离心后取血清,通过全自动生化分析仪测定其各项指标,包括L-乳酸脱氢酶(LDH)、谷丙转氨酶、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、总蛋白、白蛋白、球蛋白。
1.7 统计学分析方法
采用IBM SPSS Statistics 24.0软件对结果进行t检验和单因素分析,所有测定结果均用“均值±方差”的形式表示,P<0.05表示组间有显著差异。
2 结果与分析
2.1 凝结芽孢杆菌13002的安全性
益生菌的安全性与其预期用途相关。益生菌应用时需具有菌活,而且,与其他食品或药物成分不同,益生菌具有潜在的传染性。为了确保益生菌在应用时的活性并避免其传染性,世界卫生组织制定了《食品益生菌评价指南》[20],该指南为益生菌的临床前检测、临床试验以及在体外和动物模型下的菌种鉴定、安全性评价和功效测试等提供了参数。益生菌在应用到食品或保健品之前,其安全性评价已被列为筛选潜在益生菌的重要标准和首要步骤。表1所示为凝结芽孢杆菌13002对KM小鼠的急性经口毒性试验结果。试验期间,实验动物的体质量显著增加(P<0.05),在用凝结芽孢杆菌13002菌液灌胃后,没有观察到两组别的小鼠有中毒和死亡迹象,且两组别的小鼠在试验期间活跃,皮肤和眼睛颜色没有任何异常变化。试验结束后,对小鼠进行解剖,肉眼未见异常。由此可知,活菌数为108CFU/mL的凝结芽孢杆菌13002菌液对雌雄性KM小鼠急性经口毒性LD50>20.0 mL/kg,属于安全无毒级。

表1 凝结芽孢杆菌13002对KM小鼠的急性经口毒性试验结果1)
2.2 凝结芽孢杆菌13002的耐受性
研究发现:胃的低pH值和胃蛋白酶的抗菌作用是防止细菌进入肠道的有效屏障;进食后胃的pH值最低至1.5,最高达6.0,但一般维持在2.5~3.5;食物的状态影响其在胃中的运输时间,正常情况下,食物在胃里停留2~4 h,其中液体从胃里排出的速度比固体快,大约只需要20 min就可通过胃[21]。由图2(a)可知:凝结芽孢杆菌13002在不同pH值体外模拟胃液中的存活率随pH值的降低而降低;在pH为3.0~5.0的模拟条件下,作用3 h后,菌株的存活率均大于80%;当pH值降低至2.5或2.0时,随作用时间的延长,菌株存活率显著降低(P<0.05),这与Zárate等[22]的研究结果相符,即所有试验乳酸杆菌在pH=4.0的条件下存活良好,几种菌株在pH=3.0时略微丧失生存力,但所有测试的菌株在pH=2.0时基本丧失生存力。吴丹阳[23]在研究中发现,凝结芽孢杆菌T 242在pH=3.0的模拟胃液中耐受3 h后,存活率为87.49%,与文中研究结果相符。以上结果表明,文中试验菌株可耐受pH=3.0的模拟胃液环境,且在pH=2.0的环境中存活率大于50%。

(a)对模拟胃液的耐受性

(b)对模拟肠液的耐受性

(c)对胆盐的耐受性

(d)对模拟胃肠液的耐受性
益生菌可存活并发挥其功能的另一个屏障是小肠,小肠中含有胆盐和胰蛋白酶等[24]。食物通过小肠的转运时间一般为1~4 h,小肠的pH值约为8.0[21]。益生菌的胆盐耐受性可通过测定其在胆盐存在下的生存能力以及在不同含量胆盐的选择性培养基中的生长状况进行判断。研究发现,被推荐为供人类使用的益生菌的胆盐耐受含量为0.15%~0.30%[25]。图2(b)所示为模拟肠液环境下凝结芽孢杆菌13002的存活率,当作用4 h时,菌株存活率仍在95%左右,说明试验菌株对模拟肠液具有较高的耐受性;随着作用时间的进一步延长,存活率显著下降,这可能是因为模拟环境中缺少微生物生长所必需的营养物质,加剧了菌株存活率的下降。
进一步探究不同胆盐含量下凝结芽孢杆菌13002的存活率(见图2(c)),发现在0.03%~0.30%的胆盐含量范围内,菌株存活率均保持在84%以上,且在0.5%的胆盐含量下,菌株仍具有较高的存活率(大于80%),这与Piret等[26]的研究结果相符——97%的试验菌株可耐受高含量胆盐且所有菌株菌活均不受胰蛋白酶浓度的影响。以上结果表明,文中试验菌株对模拟小肠环境中的胰蛋白酶和胆盐具有较高的耐受性。
为更好地评价凝结芽孢杆菌13002对胃肠道环境的耐受性,进一步进行模拟食物在胃肠道中的消化过程,结果如图2(d)所示。经7.0 h的模拟胃肠道消化液作用后,凝结芽孢杆菌13002的存活率仍保持在70%以上。
综合上述试验结果可知,凝结芽孢杆菌13002对模拟胃液、肠液、胆盐均具有良好的耐受性,且在模拟胃肠道消化液中可保持较高的活菌数,有益于菌株在胃肠道内以较高的活菌数到达其作用靶点,发挥益生功效。
2.3 凝结芽孢杆菌13002的抑菌能力
抑菌活性是评价益生菌的重要指标之一。研究发现,凝结芽孢杆菌可消耗游离氧,在促进厌氧益生菌生长的同时可以抑制需氧有害菌的生长。此外,Le Marrec等[27]发现,凝结芽孢杆菌在代谢过程中可产生一种抗菌肽——凝结素。因此,文中以金黄色葡萄球菌ATCC 12598(G+)和大肠杆菌ATCC 25922(G-)为指示菌,采用牛津杯法探究试验菌株的抑菌活性,结果如表2和图3所示。

表2 不同处理下待测样品的抑菌圈直径1)
上清液对两种指示菌的抑菌活性明显最高,菌悬液和无菌发酵液的抑菌活性无显著差异,菌体破碎液的抑菌活性最差。其原因可能是凝结芽孢杆菌13002在代谢过程中会产生并分泌一些有机酸类、肽类等抑菌物质,而在超声破碎、无菌处理过程中,这些抑菌物质失活或遭到破坏,因此使得上清液的抑菌活性显著高于无菌发酵液和菌体破碎液;上清液的抑菌活性显著高于菌悬液,这可能是因为在试验菌株代谢过程中所产生的有机酸对指示菌有一定的抑制作用;菌悬液的抑菌活性显著高于菌体破碎液,这种差异可能主要是因为试验菌株为兼性厌氧菌,会与环境中的指示菌竞争营养、氧气等,从而降低氧化还原电势,抑制指示菌的生长。
为进一步探究试验菌株对指示菌的抑菌能力,采用抑菌效果最好的上清液与指示菌共培养,观察其对指示菌形态的影响,结果见图4。由图4(a)、4(c)可知,未经处理的对照组,大肠杆菌和金黄色葡萄球菌细胞完整无破损,形态饱满,表面光滑;由图4(b)、4(d)可知,试验处理后,大肠杆菌和金黄色葡萄球菌的细胞形态明显发生改变,严重皱缩,表面出现凹陷,甚至还有一些原生质外漏,且对大肠杆菌的形态破坏明显严重于金黄色葡萄球菌,这与前述抑菌圈直径的测量结果一致,可能是由于革兰氏阳性菌与革兰氏阴性菌的细胞壁结构不同而产生的差异。

(a)大肠杆菌

(b)金黄色葡萄球菌

(a)对照组,大肠杆菌
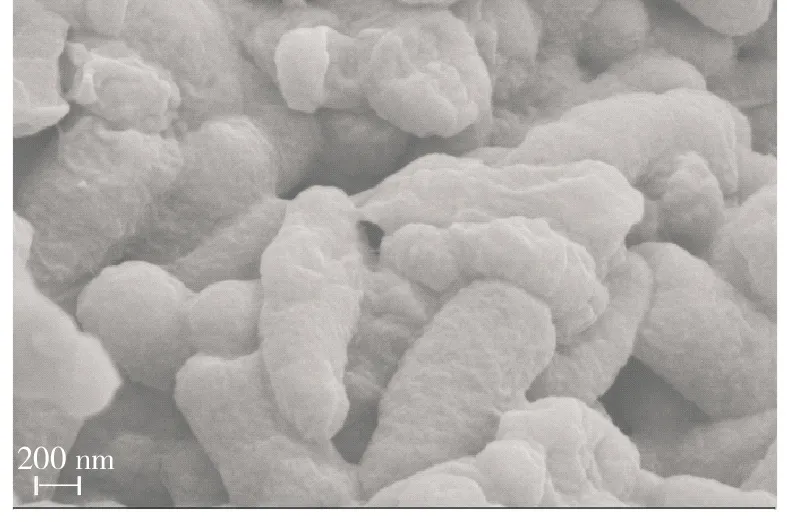
(b)试验组,大肠杆菌

(c)对照组,金黄色葡萄球菌

(d)试验组,金黄色葡萄球菌
综上,凝结芽孢杆菌13002对指示菌均有一定的抑菌活性,且对指示菌株大肠杆菌(G-)的抑菌效果要优于金黄色葡萄球菌(G+)。
2.4 凝结芽孢杆菌13002对小鼠体质量的影响
CTX组、LMS组、BCS组、BCS+FOS组连续3天腹腔注射50 mg/kg环磷酰胺后,各组小鼠的体质量均显著降低,说明试验建模成功。图5所示为各组实验小鼠的每日体质量变化。试验期间各组小鼠活动正常,且随试验时间的延长,各组小鼠的体质量均呈持续性增加的趋势。其中,试验期间对照组总增重2.21 g,CTX组总增重1.03 g,LMS组总增重2.21 g,BCS组总增重1.76 g,BCS+FOS组总增重1.62 g。说明环磷酰胺可影响小鼠的正常生长;而补充治疗左旋咪唑后,小鼠的体质量增加恢复正常;补充BCS及BCS+FOS后,小鼠的生长也有所恢复,且总增重与对照组无显著差异(P<0.05)。

图5 各组实验小鼠每日体质量的变化
表3为各组实验小鼠的摄食量及饲料利用率。各组小鼠的日均体质量增加量在0.44~0.95 g/d之间,日均摄食量在3.72~4.49 g/d之间,饲料利用率在6.04%~8.18%之间。其中,CTX组日均体质量增加量与其他组存在显著差异,说明环磷酰胺建模成功,使得实验小鼠免疫低下;而BCS、BCS+FOS组与对照组在日均体质量增加量、日均摄食量、饲料利用率指标上均无显著差异,综合2.1节内容可进一步说明,凝结芽孢杆菌13002对实验小鼠无毒副作用;且LMS、BCS、BCS+FOS组的日均体质量增加量、饲料利用率均显著高于CTX组,初步说明补充治疗后小鼠免疫能力得到了提高。

表3 各组实验小鼠的摄食量及饲料利用率
2.5 凝结芽孢杆菌13002对小鼠器官指数的影响
器官指数是衡量机体器官发育和功能的重要指标。表4所示为各组实验小鼠的器官指数。由表4可知,各组别小鼠的肝体比、肺体比、肾体比均无显著差异,即凝结芽孢杆菌13002及低聚果糖的施用对肝、肺、肾器官无毒害作用。CTX组的脾体比显著低于其他组,这与安松兰等[28]的研究结果相符,脾脏是机体最大的淋巴器官,是免疫应答的重要场所,其含有大量的巨噬细胞、淋巴细胞、浆细胞等多种免疫细胞,经补充治疗后,LMS、BCS、BCS+FOS组的脾体比均显著增大,且接近对照组,初步说明BCS、BCS+FOS同LMS一样具有一定的免疫治疗作用。
器官指数可反映机体的消化吸收及发育情况。表5所示为各组实验小鼠的肠道器官指标。由表5可知:CTX、LMS组的小肠指数显著降低,说明小肠可能受到了损伤,影响消化吸收功能;BCS、BCS+FOS组的小肠指数显著提高,且接近对照组,说明BCS及BCS+FOS可在一定程度上促进小肠的发育及对营养物质的吸收。

表4 各组实验小鼠的器官指数

表5 各组实验小鼠的肠道器官指标
2.6 凝结芽孢杆菌13002对小鼠血常规的影响
血常规检测也称全血细胞计数或全血细胞分析,能够较准确地反映动物机体的健康状况。由表6可知,各组别的淋巴细胞百分比LY、中间细胞百分比MO、中性粒细胞百分比GR、红细胞计数RBC、血红蛋白HGB、红细胞压积HCT、平均RBC血红蛋白MCH、平均血小板体积MPV、血小板分布宽度PDW均差异显著(P<0.05),而其他血常规指标无显著差异。从整体来看,补充治疗BCS、BCS+FOS后可一定程度缓解注射环磷酰胺后血常规指标的变化,使各组别的指标接近对照组。

表6 各组实验小鼠的血常规结果
2.7 凝结芽孢杆菌13002对小鼠血清生化指标的影响
表7所示为各组实验小鼠血清中的谷丙转氨酶(ALT)、L-乳酸脱氢酶(LDH)含量。由表7可知,BCS、BCS+FOS组的ALT活性在正常范围内高于对照组,ALT是由肝脏释放进入血液的,说明机体蛋白质沉积加速,糖代谢加速,促进了生长;CTX组中该酶含量较高,研究发现,当组织发生病变时,该酶活力会增多。CTX组的LDH含量显著高于其他组别,而其他组别间无显著差异。LDH广泛分布于机体各器官中,当组织受到损伤时,会释放出大量的LDH,使血液中的LDH活性提高[29]。表7结果表明,环磷酰胺对机体组织有一定的损伤,经过补充治疗后,这种损伤有所恢复。

表7 各组实验小鼠的血清谷丙转氨酶、L-乳酸脱氢酶含量
血清中总蛋白(TP)、白蛋白(ALB)的含量是衡量机体蛋白质吸收和代谢状况的有效指标,球蛋白(GLB)的含量则与机体的体液免疫密切相关。表8所示为各组实验小鼠血清中的蛋白含量。由表8可知:CTX组的TP含量相比对照组有所提高,但白蛋白-球蛋白比(A-G比)却显著降低,这可能是因为环磷酰胺使蛋白丢失过多且消耗增加;补充LMS、BCS、BCS+FOS后蛋白含量有所恢复,说明LMS、BCS、BCS+FOS可在一定程度上促进蛋白质的消化、吸收,提高氨基酸的利用率。与对照组相比,其他组别的GLB含量显著提高。GLB是一种存在于人体中的血清蛋白,具有免疫作用,当外来物入侵时,会刺激机体产生一定量的GLB,而当入侵物相对难以消灭时,会继续刺激机体继续产生更多的GLB,直到入侵物被消灭。表8结果表明,环磷酰胺造模后机体均产生了免疫应激作用。

表8 各组实验小鼠血清中的蛋白含量
血清尿素氮(BUN)水平反映了机体内蛋白质和氨基酸代谢间的平衡状况,当蛋白质合成率较高时BUN较低;血清葡萄糖(Glu)作为机体糖代谢的指标,可以反映机体内糖代谢的情况,血清中葡萄糖含量越低,说明机体对葡萄糖利用率越高,机体内糖代谢也就越强。表9所示为各组实验小鼠血清中的BUN、Glu含量。由表9可知,与CTX组相比,其他组别的BUN、Glu含量显著较低,说明补充治疗对提高蛋白质合成率及葡萄糖利用率有积极的作用。
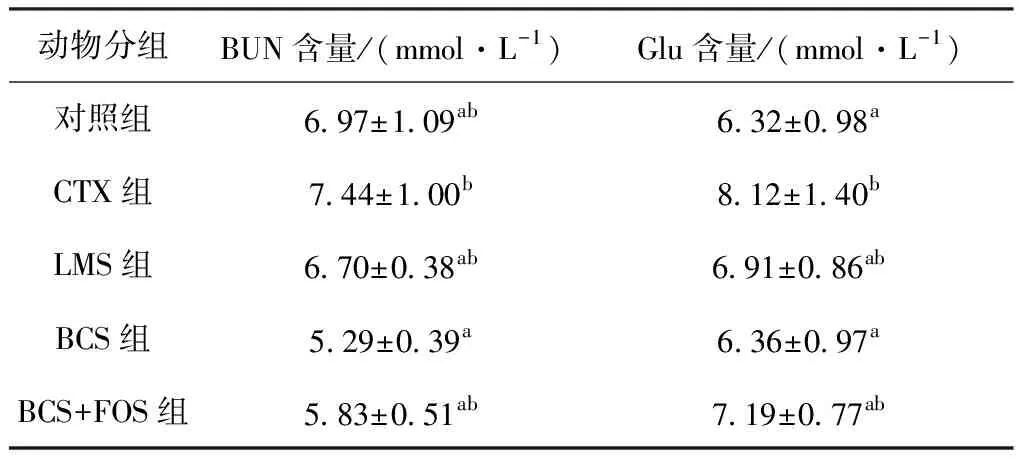
表9 各组实验小鼠血清中的尿素氮、葡萄糖含量
表10所示为各组实验小鼠血清中的血脂含量,其中血清中总胆固醇(CHO)、甘油三酯(TG)是反映机体脂类代谢功能的重要指标,血清中总胆固醇和甘油三酯含量的异常升高可能预示机体内脂蛋白代谢异常,容易引起心、脑血管等方面的疾病;高密度脂蛋白(HDL-C)能清除组织细胞中的胆固醇,确保体内胆固醇浓度的相对稳定。由表10可知,BCS、BCS+FOS可降低TG、CHO、LDL-C含量,提高HDL-C含量,清除小鼠体内多余的胆固醇,维持胆固醇的稳定。

表10 各组实验小鼠血清中的血脂含量
3 结论
文中对凝结芽孢杆菌13002进行了安全性及潜在功能特性的探究。首先通过小鼠急性毒理试验,确认了凝结芽孢杆菌13002的安全性。研究发现,活菌数为108CFU/mL的凝结芽孢杆菌13002菌液对KM小鼠急性经口毒性LD50>20.0 mL/kg,属于无毒级。同时测定了试验菌株对模拟胃肠道环境的耐受性,发现其对胃液、肠液、胆盐均具有良好的耐受性,且在模拟胃肠道消化液中可保持较高的活菌数。以金黄色葡萄球菌ATCC 12598(G+)和大肠杆菌ATCC 25922(G-)为指示菌探究其抑菌活性,发现凝结芽孢杆菌13002对两株指示菌均具有一定的抑菌能力,且上清液的抑菌活性最高,可明显破坏指示菌的微观结构。
进一步对凝结芽孢杆菌13002(BCS)及凝结芽孢杆菌13002+低聚果糖(BCS+FOS)进行了动物实验以探究其免疫调节作用,发现环磷酰胺可影响小鼠的正常生长,而补充治疗左旋咪唑后,小鼠的体质量、器官指数等增加直至恢复正常;补充BCS及BCS+FOS后,小鼠的生长也有所恢复。环磷酰胺对机体组织有一定的损伤,而经过补充BCS、BCS+FOS后,这种损伤有所恢复,可在一定程度上恢复血常规指标,提高蛋白质合成率及葡萄糖利用率,清除小鼠机体内多余的胆固醇,维持胆固醇的相对稳定,维护机体的健康,促进生长,提高免疫功能。
