OSTN-AS1/miR-330调控前列腺癌细胞增殖、迁移和侵袭的分子机制
2021-12-13莉胡月明崔海军赵济华
田 莉胡月明崔海军赵济华
(1.河北省唐山中心医院病理科,河北 唐山 063000;2.河北省唐山市工人医院泌尿外科,河北 唐山 063000;3.华北理工大学临床医学院,河北 唐山 063210)
1 材料和方法
1.1 实验材料
1.1.1 实验动物
36只清洁级BALB/c-nu/nu无胸腺雄性裸鼠,3周龄,体重(18.5±2.4)g,购于北京维通利华实验动物技术有限公司[SCXK(京)2019-0009],饲养在华北理工大学实验动物中心[SYXK(冀)2020-012]。饲养条件:白昼、黑夜交替,各12 h,温度23℃~27℃,自由进食和喝水。本实验严格按照3R原则进行,并通过了唐山中心医院伦理会批准(20200034)。
1.1.2 细胞
前列腺癌细胞系PC-3M来自中国科学院上海细胞库。
1.1.3 临床资料
选取25例于2017年5月至2018年12月在本院行手术治疗的前列腺癌患者为研究对象,前列腺癌的诊断符合原发性前列腺癌的诊断标准,且经HE染色病理确诊(图1A)。患者年龄46~78岁,平均年龄(65.24±5.87)岁。临床分期Ⅰ期、Ⅱ期和Ⅲ期患者分别为3、8和14例;淋巴结转移、未转移患者分别为18、7例。排除标准:(1)同时患有其他恶性肿瘤的患者;(2)重要脏器如心脏、肾、肝等脏器功能障碍者;(3)合并自身免疫系统疾病、心血管疾病等患者。所有患者术前未接受任何治疗。本研究符合《赫尔辛基宣言》原则。采用实时荧光定量聚合酶链式反应(Real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)法检测前列腺癌组织及癌旁组织中OSTN-AS1和miR-330表达水平。
事实上,在中国白酒国际化的进程中,茅台、五粮液等名优酒企从未停止过开拓海外市场的步伐,也为此付出了巨大的努力。但从整体来看,白酒不管从销量、宣传、认识度上都只占海外酒业市场上极其微小的一部分,以至于在海外酒业市场调查数据中有关中国白酒的数据和资料少之又少。这是因为即使有大企业去进军海外市场的行为,但由于海外市场推广的花费巨大,这些大企业充其量只是在海外宣传了自身的品牌,让海外酒业市场上多了自家产品的销售,但并没有真正将“中国白酒”这一品牌概念刻入海外消费者心中,没能实质性地提高白酒的竞争力。综上所述,大酒企并不能承担起“大猪”这一角色。
1.2 主要试剂与仪器
胎牛血清购自美国Hycolne公司;RPMI 1640培养基、细胞周期检测试剂盒和双荧光素酶活性检测试剂盒购自北京索莱宝科技有限公司;TRIzol试剂和LipofectamineTM2000试剂盒购自美国Invitrogen公司;OSTN-AS1小干扰RNA(si-OSTN-AS1)、乱序无意义阴性序列(si-NC)、miR-330抑制剂(anti-miR-330)和模拟物(mimcs)、抑制剂阴性序列(anti-miR-NC)、模拟对照序列(miR-NC)、引物序列、荧光素酶报告载体购自上海吉玛制药技术有限公司;逆转录试剂盒和PCR试剂盒购自日本TaKaRa公司;QP-50 CO2培养箱,山东济南鑫贝西生物技术有限公司;GeneAmp970型PCR仪,美国Applied Biosystems公司;FACSCalibur型流式细胞仪,美国BD公司;CKX41型倒置显微镜,日本Olympus公司。
1.3 实验方法
1.3.1 细胞培养和转染
用含10%胎牛血清的RPMI 1640培养基(完全培养基)培养PC-3M细胞。于6孔板中培养PC-3M细胞(2.5×104个/孔),培养24 h后,弃培养基。将LipofectamineTM2000试剂分别与si-OSTN-AS1(si-OSTN-AS1组)、si-NC(si-NC组)、anti-miR-330(antimiR-330组)、anti-miR-NC(anti-miR-NC组)、si-OSTN-AS1和anti-miR-330(si-OSTN-AS1+anti-miR-330组)、si-OSTN-AS1和anti-miR-NC(si-OSTN-AS1+anti-miR-NC组)混合均匀,加入6孔板中,孵育细胞6 h。然后更换培养基,再培养24 h,RT-qPCR法检测OSTN-AS1或miR-330表达验证转染效果。
1.3.2 RT-qPCR法检测OSTN-AS1、miR-330和基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)mRNA表达
TRIzol试剂提取组织或细胞中总RNA,然后将其逆转录为cDNA后,行PCR扩增。引物序列:OSTN-AS1上 游5’-AGCTGAGAGTCTGTCAAGGG-3’,下游5’-CTTCACAAGGCAGCAGGAAG-3’;miR-330上游5’-GTGCTGCGATGTTGCGAAACCCG-3’,下游5’-CGCGGCCTAGATTCGATCGTAG-3’;MMP-2上游5’-CCACAAGCCACGAGTTTTCa-3’,下游5’-TTGGGCTTTAGAGGGGATGG-3’;GAPDH上游5’-TGTTCGTCATGGGTGTGAAC-3’,下 游5’-ATGGC ATGGACTGTGGTCAT-3’;U6上 游5’-GCTTCGGC AGCACATATACTAAAAT-3’,下 游5’-CGCTTCAC GAATTTGCGTGTCAT-3’。2-△△Ct法计算OSTN-AS1和MMP-2 mRNA相对GAPDH、miR-330相对U6的表达量。
1.3.3 流式细胞仪检测细胞周期
于24孔板中培养各组细胞(2.5×104个/孔),每组设3个复孔。培养24 h后,收集细胞。加70%冰乙醇固定,4℃过夜。4℃、800 r/min离心,弃上清。加入PBS清洗细胞2次。加入400 μL结合缓冲液,重悬细胞。加入50 μL RNA酶,37℃孵育30 min。在避光环境下加入50 μL碘化丙啶,并孵育30 min,最后用流式细胞仪检测细胞周期。
1.3.4 克隆形成实验
于24孔板中培养各组细胞(2.5×104个/孔),每组设3个复孔。培养14 d,弃培养基。将细胞放置在多聚甲醛进行固定,时间30 min。然后再置于结晶紫染色液中进行染色,时间20 min。用PBS清洗细胞后,显微镜观察,记数。
1.3.5 Transwell检测细胞迁移和侵袭
迁移实验:于Transwell小室上室加100 μL各组细胞悬液(每mL 5×104个),下室加500 μL完全培养基。培养24 h后,弃培养基。将细胞放置在多聚甲醛溶液中进行固定,时间30 min。然后再置于结晶紫染色液中进行染色,时间20 min。用PBS清洗细胞后,显微镜观察,计数。侵袭实验:预先于Transwell小室上室铺Matrigel基质胶铺,自然晾干后,再加100 μL细胞悬液,剩余操作同迁移实验。
1.3.6 双荧光素酶报告基因实验验证OSTN-AS1与miR-330及miR-330与MMP-2靶向关系
OSTN-AS1、MMP-2的野生型(WT)和突变型(MUT)由上海吉玛制药技术公司设计并制备,并克隆到pMIR-Report质粒中,分别命名为WT-OSTNAS1、MUT-OSTN-AS1、WT-MMP-2、MUT-MMP-2。将PC-3M细胞接种于24孔板中(2.5×104个/孔),培养24 h后,弃培养基。将LipofectamineTM2000试剂分别与WT-OSTN-AS1(或MUT-OSTN-AS1)和miR-330 mimics(或miR-NC)、WT-MMP-2(或MUT-MMP-2)和miR-330 mimics(或miR-NC)混合均匀,加入6孔板中,孵育细胞6 h。更换培养基,再培养24 h,弃培养基,将细胞进行裂解处理。用离心机(半径10 cm)将细胞裂解液离心(3500 r/min,10 min)后,20 μL取上清液,分别加100 μL 1×萤火虫或海肾荧光素酶反应工作液,振荡混匀,用GENios Pro多功能酶标仪检测萤火虫或海肾的荧光强度。细胞荧光素酶活性以萤火虫荧光强度与海肾荧光强度的比值表示。
1.3.7 裸鼠移植瘤实验
将si-NC组、si-OSTN-AS1组、anti-miR-NC组、anti-miR-330组、si-OSTN-AS1+anti-miR-NC组、si-OSTN-AS1+anti-miR-330组PC-3M细胞密度调整为每mL 2.0×107个,均以0.1 mL接种至裸鼠皮下,每组6只。自观察到肉眼可见的肿瘤时,常规饲养4周。处死裸鼠后剥离肿瘤,称重。
1.4 统计学分析
SPSS 22.0软件分析实验数据。计量资料以平均数±标准差(±s)表示。前列腺癌组织和癌旁组织中OSTN-AS1与miR-330表达的比较及细胞荧光素活性的比较均采用独立样本t检验;si-NC组、si-OSTN-AS1组、anti-miR-NC组、anti-miR-330组、si-OSTN-AS1+anti-miR-NC组和si-OSTN-AS1+antimiR-33组各检测指标均首先采用单因素方差分析,进一步组间两两比较用SNK-q检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 OSTN-AS1和miR-330在前列腺癌组织中的表达
HE染色显示前列腺癌旁组织由导管和腺泡组成,其上皮排列有两层细胞,内层为表面的分泌细胞,外层为位于基底膜和内层上皮之间的底层细胞;各分区的导管、腺泡的结构和上皮形状差别不大。前列腺癌组织分泌细胞具有明显异型性,且形态多样;基底部基底细胞局限性缺失,腺体局部细胞向间质浸润(图1A);RT-qPCR法检测前列腺癌组织及癌旁组织中OSTN-AS1和miR-330表达,结果显示,前列腺癌组织中OSTN-AS1表达高于癌房组织(P<0.05),而miR-330表达低于癌房组织(P<0.05)。结果说明,OSTN-AS1在前列腺癌组织中呈高表达,而miR-330呈低表达(图1B、1C)。

图1 癌旁组织和癌组织的HE染色结果及OSTN-AS1和miR-330在前列腺癌组织中的表达(±s,n=25)Note.A,Localized loss of basal cells at the base of prostate cancer tissue,and local cells infiltrating into the interstitium of the glands.B,Expression of OSTN-AS1 in prostate cancer tissue increased.C,Expression of miR-330 in prostate cancer tissue decreased.Compared with the adjacent tissues,*P<0.05.Figure 1 Results of HE staining of adjacent tissues and cancerous tissuesand the expression of OSTN-AS1 and miR-330 in prostate cancer tissue
2.2 PCR检测PC-3M细胞中OSTN-AS1、miR-330和MMP-2 mRNA的表达水平
RT-qPCR法检测si-OSTN-AS1或anti-miR-330转染效率,结果显示,si-OSTN-AS1组PC-3M细胞中OSTN-AS1表达明显低于si-NC组(P<0.05),antimiR-330组PC-3M细胞中miR-330表达明显低于anti-miR-NC组(P<0.05),说明下调OSTN-AS1或下调miR-330表达的PC-3M细胞构建成功。RTqPCR法检测下调OSTN-AS1、下调miR-330或同时下调OSTN-AS1与miR-330后PC-3M细胞中miR-330或MMP-2 mRNA表达,结果显示,下调OSTNAS1的PC-3M细胞中miR-330表达升高,而MMP-2 mRNA表达降低,说明下调OSTN-AS1可促进PC-3M细胞中miR-330表达,而抑制MMP-2 mRNA表达;而下调miR-330的PC-3M细胞中MMP-2 mRNA表达升高,说明下调miR-330可促进PC-3M细胞中MMP-2 mRNA表达;同时下调OSTN-AS1和miR-330的PC-3M细胞中MMP-2 mRNA表达与仅下调OSTN-AS1的细胞比较升高(P<0.05),说明下调miR-330逆转下调OSTN-AS1对PC-3M细胞中MMP-2 mRNA表达的抑制作用(图2)。
2.3 克隆形成实验检测PC-3M细胞克隆形成数和流式细胞仪检测PC-3M细胞周期
流式细胞仪、克隆形成实验分别检测下调OSTNAS1、下调miR-330或同时下调OSTN-AS1与miR-330对PC-3M细胞的细胞周期及克隆形成的影响,结果显示,下调OSTN-AS1后,PC-3M细胞的细胞周期阻滞,克隆形成数降低,说明下调OSTN-AS1可阻碍PC-3M细胞的细胞周期进程,抑制细胞增殖;下调miR-330后,PC-3M细胞的细胞周期进程加快,克隆形成数升高,说明下调miR-330促进PC-3M细胞的细胞周期进程,并促进细胞增殖。与仅下调OSTN-AS1的PC-3M细胞比较,同时下调OSTN-AS1与miR-330的PC-3M细胞的细胞周期进程加快,克隆形成数升高,说明下调miR-330逆转下调OSTN-AS1对PC-3M细胞周期及克隆形成的影响(图3、表1)。
表1 各组PC-3M细胞的细胞周期及克隆形成数(±s,n=3)Table 1 Cell cycle changes and clone formation number of PC-3M cells in each group
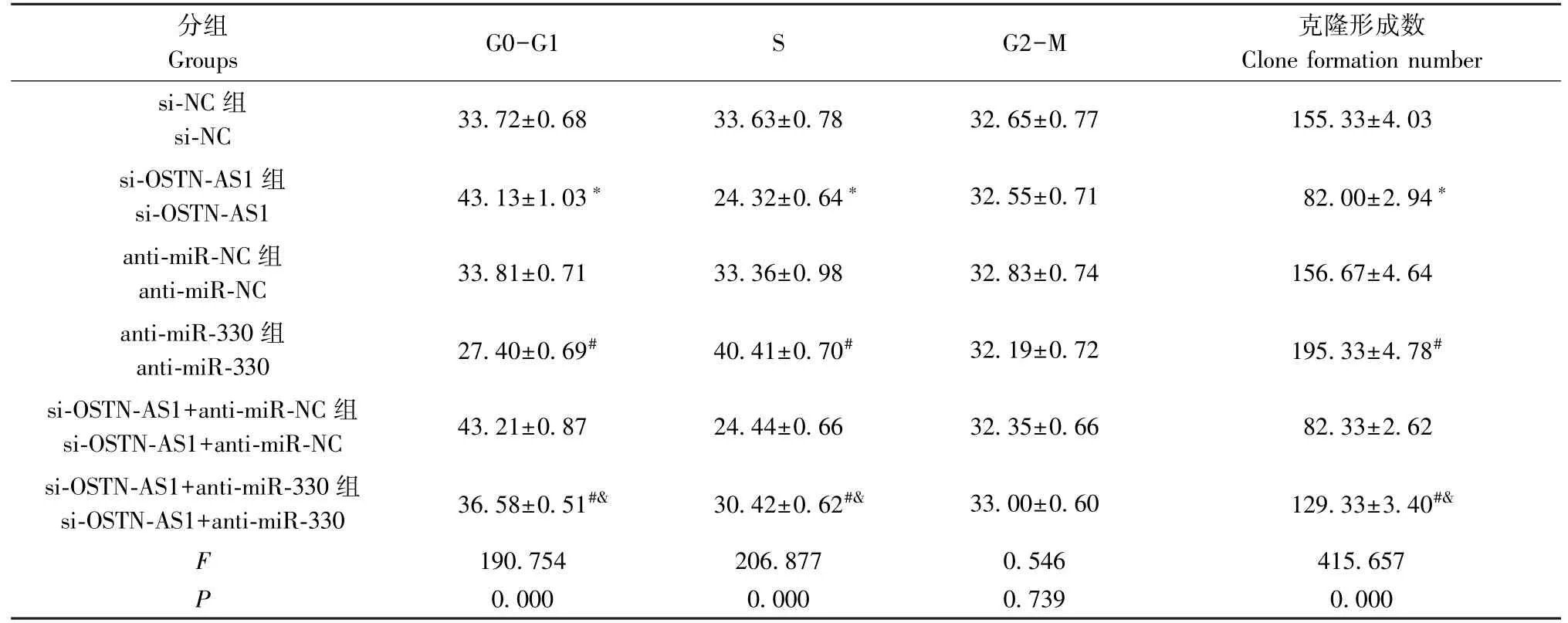
表1 各组PC-3M细胞的细胞周期及克隆形成数(±s,n=3)Table 1 Cell cycle changes and clone formation number of PC-3M cells in each group
注:与si-NC组相比,*P<0.05;与anti-miR-NC组相比,#P<0.05;与si-OSTN-AS1+anti-miR-NC组相比,&P<0.05。Note.Compared with the si-NC group,*P<0.05.Compared with the anti-miR-NC group,#P<0.05.Compared with the si-OSTN-AS1+anti-miR-NC group,&P<0.05.
?
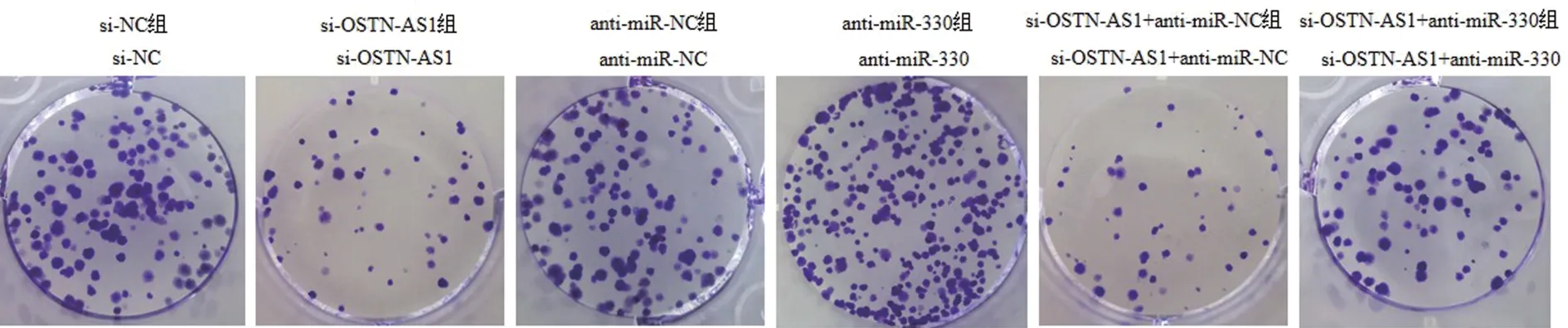
图3 各组PC-3M细胞克隆形成数Figure 3 Colony formation number of PC-3M cells in each group
2.4 Transwell实验检测PC-3M细胞迁移和侵袭
Transwell分别检测下调OSTN-AS1、下调miR-330或同时下调OSTN-AS1与miR-330对PC-3M细胞迁移和侵袭的影响,结果显示,下调OSTN-AS1后,PC-3M细胞的迁移和侵袭数均降低,说明下调OSTN-AS1可抑制PC-3M细胞迁移和侵袭;下调miR-330后,PC-3M细胞的迁移和侵袭数均升高,说明下调miR-330促进PC-3M细胞迁移和侵袭。与仅下调OSTN-AS1的PC-3M细胞比较,同时下调OSTN-AS1与miR-330的PC-3M细胞迁移和侵袭数升高,说明下调miR-330逆转下调OSTN-AS1对PC-3M细胞迁移和侵袭的抑制作用(图4、表2)。
表2 各组PC-3M细胞迁移和侵袭数比较(±s,n=3)Table 2 Comparison of migration and invasion numbers of PC-3M cells in each group
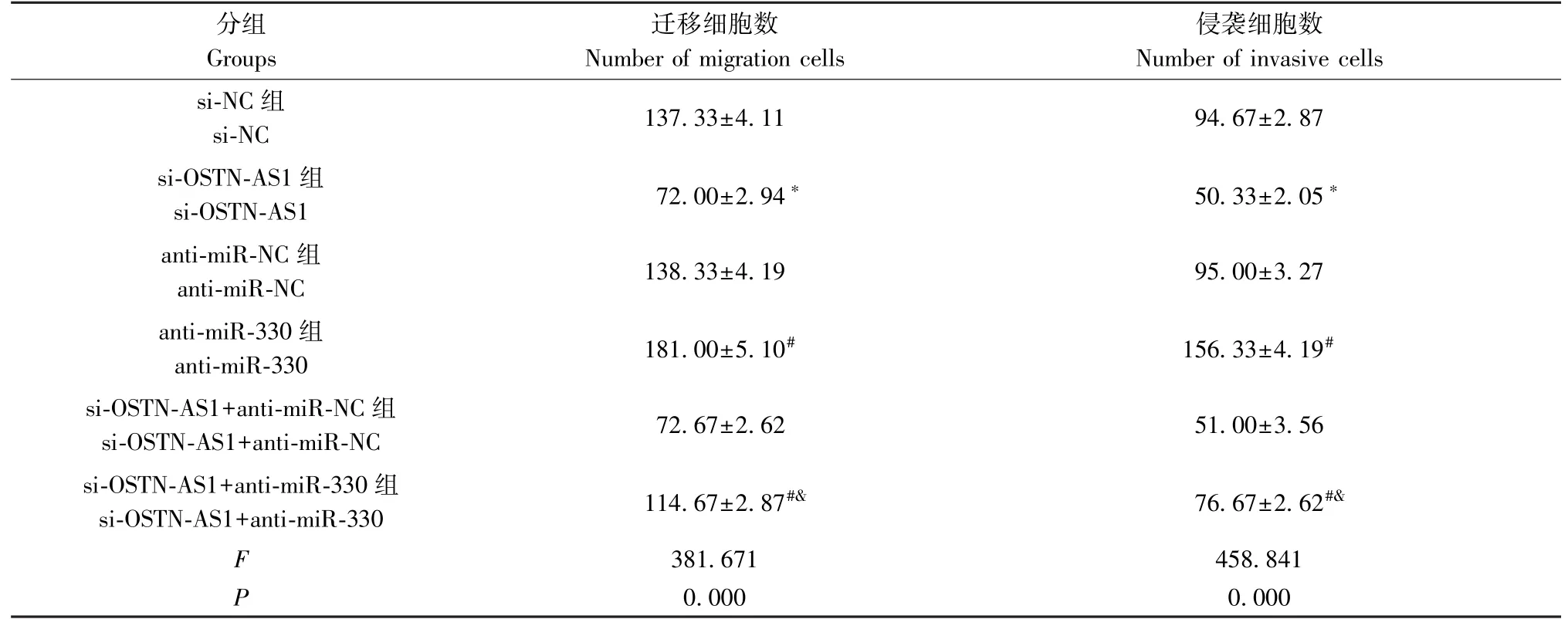
表2 各组PC-3M细胞迁移和侵袭数比较(±s,n=3)Table 2 Comparison of migration and invasion numbers of PC-3M cells in each group
注:与si-NC组相比,*P<0.05;与anti-miR-NC组相比,#P<0.05;与si-OSTN-AS1+anti-miR-NC组相比,&P<0.05。Note.Compared with the si-NC group,*P<0.05.Compared with the anti-miR-NC group,#P<0.05.Compared with the si-OSTN-AS1+anti-miR-NC group,&P<0.05.
?
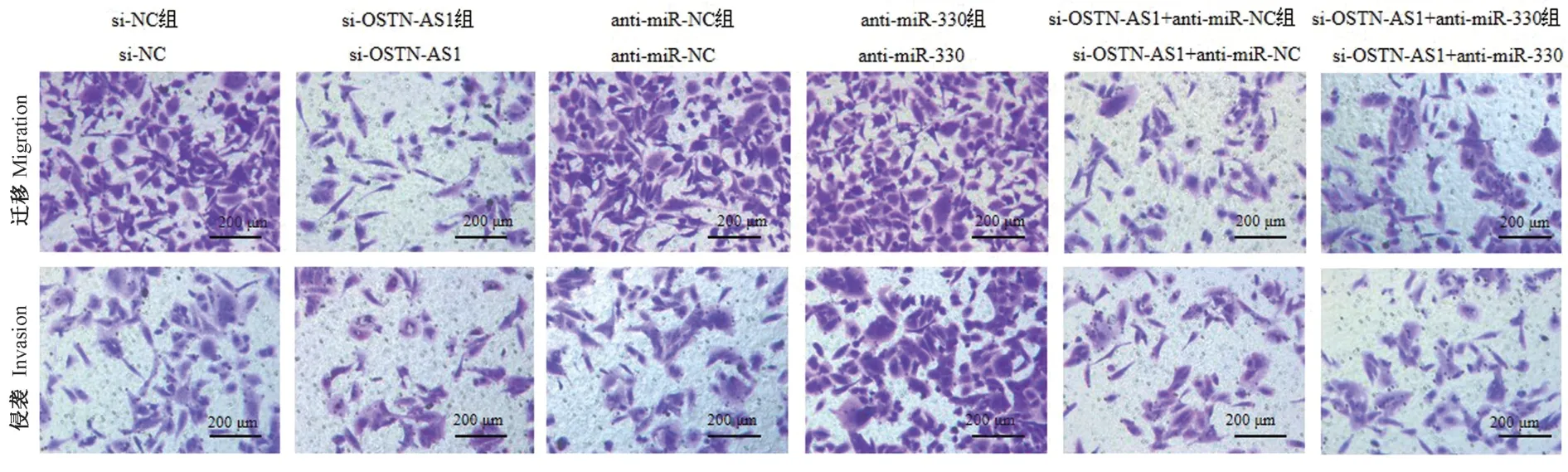
图4 Transwell检测各组PC-3M细胞迁移和侵袭(结晶紫染色)Figure 4 Transwell detects the migration and invasion of PC-3M cells in each group(crystal violet staining)
2.5 双荧光素酶报告实验验证OSTN-AS1、miR-330、MMP-2的靶向关系
生物信息学软件预测显示,OSTN-AS1与miR-330、MMP-2 3’UTR与miR-330的核苷酸序列具有连续结合位点(图5)。双荧光素酶报告基因实验检测OSTN-AS1与miR-330及miR-330与MMP-2的靶向关系,结果显示,共转染miR-330 mimics与WTOSTN-AS1或WT-MMP-2的PC-3M细胞荧光素酶活性明显降低(P<0.05),而共转染miR-330 mimics与MUT-OSTN-AS1或MUT-MMP-2的PC-3M细胞荧光素酶活性无显著变化(P>0.05),说明OSTNAS1可靶向结合miR-330,MMP-2是miR-330的靶基因(表3)。
表3 荧光素酶活性检测结果(±s,n=3)Table 3 Test results of luciferase activity
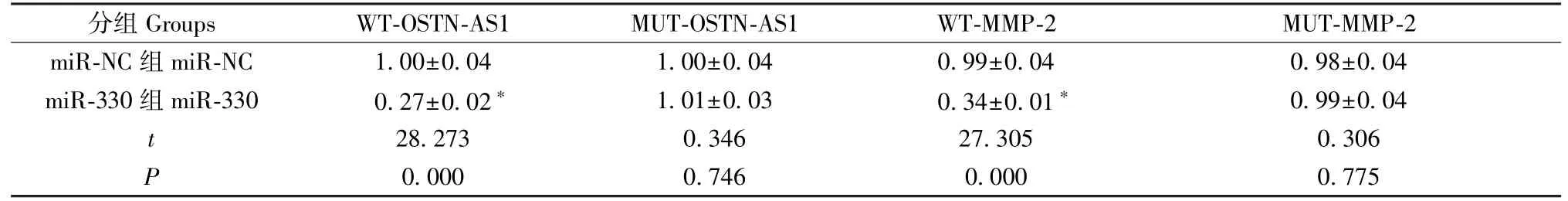
表3 荧光素酶活性检测结果(±s,n=3)Table 3 Test results of luciferase activity
注:与miR-NC组相比,*P<0.05。Note.Compared with the miR-NC group,*P<0.05.
?

图5 OSTN-AS1与miR-330及miR-330与MMP-2的互补序列Note.A,Complementary sequence of OSTN-AS1 and miR-330.B,Complementary sequence of miR-330 and MMP-2.Figure 5 Complementary sequence of OSTN-AS1 and miR-330 or miR-330 and MMP-2
2.6 裸鼠移植瘤实验检测不同处理对裸鼠成瘤的影响
各组裸鼠饲养21 d后,剥离肿瘤,并对其称重。结果显示,下调OSTN-AS1后,裸鼠肿瘤重量降低,说明下调OSTN-AS1可抑制体内肿瘤生长;下调miR-330后,裸鼠肿瘤重量增加,说明下调miR-330促进体内肿瘤生长;而同时下调OSTN-AS1与miR-330后,裸鼠肿瘤重量增加,说明下调miR-330逆转下调OSTN-AS1对裸鼠肿瘤生长的抑制作用(图6、表4)。
表4 各个处理组小鼠中瘤重的检测(±s,n=6)Table 4 Detection of tumor weight in each treatment group
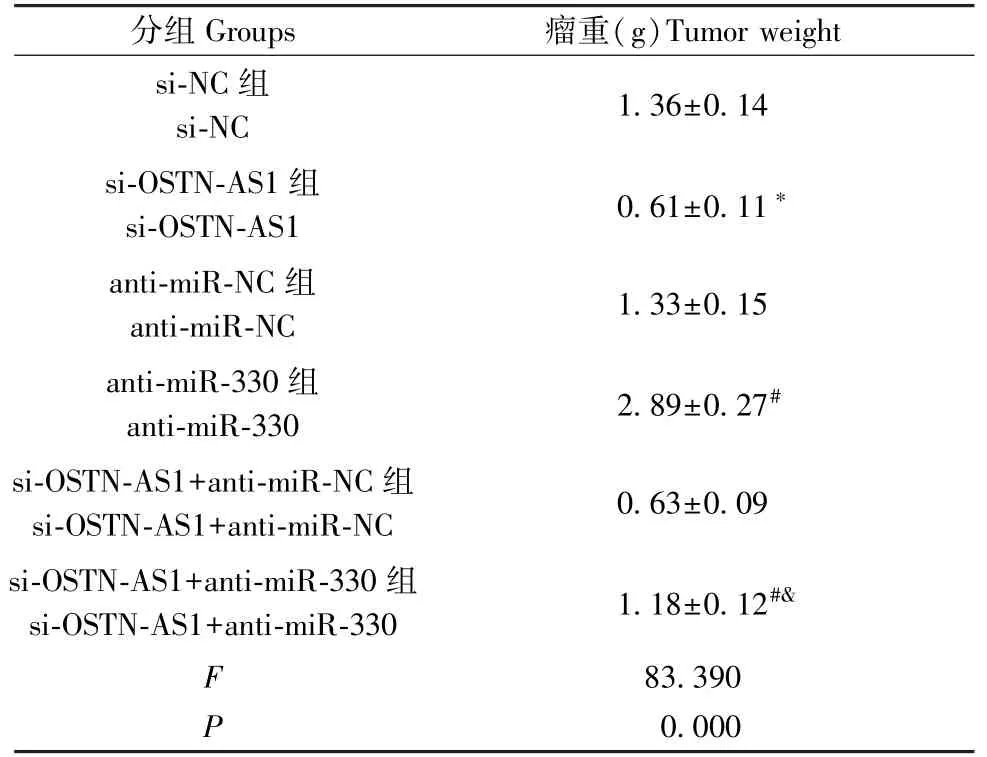
表4 各个处理组小鼠中瘤重的检测(±s,n=6)Table 4 Detection of tumor weight in each treatment group
注:与si-NC组相比,*P<0.05;与anti-miR-NC组相比,#P<0.05;与si-OSTN-AS1+anti-miR-NC组相比,&P<0.05。Note.Compared with the si-NC group,*P<0.05.Compared with the antimiR-NC group,#P<0.05.Compared with the si-OSTN-AS1+anti-miR-NC group,&P<0.05.
?
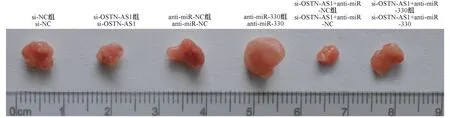
图6 各个处理组瘤重Figure 6 Tumor weight of each treatment group
3 讨论
lncRNA是一类长度超过200 bp的小分子非编码RNA,其竞争性吸附miRNA,调控miRNA靶基因的表达,进而发挥生物学作用。研究已表明,多种lncRNA参与调控前列腺癌细胞的恶性表型,与该肿瘤的发生发展密切相关。lncRNA PROX1-AS1[3]、lncRNA HCP5[4]等lncRNA在前列腺癌中表达升高,可分别通过竞争性吸附miR-647、miR-4656促进前列腺癌的发展进程。此外,lncRNA Erbb4-IR[5]、lncRNA MIR22HG等[6]lncRNA在前列腺癌中表达下调,对前列腺癌的发展起抑制作用。OSTN-AS1是近年来新发现的一种lncRNA,目前对其在肿瘤中的研究较为少见。
Jiang等[1]报道称,OSTN-AS1在前列腺癌组织中呈高表达,这与本研究结果一致,但Jiang并未探究OSTN-AS1对前列腺癌细胞恶性表型的影响。本研究通过转染OSTN-AS1小干扰RNA下调前列腺癌细胞中表达,首次探究了OSTN-AS1对前列腺癌细胞恶性表型的影响,结果显示,下调OSTN-AS1可明显削弱体外前列腺癌细胞的克隆形成、迁移和侵袭能力,并使细胞周期阻滞,且下调OSTN-AS1抑制了裸鼠体内肿瘤生长,这提示下调OSTN-AS1可抑制前列腺癌的发展进程,OSTN-AS1有可能是前列腺癌治疗的分子靶点。
此外,本研究证实了OSTN-AS1可竞争性吸附并负调控miR-330表达,这在其他文献中也尚未见报道。研究显示,结直肠癌[7]、黑色素瘤[8]、非小细胞肺癌[9]等肿瘤中miR-330的表达降低,上调miR-330对这些肿瘤细胞的增殖、迁移和侵袭具有明显抑制作用,miR-330作为抑癌基因参与这些肿瘤的发展进程。然而,Zhang等[10]研究显示,miR-330在乳腺癌患者癌组织和血清中表达升高,可促进腋窝淋巴结转移,是影响乳腺癌患者预后的重要因素,其在乳腺癌中发挥促癌基因作用。这说明miR-330可能在不同的肿瘤中发挥的作用不同。本研究结果显示,下调miR-330促进体外前列腺癌细胞增殖、迁移和侵袭,与相关报道结果一致[11],且下调miR-330促进体内肿瘤生长,说明miR-330作为抑癌基因参与前列腺癌的发展进程。本研究结果还显示,下调miR-330逆转了下调OSTN-AS1对体外PC-3M细胞增殖、迁移和侵袭的抑制作用及体内肿瘤生长的抑制作用,提示OSTN-AS1可能通过负调控miR-330来促进前列腺癌的发展进程。
MMP-2是一种基质金属蛋白酶,可降解细胞外基质,促进细胞迁移和侵袭[12]。Yang等[13]研究显示,miR-200a在人乳腺癌组织中明显过表达,miR-200a的过表达通过促进MMP-2的转录促进了乳腺癌细胞侵袭。邱承俊等[14]研究显示,MMP-2在前列腺癌PC3细胞表达升高,下调其表达可能通过下调血管内皮生长因子和上调活化的半胱天冬酶-8的蛋白表达降低了PC3细胞的增殖、侵袭和迁移。本研究首先利用双荧光素酶报告基因实验证实了MMP-2是miR-330的靶基因,且下调OSTN-AS1抑制前列腺癌细胞中MMP-2的表达,且下调miR-330降低可下调OSTN-AS1对前列腺癌细胞中MMP-2表达的抑制作用,进一步提示提示OSTN-AS1通过调控miR-330/MMP-2轴来抑制PC-3M细胞增殖、迁移和侵袭。
综上所述,前列腺癌组织中OSTN-AS1呈高表达,而miR-330呈低表达;下调OSTN-AS1显著降低体外前列腺癌PC-3M细胞的增殖、迁移和侵袭性及体内肿瘤生长,其作用机制可能与调控miR-330/MMP-2轴有关,有可能成为前列腺癌治疗的分子靶点。
