miR-214调控FGF9的表达参与结核分枝杆菌感染肺泡Ⅱ型细胞中PI3K/AKT信号通路的免疫调控作用研究
2021-12-13苏维娜李晓晶张丽丽包志伟
苏维娜李晓晶张丽丽包志伟
(1.山东师范大学校医院检验科,济南 250014;2.山东中医药研究院,济南 250014;3.山东省临沂市沂水人民医院检验科,山东 临沂 276400;4.江汉大学医院内科,武汉 430056)
结核分枝杆菌感染是肺结核发病的主要原因。结核分枝杆菌感染每年夺去近150万人的生命,是目前全球死亡人数最高的病原体感染疾病之一[1-2]。由于老年人免疫功能紊乱,从而导致结核病发病率远高于成年人[3]。
肺泡上皮细胞包括I型肺泡上皮细胞和II型肺泡上皮细胞[4]。其中Ⅱ型肺泡上皮细胞数量多,具有增殖功能,可通过增殖,并分化形成I型肺泡上皮细胞,修复肺部损伤[5-6]。另有研究表明II型肺泡上皮细胞具有重要的免疫调控作用,可对抗结核分枝杆菌感染[7]。
MicroRNA(miRNA)可影响结核病患者免疫功能[8]。miRNA是一类内源性,可调控多项生命活动的非编码RNA[9]。miRNA的异常表达与结核病的发生和发展存在密切的关联,在宿主抵抗结核分枝杆菌的过程中具有重要的调控作用[10-11]。根据以往的研究发现,miR-214在发生肺损伤后的Ⅱ型肺泡上皮细胞中异常表达[12],因此推测miR-214会影响免疫功能,但目前尚无研究报道miR-214对结核分枝杆菌感染的Ⅱ型肺泡上皮细胞的调控作用。miRNA可以调节基因和蛋白质的表达。且miRNA可通过影响下游靶基因的表达,进而调控机体生命活动[13-14]。在胃癌中,miR-214可通过靶向抑制FGF9,调控胃癌细胞迁移和侵袭[15]。网站(http://www.targetscan.org/vert_71/)显示miR-214和FGF9之间存在结合位点。在炎症环境下,FGF9对组织具有保护作用[16],在结核分枝杆菌感染的Ⅱ型肺泡上皮细胞中,FGF9是否具有保护作用尚未可知。
在本研究中,通过使用结核分枝杆菌标准株H37Rv感染Ⅱ型肺泡上皮细胞A549,并分别转染miR-214和FGF9等载体,旨在探究miR-214和FGF9对结核分枝杆菌感染的Ⅱ型肺泡上皮细胞的免疫调控作用。
1 材料和方法
1.1 细胞
II型肺泡上皮细胞系A549,购自ATCC库。
1.2 主要试剂与仪器
转染所用载体均购自武汉伯远生物科技有限公司;Lipofectamine 2000转染试剂货号为11668019,购自ThermoFisher公司;RIPA裂解液货号为SJH0994,购自上海如吉生物科技发展有限公司;反转录试剂盒购自上海碧云天生物技术有限公司,货号D7168 S;Premix购自TaKaRa(中国大连分公司);鼠一抗信息如下:FGF9(ab215908,abcam,USA)、PI3K(ab140307,abcam,USA)、AKT(4691,CST Signaling,USA)、p-AKT(9614,CST Signaling,USA)、GAPDH(CW0100 M,康为世纪,康为世纪生物科技有限公司,中国);二抗IgG(ab6789,Abcam,USA);Rellina质粒购自上海吉满生物科技有限公司;双荧光素酶报告试剂盒购自Promega;SP-A、SPD含量的ELISA试剂盒购自睿信生物科技有限公司;测定TLR2、TLR4含量所用的试剂盒购自Merck公司;IL-10、TNF-α、IL-1β、IL-8试剂盒购自abcam公司。
bio-Rad凝胶成像系统显影(MG8600,北京托摩根生物科技有限公司,北京,中国);分光光度计(Thermo Fisher Scientific,Waltham,MA,USA);IPP7.0软件(Media Cybernetics,Singapore)。
1.3 实验方法
1.3.1 细胞培养
II型肺泡上皮细胞系A549保存在EMEM培养基中,并加入2 mL谷氨酰胺和5%(v/v)FBS。细胞在37℃下在含有50 ng/mL PMA的RPMI 1640培养基中培养6 h,然后进行后续处理。
1.3.2 结核分枝杆菌感染A549细胞
BCG和H37Rv培养:结核分枝杆菌BCG和H37Rv在添加0.5%(v/v)甘油、0.05%(v/v)Tween 80、0.5%(w/v)牛血清白蛋白和0.085%(w/v)NaCl的Middlebrook 7H9液体培养基中培养。并加入50 mg/mL卡那霉素维持菌株的生长。
将BCG和H37Rv置于7H9液体培养基中培养,待细菌生长至OD600为1.0,在5000 r/min下离心5 min,去除7H9液体培养基。在RPMI 1640培养基中再悬浮菌株。分散A549细胞并计数。将细胞置于37℃、5% CO2恒温培养箱中培养。待细胞生长融合至50%,更换新RPMI 1640培养基,并将重悬的菌株加入培养基中。
1.3.3 细胞分组
对A549细胞进行分组,并进行H37Rv感染:NC mimic+oe-NC(阴性对照)、miR-214 mimic+oe-NC(miR-214过表达)、NC mimic+oe-FGF9(FGF9过表达)、miR-214 mimic+oe-FGF9(miR-214和FGF9同时过表达)。将A549细胞分别以1×106细胞/孔接种于6孔板中过夜,使用Lipofectamine 2000转染试剂,按照试剂盒说明书进行转染。转染24 h后,进行H37Rv感染。
1.3.4 qRT-PCR
采用qRT-PCR检测miR-214和FGF9的表达情况。取感染后48 h细胞,弃培养基,使用冷PBS清晰2次。TRIzol法提取细胞RNA。取5 μL RNA样品,用无RNA酶超纯水稀释20倍,读取其在紫外分光光度计260 nm和280 nm处的吸收值,测定RNA的浓度和纯度,OD260/OD280比值检测纯度。按照反转录试剂盒说明书在PCR扩增仪进行逆转录,反应合成cDNA模版,由上海生工生物工程股份有限公司合成所需qPCR引物,引物信息见表1。qPCR反应总体系为10 μL,反应成分包括:5 μL 2×SYBR Premix,cDNA模板1 μL,上下游引物各0.5 μL,ddH2O 3 μL。qPCR程序为:95℃预变性30 s,95℃变性30 s,退火20 s,72℃延伸30 s,40个循环。FGF9以GAPDH为内参,miR-214以U6为内参。2-△△Ct表示实验组与对照组目的基因表达的倍比关系:△△CT=△Ct实验组-△Ct对照组。Ct为反应的实时荧光强度达到设定的阈值时所经过的扩增循环数,此时扩增是呈对数期增长。

表1 引物序列Table 1 Primer sequences
1.3.5 Western blot
收集各组细胞,加入含有10%蛋白酶抑制剂的RIPA裂解液,将细胞样品移至1.5 mL离心管中,5000 r/min离心10 min取上清,用BCA法测定蛋白质浓度后保存于-20℃备用。然后使用SDS-PAGE凝胶试剂盒配制12%分离胶和浓缩胶,在聚丙烯酰胺凝胶上电泳分离蛋白后采用湿转方法将蛋白转至NC膜上,5%脱脂牛奶室温下封闭1 h。滴加稀释的FGF9、PI3K、AKT、p-AKT、GAPDH一抗鼠抗。4℃过夜,次日用PBST洗膜3次,每次10 min,孵育鼠二抗IgG,室温置于摇床振荡2 h,再次用PBST洗膜3次,每次10 min。加入显影剂并通过bio-Rad凝胶成像系统显影,使用IPP 7.0软件进行定量分析。
1.3.6 双荧光素酶报告
使用生物学预测网站(http://www.targetscan.org/vert_71/)预测miR-214和FGF9的结合位点,通过双荧光素酶报告系统验证miR-214和FGF9的靶向关系。构建靶基因FGF9双荧光素酶报告基因载体与miR-214结合位点突变的突变体:FGF9 wt和FGF9 mut。将Rellina质粒和两种报告质粒分别与miR-214 mimic和NC mimic质粒共转染到HEK293 T(ATCC)细胞中。在细胞转染24 h后,进行双荧光素酶检测。首先将各组细胞裂解,裂解后以12000 r/min离心1 min,去沉淀,收集上清液。按照双荧光素酶报告试剂盒操作,测量荧光素酶活性。操作步骤如下:将裂解后的细胞样品吸入EP管中,每10 μL样品中萤火虫荧光素酶工作溶液100 μL,测得萤火虫荧光素酶之后加入海肾荧光素酶工作溶液100 μL,测得海肾荧光素酶结果。相对荧光素酶活性=萤火虫荧光素酶/海肾荧光素酶。
1.3.7 ELISA
收集各组细胞,检测细胞中免疫相关因子SPA、SP-D、TLR2、TLR4,炎症因子IL-10、TNF-α、IL-1β、IL-8含量。按照试剂盒操作检测各组细胞中SP-A、SP-D、TLR2、TLR4、IL-10、TNF-α、IL-1β、IL-8含量,根据操作说明书将样品进行处理后,通过分光光度计,检测各组样品在450 nm处OD值,得到各组样品中SP-A、SP-D、TLR2、TLR4、IL-10、TNF-α、IL-1β、IL-8含量。
1.4 统计学方法
所有统计分析均采用SPSS 21.0统计软件,两组数据之间的比较使用t检验比较,而多组之间的单因素比较采用one-way ANOVA分析,多因素采用two-way ANOVA分析,所有数据均表示为至少3个独立实验的平均数±标准差(±s)。对于偏态分布数据,采用非参数检验确定统计显著性。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-214在经结核分枝杆菌感染的肺泡Ⅱ型细胞表达上调,FGF9表达下调
培养结核分枝杆菌减毒株BCG和标准株H37Rv,并分别感染A549细胞。qRT-PCR检测感染后细胞中miR-214、FGF9的表达情况(图1A),Western blot检测FGF9蛋白的表达情况(图1B、1C)。结果显示和未经感染和BCG感染后相比,H37Rv感染后,A549细胞中miR-214表达显著升高,而FGF9 mRNA和蛋白表达则显著降低。
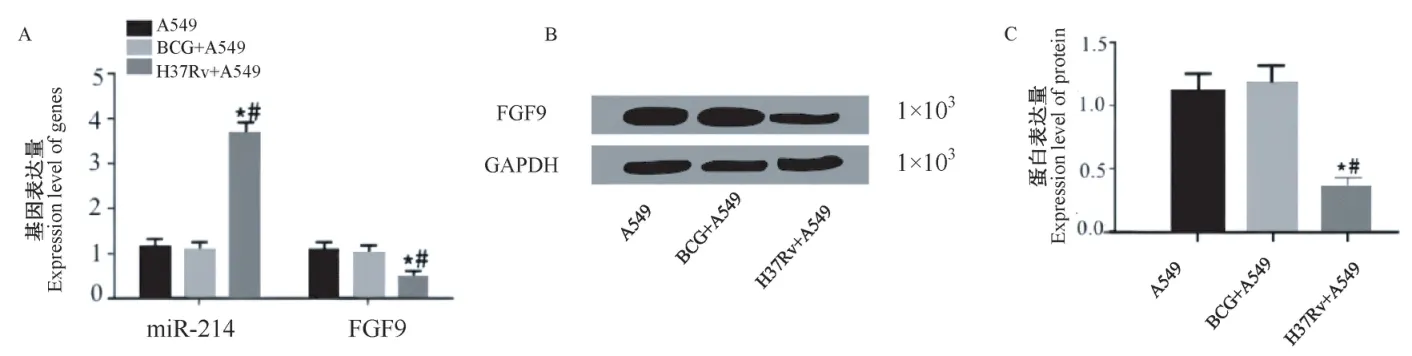
图1 miR-214、FGF9在经结核分枝杆菌感染的肺泡Ⅱ型细胞中的表达情况Note.A,qRT-PCR was used to detect the expression of miR-214 and FGF9.B,Protein banding.C,Expression of FGF9 was detected by Western blot.Compared with BCG group,*P<0.05.Figure 1 Expression of miR-214 and FGF9 in alveolar type II cells infected by Mycobacterium tuberculosis
2.2 miR-214靶向抑制FGF9的表达
生信网站分析(http://www.targetscan.org/vert_71/)查询到miR-214和FGF9存在结合位点(图2A)。根据结合位点信息,构建FGF9 wt和FGF9 mut报告载体,双荧光素酶报告验证miR-214和FGF9的靶向关系。结果显示,和FGF9 mut共转的两组细胞荧光素酶活性无显著差异。而NC mimic与FGF9 wt共转细胞相比,miR-214 mimic与FGF9 wt共转后,荧光素酶活性显著降低(图2B)。同时通过qRT-PCR检测感染后细胞中miR-214、FGF9的表达情况(图2C),Western blot检测FGF9蛋白的表达情况(图2D、2E)。结果显示和NC mimic+oe-NC组相比,miR-214 mimic+oe-NC组miR-214表达显著升高,FGF9 mRNA和蛋白表达均显著降低;NC mimic+oe-FGF9组中miR-214表达无显著变化,FGF9 mRNA和蛋白表达均显著升高。和miR-214 mimic+oe-NC组相比,miR-214 mimic+oe-FGF9组miR-214表达无显著变化,FGF9 mRNA和蛋白表达均显著升高。
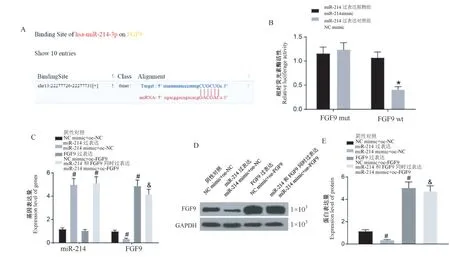
图2 miR-214靶向抑制FGF9的表达Note.A,Predicted binding sites between miR-214 and FGF9.B,Double luciferase assay was used to analyze the targeting relationship between miR-214 and FGF9.C,Expression of miR-214 and FGF9 was detected by qRT-PCR.D,Protein banding.E,Expression of FGF9 was detected by Western blot.Compared with NC mimic group,*P<0.05.Compared with NC mimic+oe-NC group,#P<0.05.Compared with miR-214 mimic+oe-NC group,&P<0.05.Figure 2 miR-214 inhibits the expression of FGF9
2.3 miR-214通过靶向FGF9参与结核分枝杆菌感染肺泡Ⅱ型细胞免疫反应
为探究miR-214靶向FGF9,对结核分枝杆菌感染后,肺泡Ⅱ型细胞免疫反应的影响,ELISA检测各组细胞中SP-A、SP-D、TLR2、TLR4的含量(图3)。结果显示和NC mimic+oe-NC组相比,miR-214 mimic+oe-NC组SP-A、SP-D含量显著降低,TLR2、TLR4含量显著升高;NC mimic+oe-FGF9组中SP-A、SP-D含量显著升高,TLR2、TLR4含量显著降低。和miR-214 mimic+oe-NC组相比,miR-214 mimic+oe-FGF9组SP-A、SP-D含量显著升高,TLR2、TLR4含量显著降低。
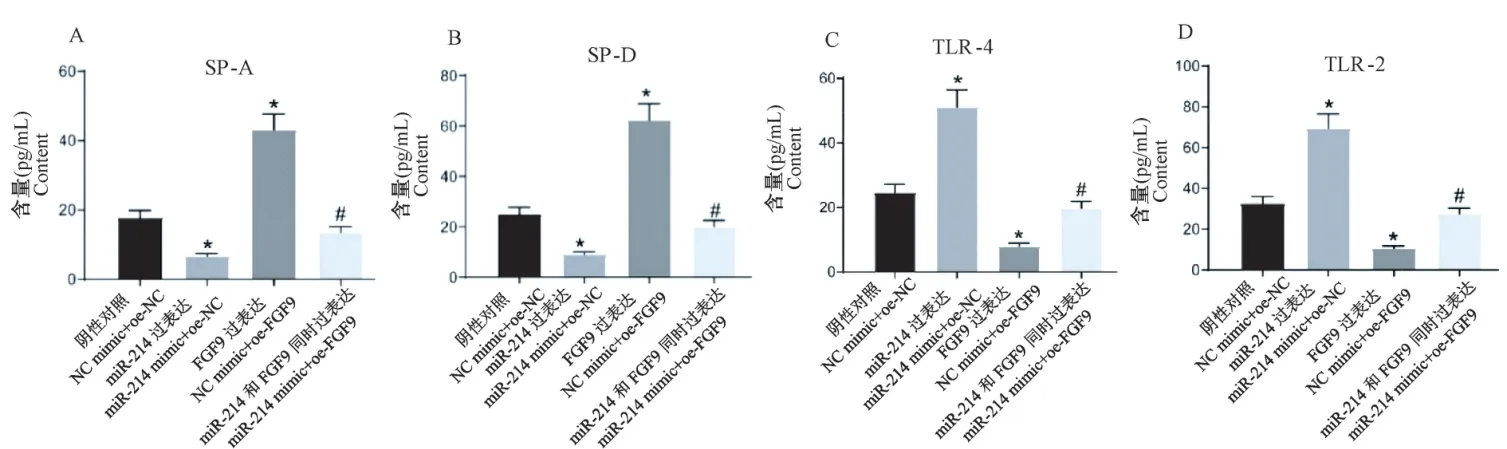
图3 miR-214通过靶向FGF9参与结核分枝杆菌感染肺泡Ⅱ型细胞免疫反应Note.A,SP-A content was detected by ELISA.B,Content of SP-D was detected by ELISA.C,TLR2 was detected by ELISA.D,TLR4 was detected by ELISA.Compared with NC mimic+oe-NC group,*P<0.05.Compared with miR-214 mimic+oe-NC group,#P<0.05.Figure 3 miR-214 participates in alveolar type II cellular immune response to Mycobacterium tuberculosis infection by targeting FGF9
2.4 miR-214通过靶向抑制FGF9,促进结核分枝杆菌感染肺泡Ⅱ型细胞的炎症反应
ELISA检测炎性因子IL-10、TNF-α、IL-1β、TNFγ的含量(图4)。结果显示,和NC mimic+oe-NC组相比,miR-214 mimic+oe-NC组IL-10含量显著降低,TNF-α、IL-1β、TNF-γ含量显著升高;NC mimic+oe-FGF9组中IL-10含量显著升高,TNF-α、IL-1β、TNF-γ含量显著降低。和miR-214 mimic+oe-NC组相比,miR-214 mimic+oe-FGF9组IL-10含量显著升高,TNF-α、IL-1β、TNF-γ含量显著降低。

图4 miR-214通过靶向FGF9参与结核分枝杆菌感染肺泡Ⅱ型细胞的炎症反应Note.A,Content of IL-10 was detected by ELISA.B,TNF-α was detected by ELISA.C,Content of IL-1β was detected by ELISA.D,Content of TNF-γ was detected by ELISA.Compared with NC mimic+oe-NC group,*P<0.05.Compared with miR-214 mimic+oe-NC group,#P<0.05.Figure 4 miR-214 participates in the Inflammation of type II alveolar cells infected by Mycobacterium tuberculosis by targeting FGF9
2.5 miR-214靶向FGF9,影响结核分枝杆菌感染肺泡Ⅱ型细胞中PI3K/AKT信号通路表达
Western blot检测各组细胞中PI3K/AKT信号通路成员PI3K、AKT、p-AKT的表达情况(图5)。结果显示,和NC mimic+oe-NC组相比,miR-214 mimic+oe-NC组PI3K、AKT/p-AKT表达水平显著降低;NC mimic+oe-FGF9组PI3K、AKT/p-AKT表达水平显著升高。和miR-214 mimic+oe-NC组相比,miR-214 mimic+oe-FGF9组PI3K、AKT/p-AKT表达水平显著升高。
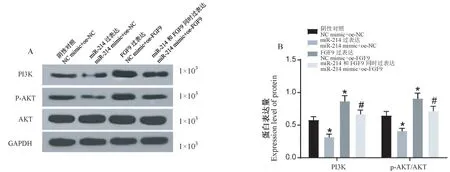
图5 miR-214靶向FGF9,影响结核分枝杆菌感染肺泡Ⅱ型细胞中PI3K/AKT信号通路表达Note.A,Protein band diagram.B,Expression of PI3K and p-AKT/AKT was statistically analyzed.Compared with NC mimic+oe-NC group,*P<0.05.Compared with miR-214 mimic+oe-NC group,#P<0.05.Figure 5 miR-214 targets FGF9 and affects the expression of PI3K/Akt signaling pathway in alveolar type II cells infected by Mycobacterium tuberculosis
3 讨论
结核病是由结核分枝杆菌引起的一种严重的健康问题[17]。据报道,全世界约有三分之一的人口受到结核分枝杆菌的感染,死亡率占感染性疾病的首位[18]。尽管目前已使用卡介苗作为全球唯一可用的结核病疫苗。但是卡介苗在对抗感染方面并没有显著的效果,且在发展中国家,结核病的发病率有明显上升[19]。
结核分枝杆菌感染会引发机体免疫反应,随着免疫反应的增强,会促进下游识别受体,如TLR-2、TLR4的表达[20]。TLR-2、TLR4持续的异常表达会刺激下游促炎因子IL-1β、TNF-α、TNF-γ的表达,进而导致炎症的发生[21]。炎症发展对招募免疫细胞具有重要的作用,但同时会导致免疫紊乱,从而使炎症进一步发展,导致机体损伤加重[22]。近期有研究发现II型肺泡上皮细胞具有免疫调控的作用[23]。II型肺泡上皮细胞具有合成和分泌表面活性物质的功能,其中SP-A、SP-D是两种常见的亲水性表面活性物质[24]。SP-A、SP-D是肺部重要的天然免疫防御分子,具有调节免疫和炎症的作用[25]。SP-A、SPD可下调IL-1β、TNF-α等促炎因子的表达,同时抑制细胞因子的合成和释放,促进抑炎因子的表达,进而抑制机体炎症反应[26]。miR-214属于microRNA家族重要的成员之一。李丹等[27]研究报道显示,miR-214过表达的缺血性急性肾损伤大鼠炎症浸润加重。本研究发现H37Rv感染A549细胞后,miR-214表达异常上调,FGF9表达显著下调。过表达miR-214会导致SP-A、SP-D、IL-10含量降低,TLR-2、TLR-4、TNF-α、IL-1β、TNF-γ含量显著升高,呈现出对免疫反应的过度激活和炎症反应的促进作用。FGF9表达会升高SP-A、SP-D、IL-10含量,降低TLR-2、TLR-4、TNF-α、IL-1β、TNF-γ含量。结果提示miR-214会导致免疫反应过度激活,导致II型肺泡上皮细胞免疫反应紊乱,导致炎症的发展,而FGF9则与之相反。
有文献表明miR-214和FGF9之间存在结合位点。因此,推测FGF9可能对感染后的II型肺泡上皮细胞具有调控作用。FGF9属于FGFs家族成员之一。在肿瘤学领域,FGF9被认为是多类癌症进展的重要介质,其在免疫领域的作用机制尚不明确。有研究认为FGF9的表达可促进II型肺泡上皮细胞的生长[28]。本研究通过双荧光素酶报告、qRT-PCR和Western检测也证实miR-214可靶向抑制FGF9的表达。且过表达FGF9可阻断miR-214对免疫反应的过度激活和对炎症反应的促进作用。
PI3K/AKT信号通路可调节T细胞生长、分化、代谢等过程[29]。PI3K/AKT通路被抑制后,会促进Treg细胞的增殖以及活化,进而导致免疫逃逸。结核分枝杆菌可通过抑制PI3K/AKT信号通路的活化[30]。本研究结果显示过表达miR-214会抑制PI3K/AKT信号通路的活化,过表达FGF9会促进PI3K/AKT信号通路的活化,且过表达FGF9可阻断miR-214对PI3K/AKT信号通路的抑制作用。
综上所述,miR-214可通过靶向抑制FGF9的表达,进而抑制PI3K/AKT信号通路的激活,导致经结核分枝杆菌感染的II型肺泡上皮细胞免疫反应紊乱,并促进细胞免疫反应。本次研究进一步完善了结核病的发病机制,为预防结核病以及更有效治疗结核病具有重要的指导作用。但目前的研究仍缺乏进一步的动物研究。考虑到A549细胞属于人类肺泡基底上皮细胞,与人和小鼠的同源性极高,有望成功得到进一步的体内研究证实。
