基于网络药理学与分子对接探讨连花清瘟胶囊入血成分干预细胞因子风暴防治新型冠状病毒肺炎的作用机制
2021-12-13王海娟韩玉洁张晓雪李文瑾郭秋红
王海娟,韩玉洁,张晓雪,李文瑾,郭秋红,2,3*
1河北中医学院;2河北省中药组方制剂技术创新中心;3河北省高校中药组方制剂应用技术研发中心,石家庄 050200
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由冠状病毒感染引起的,以发热、乏力、干咳为主要临床特征,部分患者在发病一周后迅速转为重症,严重者可进一步发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、脓毒症休克、难以纠正的代谢性酸中毒和多器官功能衰竭(multiple organ dysfunction syndrome,MODS)等状态。值得注意的是,少数早期轻症患者,后期突然加重,导致多器官衰竭而死亡,其主要原因是引发细胞因子风暴[1]。
细胞因子风暴(cytokine storm)又称炎症风暴和高细胞介质症(hypercytokinemia),主要由于免疫系统失调后多种细胞因子迅速大量释放,导致肺组织广泛水肿,引起急性肺损伤,与COVID-19的不良预后密切相关,是疾病进展的重要转折点,最终可发展为ARDS、MODS,甚至死亡[2,3]。由此可见,通过抗炎治疗可能是遏制细胞因子风暴防治COVID-19的一种有效方法。
连花清瘟胶囊(简称“连花清瘟”)作为呼吸系统传染病突发公共卫生事件代表中成药,主要由银翘散和麻杏甘石汤化裁而来,包括金银花、连翘、大黄等13味中药,具有清瘟解毒,宣肺泄热的功效。已有研究证实[4],连花清瘟通过调节炎症细胞因子表达,明显改善患者发热、咳嗽、咳痰、气促、乏力等相关症状,使转重比率明显下降,对治疗COVID-19具有十分重要的意义。本研究将以连花清瘟入血成分为基础,通过网络药理学与分子对接探讨干预细胞因子风暴防治COVID-19可能作用机制,以期为临床应用提供理论指导。
1 材料与方法
1.1 连花清瘟入血成分靶点预测
通过查阅文献确定连花清瘟入血成分[5],借助中药系统药理学分析平台(TCMSP,https://tcmspw.com/tcmsp.php)数据库检索连花清瘟入血成分相关靶点,利用中药分子机制生物信息学分析工具(BATMAN-TCM,http://bionet.ncpsb.org/batman-tcm/)数据库对连花清瘟入血成分相关靶点进行补充。通过UniProt(https://www.uniprot.org/)数据库对靶点进行标准化处理,将其转换成与之相对应的基因名称。
1.2 疾病靶点的筛选及韦恩图
利用GeneCards(https://www.genecards.org/)数据库,OMIM(https://www.omim.org/)以及Drugbank(https://go.drugbank.com/)数据库以“Novel coronavirus pneumonia”“Cytokine storm”为关键词收集疾病相关蛋白基因,删除重复靶基因,作为COVID-19与细胞因子风暴疾病靶点,并利用在线韦恩分析工具Venny 2.0(https://bioinfogp.cnb.csic.es/tools/venny/)映射筛选出连花清瘟入血成分对COVID-19以及细胞因子风暴交集作用靶点。
1.3 “中药-成分-靶点-疾病”网络构建与分析
获取的连花清瘟入血成分以及与疾病交集靶点导入Cytoscape 3.8.0软件,构建网络关系图,并利用“Analyze Network”功能对其进行拓扑分析,获取主要有效化合物。
1.4 构建蛋白相互作用(PPI)网络
将连花清瘟入血成分靶点与疾病靶点相交集部分导入String数据库进行检索,把蛋白物种设置为“Homo sapiens”,最低相互作用阈值为0.4,隐藏单独靶点,其余参数不变,获取蛋白相互作用数据文件,将数据导入Cytoscape 3.8.0进行拓扑分析,根据degree值制作PPI网络图,并以degree值大于中位数筛选出核心靶点。
1.5 GO富集和KEGG通路分析
选取连花清瘟入血成分干预细胞因子风暴防治COVID-19靶点,导入生物学信息注释数据库DAVID(https://david.ncifcrf.gov/),分析基因本体论(GO)富集和京都基因与基因组百科全书(KEGG)通路,物种与背景均设置为“Homo sapiens”(P<0.01)进行操作,并按照count进行排序,筛选排名靠前的GO富集和KEGG通路,并通过Origin 2019软件工具,对富集分析结果进行可视化作图。
1.6 构建“靶点-通路”网络图
通过筛选得到的连花清瘟入血成分与疾病共同靶点,与KEGG信号通路一同导入Cytoscape 3.8.0软件,绘制网络图。
1.7 成分-靶点分子对接
基于“中药-成分-靶点-疾病”网络与PPI蛋白互作网络分析,根据degree值选取排名前5个成分与前5个靶基因进行分子对接。首先从ZINC(http://zinc.docking.org/)数据库下载核心化合物相关mol2格式文件,通过PDB(https://www.rcsb.org/)蛋白数据库下载含有原配体的3D结构PDB格式文件,应用PyMol软件删除蛋白水分子,并拆分蛋白与配体,利用AutoDock Vina 1.1.2进行分子对接验证,最后用PyMol对结果进行可视化处理并作图。
1.8 检索多器官组织损伤、免疫损伤和SARS相关靶点
通过GeneCards(https://www.genecards.org/)、OMIM(https://www.omim.org/)、TTD(http://db.idrblab.net/ttd/)数据库,以“SARS”“Liver injury”“Renal injury”“Lung injury”“Cardiovascular injury”“Immune injury”为检索词,收集多器官组织损伤、免疫损伤相关靶点,利用在线工具Draw Venn Diagram分析连花清瘟入血成分与多器官组织损伤、免疫损伤和SARS之间的交集靶点,制作韦恩图。并分别将其交集靶点导入DAVID数据库,进行KEGG通路分析,通过Origin对结果进行可视化处理。
2 结果
2.1 筛选连花清瘟入血成靶点与疾病靶点并制作韦恩图
通过文献查阅确定连花清瘟22个入血成分,剔除无靶点的成分,一共17个连花清瘟入血活性成分(见表1),借助TCMSP和BATMAN-TCM数据库共收集得到237个靶点。利用GeneCards、OMIM以及Drugbank数据库查找COVID-19及细胞因子风暴相关靶点,其中收集COVID-19靶点451个,细胞因子风暴靶点303个,筛除重复靶点得到685个。将连花清瘟入血成分靶点与疾病靶点导入Venny 2.0进行绘制韦恩图,如图1所示。

表1 连花清瘟入血成分Table 1 Absorbed components of Lianhua Qingwen

图1 成分与疾病靶点交集分布Fig.1 Intersection distribution of components and disease targets
2.2 “中药-成分-靶点-疾病”网络图与核心化合物
17个入血成分和47个交集靶点导入Cytoscape软件构建“中药-成分-靶点-疾病”网络图,如图2所示,其中网络共有74个节点,176条边,蓝色代表靶点,黄色代表成分,红色代表疾病与中药名称;利用内部“Analyze Network”功能,并根据degree值进行分析,度值越高,说明其在网络中越重要。结果显示大黄素(emodin)、芒柄花黄素(formononetin)、芦丁(rutin)、没食子酸(gallic acid)、甘草素(liquiritigenin)成分在网络中排名较高,可能是连花清瘟入血成分干预细胞因子风暴防治COVID-19重要活性成分。
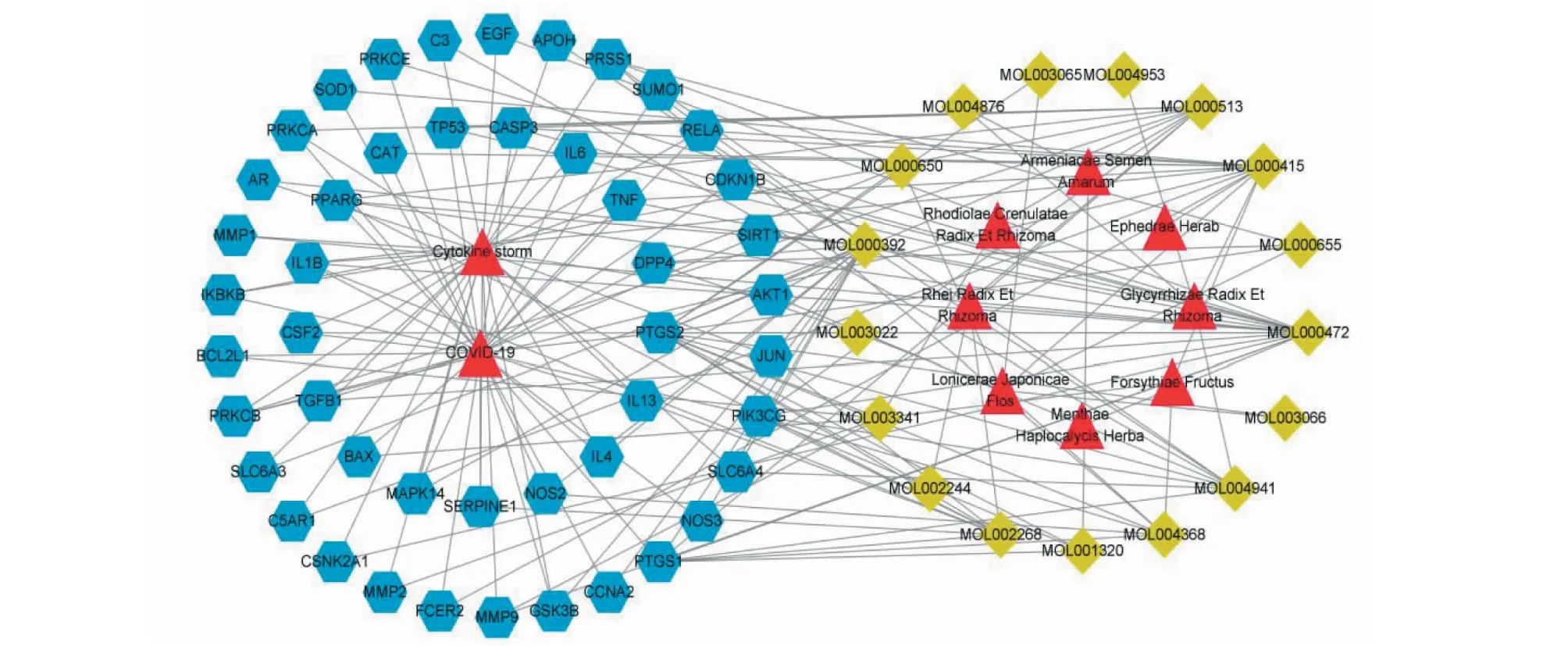
图2 “中药-成分-靶点-疾病”网络Fig.2 “Herbs-components-targets-disease” network
2.3 PPI网络制作及筛选关键靶点
将17个入血成分靶点与疾病靶点相映射得到47个相交集靶点,导入String数据库进行PPI网络分析,设置蛋白互作综合得分> 0.4,隐藏单独靶点,其余参数不变,得到PPI网络信息,导入Cytoscape软件进行网络拓扑分析,根据degree值制作PPI网络图,如图3所示,其中节点表示每个蛋白,节点与节点之间的连线表示蛋白之间的相互作用关系;以“degree >中位数(20)”筛选出核心靶点22个(见表2),连花清瘟入血成分可能与核心靶点结合而发挥其药理作用。
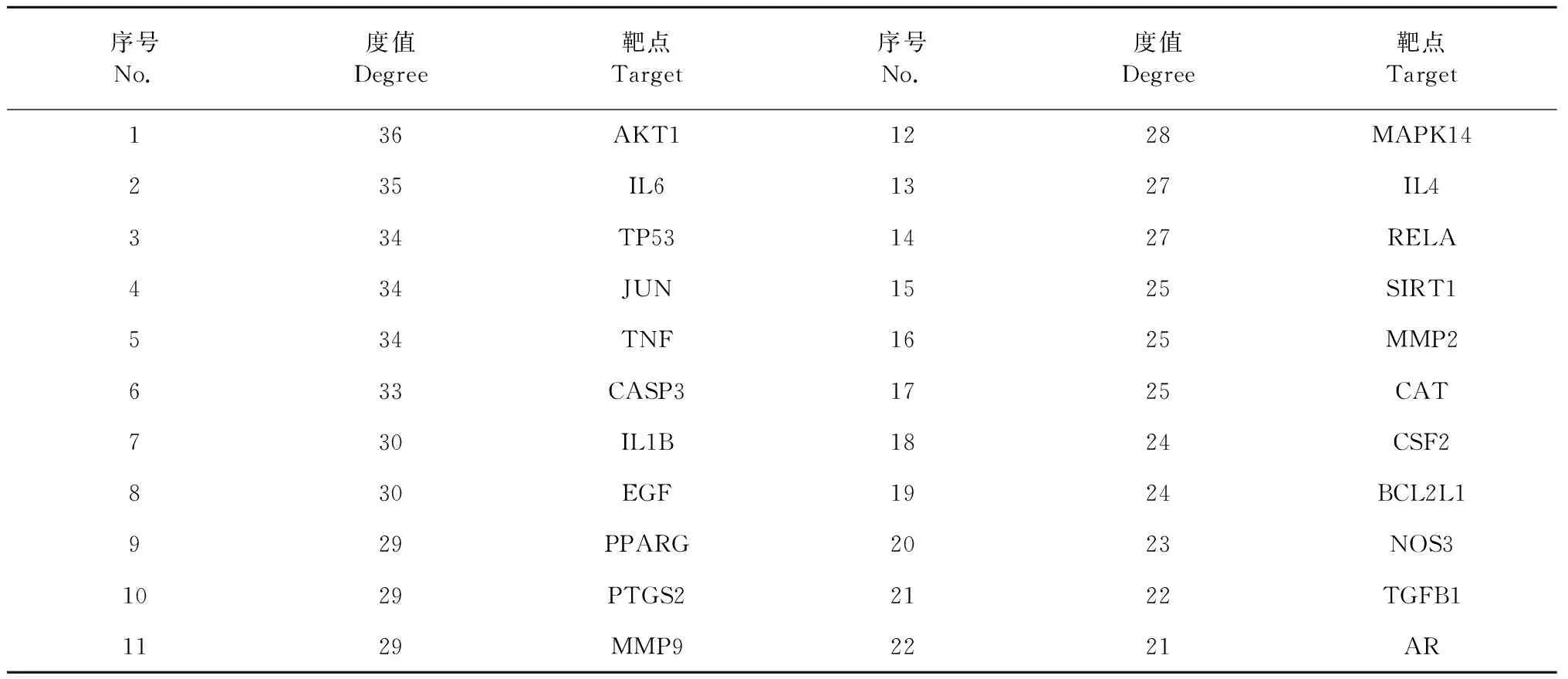
表2 连花清瘟入血成分关键靶点信息Table 2 Information on the key targets of absorbed components of Lianhua Qingwen

图3 PPI蛋白互作网络Fig.3 PPI protein interaction network
2.4 GO富集和KEGG通路分析
把得到的47共同靶点导入DAVID数据库进行GO生物功能注释,获得GO条目174个(P<0.01),分别包括生物过程(BP)129个,细胞组成(CC)15个,分子功能(MF)30个,根据count值选取各自排名前10个条目绘制柱状图,如图4所示,其中生物过程主要与炎症反应(inflammatory response)、信号转导(signal transduction)、免疫反应(immune response)等相关;细胞组成主要富集在细胞质(cytoplasm)、核(nucleus)、线粒体(mitochondrion)等;分子功能主要涉及在蛋白结合(protein binding)、细胞因子活性(cytokine activity)、蛋白激酶活性(protein kinase activity)等。KEGG通路分析共富集于83个条目(P< 0.01),筛选排名靠前的20个条目进行可视化分析,绘制气泡图,如图5所示,主要涉及癌症通路(pathways in cancer)、TNF信号通路(TNF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、NF-κB信号通路(NF-κB signaling pathway)等。
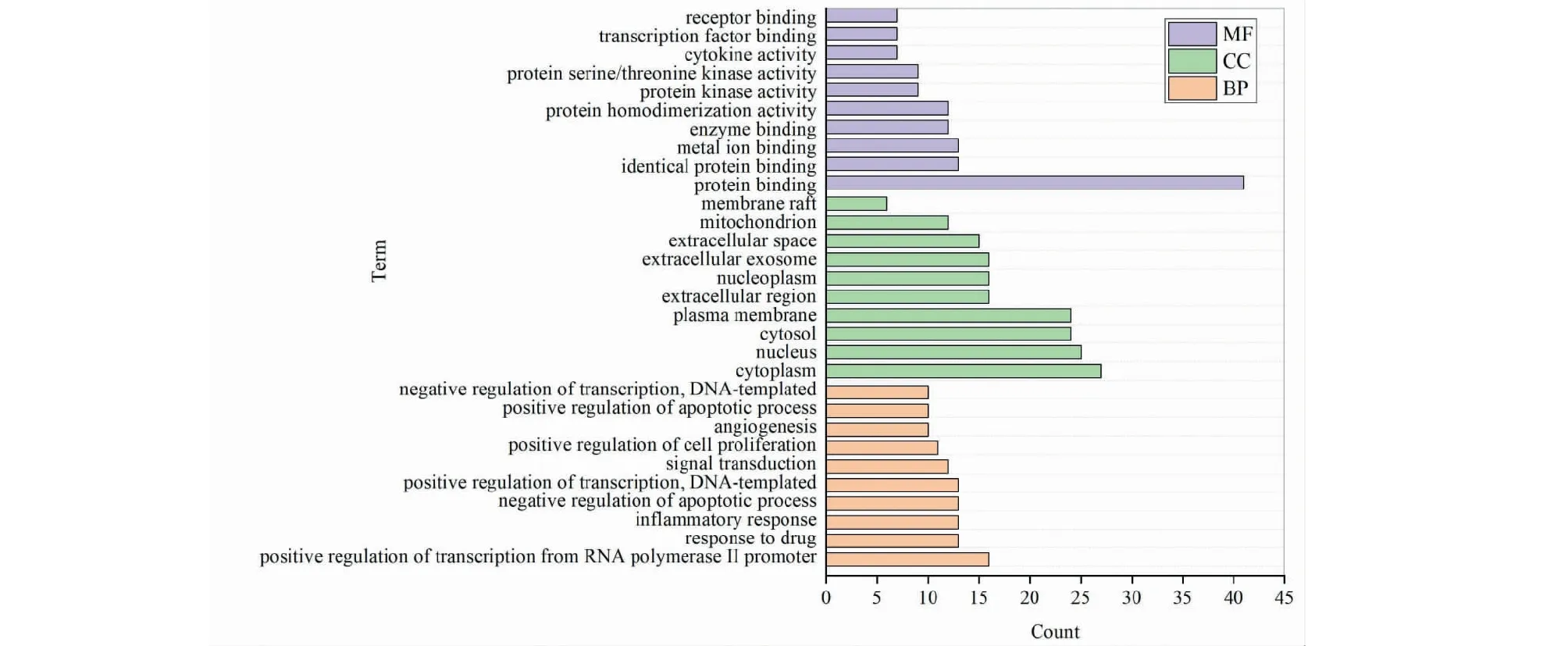
图4 GO功能分析Fig.4 GO functional analysis

图5 KEGG通路分析Fig.5 KEGG pathway analysis
2.5 构建“靶点-通路”网路图
47个靶点,83条KEGG通路导入Cytoscape软件构建“靶点-通路”网络图,如图6所示,其中网络共有132个节点,790条边,利用内部的“Analyze Network”功能进行分析,在47个靶点中PIK3CG、AKT1、RELA、TNF、IKBKB、JUN、IL6、TP53、PRKCA、MAPK14、PRKCB、IL1B、TGFB1、CASP3、GSK3B、EGF、CDKN1B、BAX、BCL2L1、CSF2、NOS2共参与10条以上信号通路,为富集较多的基因,提示这些基因与连花清瘟入血成分作用机制高度相关。
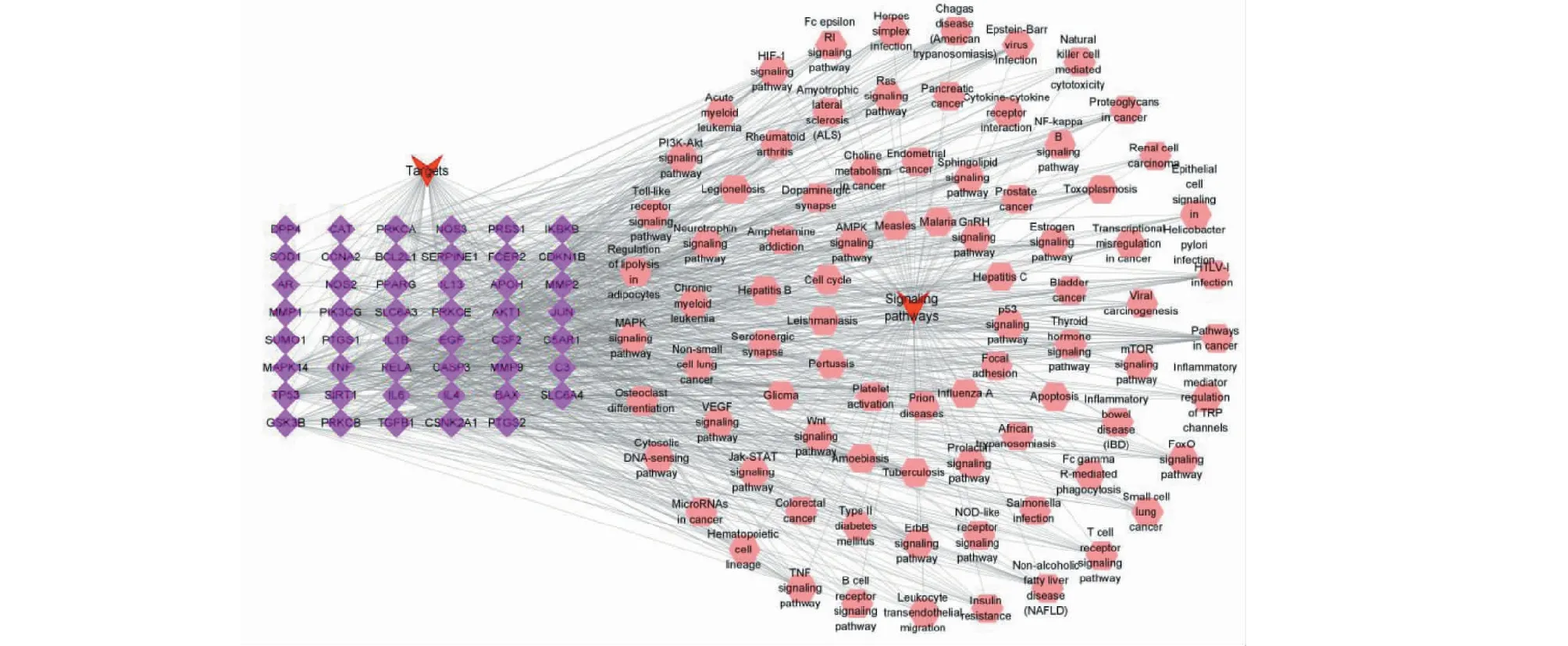
图6 “靶点-通路”网络Fig.6 “Targets-pathways” network
2.6 分子对接验证结果分析
本研究将emodin、formononetin、rutin、gallic acid、liquiritigenin核心化合物与AKT1、IL-6、TP53、JUN、TNF核心靶点进行分子对接验证,结果表明化合物与靶点有良好的结合能力,其结合能越小表示结合活性越高,化合物越容易与靶点结合。结果见表3所示,核心化合物emodin分别与AKT1、JUN、TNF、ACE2结合能均小于-8 kcal/mol;Liquiritigenin与TNF结合能最低,其次为emodin与JUN,表明liquiritigenin、emodin与TNF、JUN结合活性最强;而emodin通过结合位点MET-111、ASN-114形成氢键作用。分子对接情况如图7所示。
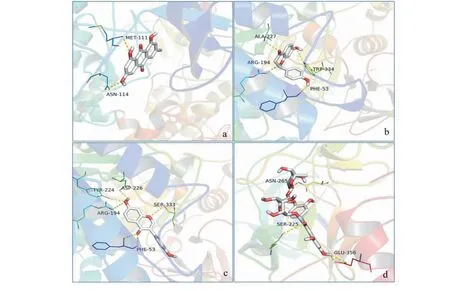
图7 化合物与靶点分子对接图Fig.7 Molecular docking diagram of compounds and target注:a.大黄素-JUN;b.甘草素-TNF;c.芒柄花黄素-TNF;d.芦丁-AKT1。Note: a.Emodin-JUN;b.Liquiritigenin-TNF;c.Formononetin-TNF;d.Rutin-AKT1.

表3 化合物与靶点分子对接结果Table 3 Molecular docking results of compound and target
2.7 连花清瘟入血成分对多器官组织损伤、免疫损伤和SARS的作用
通过数据库检索“Liver injury”相关靶点7 842个,“Renal injury”靶点6 685个,“Lung injury”靶点8 484个,“Cardiovascular injury”靶点6 513个,“Immune injury”靶点7 343个,“SARS”靶点1 688个。为了进一步分析连花清瘟入血成分对多器官组织损伤以及免疫损伤是否有调控作用,把连花清瘟入血成分靶点与器官组织损伤、免疫损伤靶点之间取交集,并制作韦恩图,如图8所示,交集靶点个数与比例见表4。
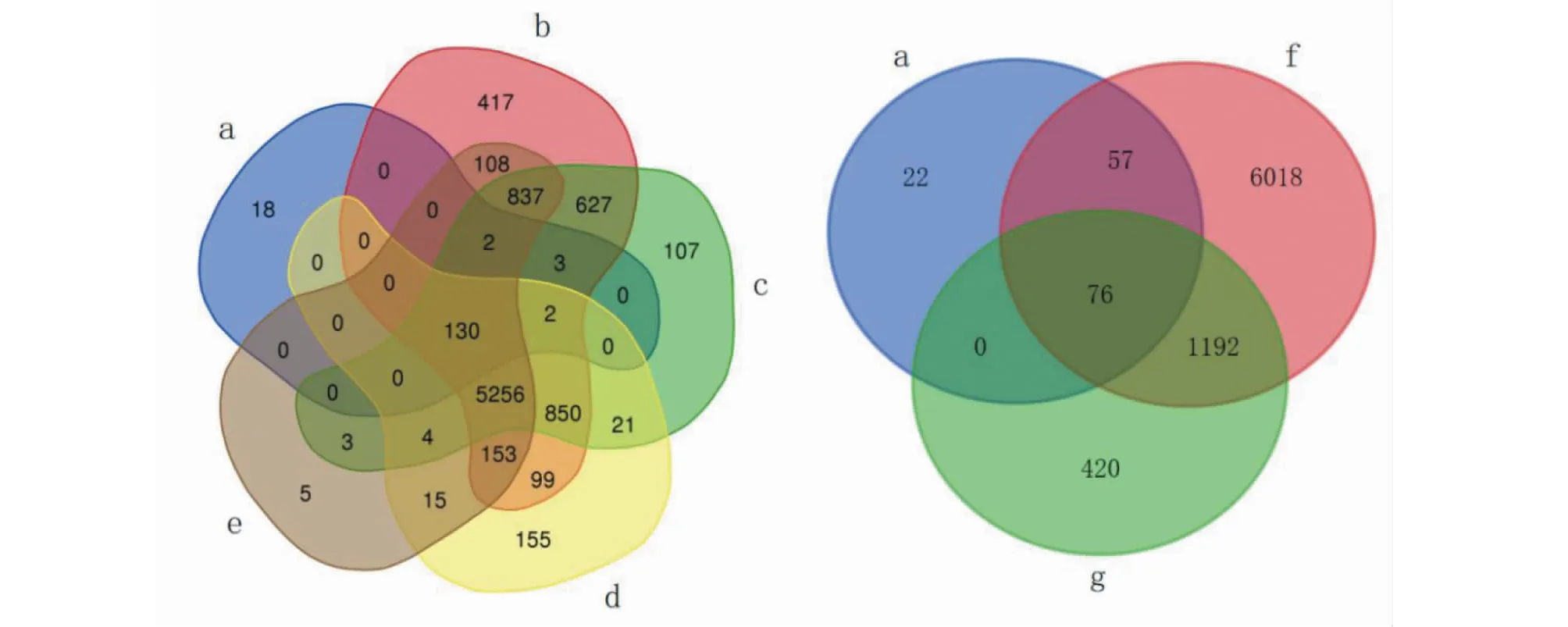
图8 连花清瘟入血成分与多器官组织损伤和免疫损伤、SARS韦恩图Fig.8 Venn diagram of absorbed components of Lianhua Qingwen and multiple organ tissue injury,immune injury and SARS注:a.连花清瘟入血成分;b.肺损伤;c.肝损伤;d.肾损伤;e.心血管损伤.f.免疫损伤;g.SARS。Note: a.absorbed components of Lianhua Qingwen;b.Lung injury;c.Liver injury;d.Renal injury;e.Cardiovascular injury;f.Immune injury;g.SARS.
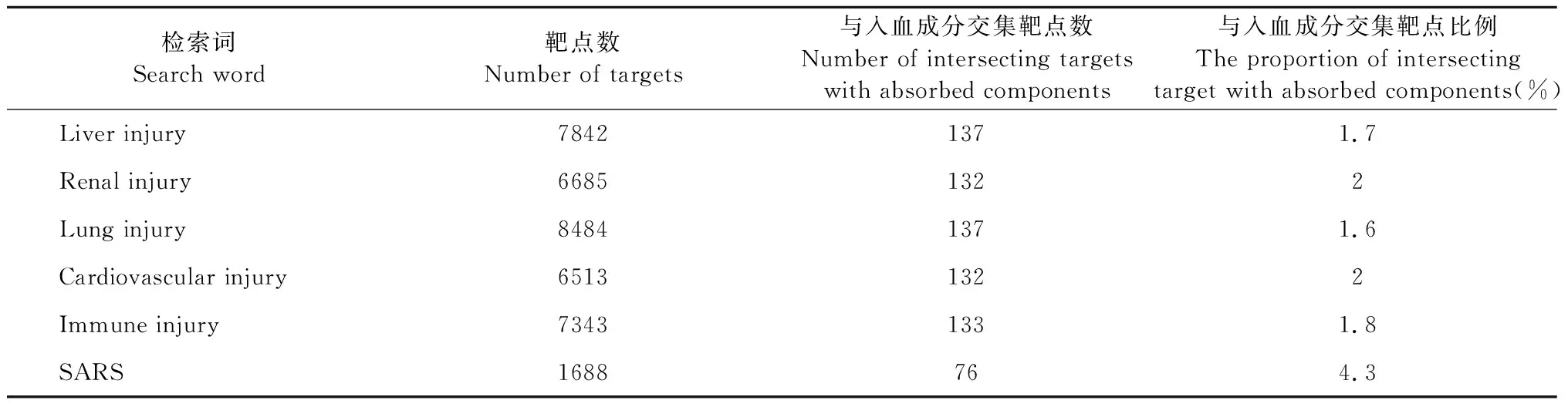
表4 连花清瘟入血成分与多器官组织损伤、免疫损伤和SARS靶点信息Table 4 Target information of absorbed components of Lianhua Qingwen and multiple organ tissue injury,immune injury and SARS
将连花清瘟入血成分与SARS得到的76个交集靶点,多器官组织损伤130个交集靶点,免疫损伤133个交集靶点,分别导入DAVID数据库进行KEGG通路分析,并筛选各自排名靠前的12个条目进行绘制条形图,如图9所示,结果显示多器官组织损伤、免疫损伤和SARS主要涉及癌症通路(pathways in cancer)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、MAPK信号通路(MAPK signaling pathway)、TNF信号通路(TNF signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)等。
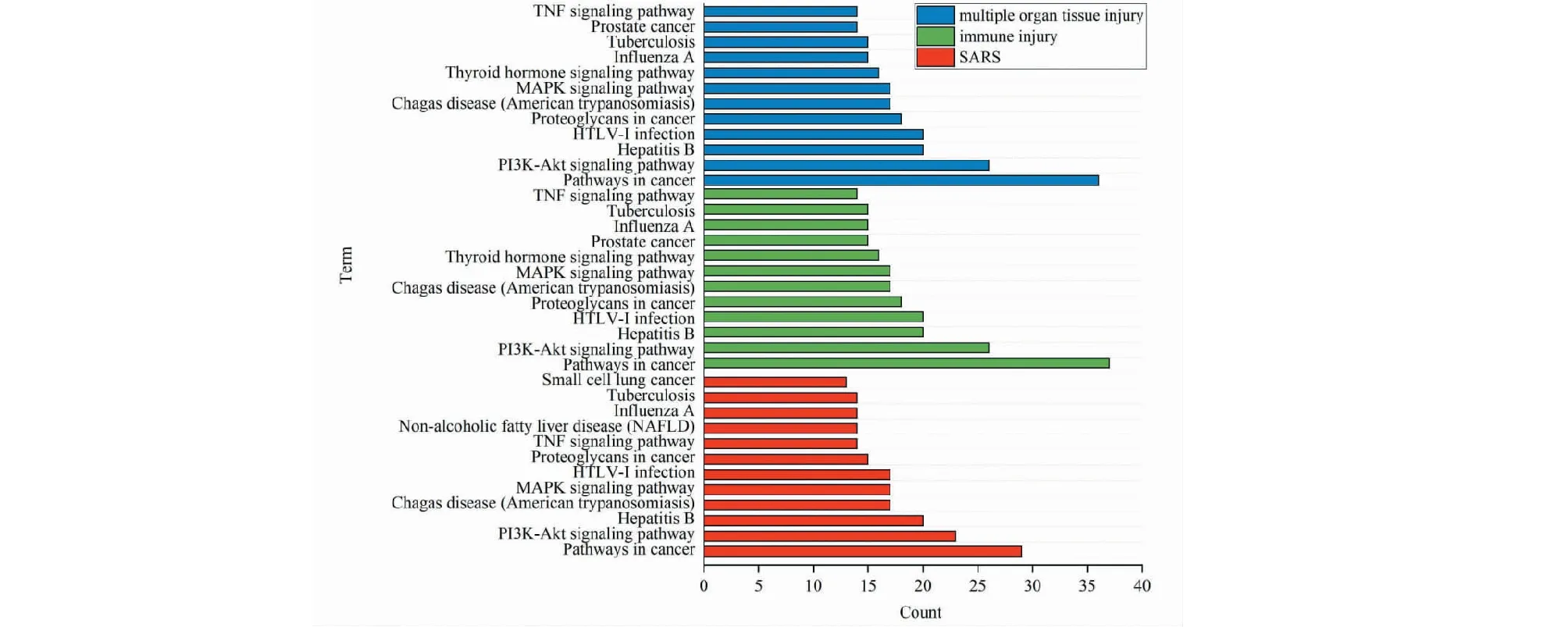
图9 连花清瘟入血成分与SARS、多器官组织损伤和免疫损伤KEGG通路分析Fig.9 KEGG pathway analysis of absorbed components of Lianhua Qingwen and multiple organ tissue injury,immune injury and SARS
3 讨论
本研究通过查阅文献得出17个连花清瘟有效入血成分,利用网络拓扑学分析得到emodin、formononetin、rutin、gallic acid、liquiritigenin核心成分;获得47个连花清瘟入血成分干预细胞因子风暴防治COVID-19潜在作用靶点,包括AKT1、IL-6、TP53、JUN、TNF、CASP3、IL1B、EGF等22个核心靶点。为了更好的诠释靶点涉及的功能,本研究对47个靶点进行了GO富集分析和KEGG通路分析,结果发现连花清瘟入血成分作用机制主要富集RNA聚合酶Ⅱ启动转录正调控(positive regulation of transcription from RNA polymerase Ⅱ promoter)、炎症反应(inflammatory response)、NF-κB转录因子活性正调控(positive regulation of NF-KappaB transcription factor activity)等与炎症相关的生物过程;KEGG通路分析主要涉及癌症通路(pathways in cancer)、TNF信号通路(TNF signaling pathway)、MAPK信号通路(MAPK signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、NF-κB信号通路(NF-κB signa-ling pathway)等。分子对接显示连花清瘟入血成分中emodin、formononetin、rutin、gallic acid、liquiritigenin核心化合物与AKT1、IL-6、TP53、JUN、TNF核心靶点有良好的结合能力,推测连花清瘟入血成分可能通过调节相关靶点,抑制炎症细胞因子分泌,阻断SARS-CoV-2病毒与ACE2蛋白结合,防止SARS-CoV-2感染人体细胞,进而发挥干预细胞因子风暴的效果。
为了进一步分析连花清瘟入血成分对多器官组织损伤以及免疫损伤是否有调控作用,通过数据库检索多器官组织损伤以及免疫损伤相关靶点,并与连花清瘟入血成分靶点之间取交集,结果显示连花清瘟胶囊入血成分与多器官组织损伤及免疫损伤相交集靶点比例为1.6%~2%。因SARS病毒与冠状病毒具有高度的同源性,把连花清瘟入血成分与SARS病毒两者之间取交集,得出连花清瘟入血成分与SARS交集靶点比例为4.3%。提示连花清瘟入血成分有调节免疫,保护组织器官以及抗病毒的可能。KEGG通路分析结果显示多器官组织损伤、免疫损伤和SARS主要涉及癌症通路、PI3K-Akt、MAPK、TNF、HIF-1等信号通路。故本研究根据靶点预测,及KEGG通路分析,将从清除抗原,调节免疫系统,保护组织器官三个方面探讨连花清瘟入血成分干预细胞因子风暴防治COVID-19的作用。
3.1 清除抗原—抗病毒
新型冠状病毒是COVID-19的病原体,广州医科大学第一附属医院呼吸疾病国家重点实验室研究发现连花清瘟体外可明显抑制新型冠状病毒活性,减少细胞胞膜及胞浆中病毒含量,抑制细胞因子过度激活。研究发现,ACE2是SARS-CoV-2宿主细胞受体,SARS-CoV-2与ACE2 结合是病毒感染人体细胞的重要环节,SARS-CoV-2感染后进入肺泡细胞,短期内复制大量细胞因子,最终形成细胞因子风暴引发炎症[6,7]。Ho等[8]发现大黄素通过阻断SARS-CoV蛋白与ACE2受体结合来抑制SARS-CoV感染,从而起到抗病毒作用。已有研究表明,芦丁200mg/kg时,对流感小鼠肺指数抑制率为27.3%,具有明显抗流感病毒的作用,而对流感病毒抑制作用可能在释放和扩散阶段[9,10]。MAPK是一种已知可被多种病毒激活的主要细胞信号通路,此前有关人冠状病毒感染的报道显示,p38 MAPK通路激活,其下游调控蛋白磷酸化增强,促进促炎细胞因子的产生,并导致细胞因子风暴[11]。Wang等[12]通过体内和体外实验发现,大黄酸可以抑制甲型流感病毒(IAV)吸附和复制,可能是通过抑制MAPK以及NF-κB信号通路有关。已经证实甘草主要成分甘草酸可以抑制SARS-CoV病毒在体外培养Vero细胞内的复制,还能抑制病毒在复制周期早期阶段的吸附和渗透[13]。以上说明连花清瘟入血成分具有广谱抗病毒作用,可能通过抑制病毒繁殖,进一步从源头遏制细胞因子风暴发生。
3.2 免疫调节—抑制炎症风暴
免疫紊乱是细胞因子风暴的核心,病毒进入机体后,使免疫调控网络失衡,导致促炎细胞因子与抗炎细胞因子之间平衡失调,使机体走向一种高炎症状态,进而引发细胞因子风暴。通过韦恩图发现连花清瘟入血成分与免疫损伤有133个共同靶点,由此可知连花清瘟入血成分可能通过免疫调节达到抑制炎症风暴。根据已有研究发现,COVID-19患者外周血CD4+和CD8+T淋巴细胞显著减少,但CD4+T淋巴细胞Th17亚群增加,CD8+T淋巴细胞含有更高浓度的细胞毒性颗粒,提示在某种程度上,病人免疫程度损伤严重[14]。IL-6是一种促炎细胞因子,IL-6分泌有助于辅助评估COVID-19严重程度,且IL-6水平动态变化可作为重症新冠肺炎患者病情监测的指标[15]。TNF-α主要有单核巨噬细胞分泌的小分子蛋白,释放炎性因子参与炎症反应,进而加重疾病发生发展。已有研究发现激活NF-κB通路,导致TNF-α和IL-6等促炎细胞因子的过度表达,阻断NF-κB信号通路不仅可以抑制病毒传播,还可以抑制相关炎症发展[16]。甘草酸在绵羊肺炎支原体(MO)感染中,可以通过增加MO感染后的巨噬细胞增殖,从而起到免疫调控作用[17]。大黄素作为大黄的主要成分之一,除了能抑制炎症早期细胞因子外,还能抑制炎症级联反应,降低“次级”炎症细胞因子表达,通过抑制NF-κB p65磷酸化,能使IL-6、TNF-α在外周血中表达降低,抑制LPS诱导的巨噬细胞释放细胞因子,具有较理想抗炎功效[18,19]。已有研究表明芒柄花黄素可以降低对脑组织炎症因子表达,主要是通过控制SphK1/SIP信号通路的激活,从而抑制NF-κB信号通路,进一步改善炎症因子对脑组织的损伤[20]。Liu等[21]观察发现红景天苷能使血清中促炎细胞因子和肺部炎症显著降低,明显抑制TNF-α、IL-1β、IL-6促炎细胞因子,使抗炎细胞因子IL-10水平明显升高。以上表明,连花清瘟入血成分通过抑制NF-κB信号通路,下调促炎细胞因子表达,上调抗炎细胞因子水平,使促炎细胞因子与抗炎细胞因子之间平衡,从而起到干预细胞因子风暴作用。
3.3 组织器官保护
细胞因子风暴的后果是多器官功能衰竭,过量的细胞因子释放会导致组织损伤,严重者导致死亡。在临床生化检验指标中发现,COVID-19主要损伤器官是肺,其次对心、肝、肾也有不同程度的损伤[22]。根据连花清瘟入血成分与各脏器损伤的靶点制作韦恩图可知,连花清瘟入血成分对各脏器损伤都有交集靶点,可能通过这些靶点减轻组织器官损伤,增强机体免疫功能。PI3K属于胞内磷脂酰肌醇激酶,Akt是PI3K下游非常重要的活性靶标,属于一种丝氨酸/苏氨酸蛋白激酶。PI3K/Akt信号通路在LPS诱导的慢性肝损伤中表达升高,显著影响NF-κB信号通路,导致细胞转录改变,最终导致肝功能障碍;有研究证明苦杏仁苷对细胞中PI3K和磷酸化AKT表达降低,表明苦杏仁苷通过抑制PI3K/AKT和NF-κB信号通路,增强抗炎能力,对肝损伤具有显著保护作用[23]。Hu等[24]研究发现LPS诱导TNF-α、IL-1、IL-6炎症反应是急性肺损伤(ALI)恶化的关键因素,因此,抑制促炎细胞因子过量产生和表达来降低LPS诱导ALI不可忽视。大黄素在重症急性胰腺炎(SAP)肺损伤大鼠模型中,通过下调NF-κB、TNF-α、IL-1β炎症表达,起到保护SAP肺损伤,保护机体的作用[25]。说明连花清瘟入血成分,通过抑制PI3K/AKT、NF-κB炎症信号通路,具有减轻组织器官损伤的作用。
综上所述,通过网络药理学与分子对接对连花清瘟入血成分进行探究性研究,表明连花清瘟入血成分具有多成分、多靶点、多通路的特点,能通过调节相关细胞因子及信号通路发挥清除抗原、调节免疫和保护组织器官的作用。该研究为连花清瘟胶囊有效防治COVID-19提供了物质基础及理论依据。
