网络药理学技术预测昆仑雪菊总黄酮治疗非小细胞肺癌作用及初步验证研究
2021-12-13伊丽米热吾甫尔库热西玉努斯王志滨国鲁源吴桂霞
伊丽米热·吾甫尔,库热西·玉努斯,王志滨,国鲁源,吴桂霞*
1新疆医科大学基础医学院;2新疆医科大学维吾尔医学院;3新疆医科大学第二临床医学院,乌鲁木齐 830011
肺癌是全球最常见的癌症之一。大约85%的肺癌是非小细胞肺癌(non small cell lung cancer,NSCLC)[1]。临床对于肺癌的主要治疗手段有手术、化疗、放疗和生物治疗等。完全手术切除虽有效但前提是该疾病在医学上可操作且可适当分期[2]。放、化疗药物具有非特异性,往往产生严重的毒副作用。中药因具有多靶点、多途径、多效应的作用特点在肿瘤的预防及治疗领域发挥了独特的作用。已有多种中药成分及其提取物被发现具有较好的抗肿瘤作用,如苦参碱、三羟异黄酮、紫杉醇等,其中一些已广泛地应用于临床[3-5]。昆仑雪菊又被称作两色金鸡菊(CoreopsistinctoriaNutt.)。现代药效学研究表明新疆昆仑雪菊富含多酚类、黄酮类、多糖等多种化学成分[6],其中黄酮类具有降血脂、调节血糖、抗肿瘤等重要的药理作用[7,8]。但由于黄酮类成分多、靶点多、作用途径多,使其治疗疾病的分子机制研究存在一定困难。
网络药理学(network pharmacology)是基于系统生物学和多向药理学的研究方法,通过构建“药物-靶点-疾病”的多层次相互作用网络,从整体水平上分析药物作用靶点及作用机制[9]。本文通过应用网络药理学结合体外细胞实验,分析昆仑雪菊总黄酮(Kunlun chrysanthemum total flavonoids,KCTF)对NSCLC的抗瘤成分及作用机制,为其后续的药物研发和临床应用提供实验依据。
1 材料
1.1 细胞
人非小细胞肺癌细胞(A549)由新疆医科大学协同创新细胞库提供。
1.2 药品与试剂
DMEM液体培养基和胎牛血清(赛默飞世尔科技有限公司);Annexin V-FITC/PI试剂盒(美国BD公司);TRIzol Reagent(赛默飞世尔科技有限公司);反转录试剂盒(赛默飞世尔科技公司);QuantiNova SYBR Green染料法PCR试剂盒(凯基生物公司);RIPA裂解液(碧云天生物技术公司);BCA蛋白浓度测定试剂盒(碧云天生物技术公司);兔单抗Bax、兔单抗Bcl-2(Abcam公司,ab32503、ab32124);小鼠单抗β-actin(武汉博士德生物工程有限公司,BM0627);昆仑雪菊(新疆雪菊生物科技有限公司,生产许可证号:QS650114020007)。
1.3 仪器
NovoCyte D2060R流式细胞仪(ACEA公司);MF53倒置荧光显微镜(德国莱卡公司);ABI 7500 Real-Time PCR仪(Applied Biosystems公司)。
2 方法
2.1 KCTF的提取及纯化分离
60 ℃烘干箱内烘干雪菊,研磨后过筛备用,按照1∶60投料比,加入80%的乙醇,超声萃取仪超声1.5 h后过滤,共三次。滤液经旋转蒸发仪蒸发浓缩得其浸膏。将粗黄酮浸膏装入大孔树脂的玻璃层析柱中,经12 h浸泡后,60%乙醇洗脱,收集洗脱液,旋蒸后得KCTF纯化物,经紫外分光光度计法测其总黄酮含量。
2.2 雪菊-类黄酮广靶代谢组分析
用600 μL提取液(50%甲醇含0.1%甲酸)复溶总黄酮纯化物,涡旋30 s后冰水浴超声15 min,4 ℃,12 000 rpm离心15 min,取上清于2 mL进样,UPLC BEH C18色谱柱(1.7 μm,2.1 mm×150 mm)上机检测。柱温箱温度设为40 ℃,自动进样器温度设为8 ℃,进样体积为2 μL。
2.3 应用网络药理学进行靶点预测及网络构建
2.3.1 KCTF靶点预测
通过HPLC法得到KCTF的化合物组分,从TCMPS(https://lsp.nwu.edu.cn/tcmsp.php)中对KCTF的主要化合物分子进行吸收、分布、代谢、排泄和毒性(ADME/T)预测和评价。对符合药物口服生物利用度(oral bioavailability,OB)≥30%,类药性值(drug-like,DL)≥0.18的成分进行筛选,得出总黄酮的有效活性成分。再通过TCMSP平台预测上述有效活性成分的靶点。将所有靶点通过STRING(https://www.string-db.org/)数据库以“Homo sapiens”(人属)为关键词进行基因-蛋白名称转换。
2.3.2 NSCLC相关靶点网络构建[10]
通过DiSGeNET(http://www.disgenet.org/),以“Non-Small Cell Lung Carcinoma”为关键词检索NSCLC相关靶点,获得所有已知的与NSCLC有关的基因靶点。借助STRING数据库,输入上述关键靶点,物种限定设置为人类。将查询到的与NSCLC有关的靶点与KCTF有效活性成分的作用靶点取交集,筛选KCTF治疗NSCLC的潜在靶点。应用STRING数据库,输入上述潜在靶点,随后进行PPI网络构建与分析,获取关键靶点。
2.3.3 关键靶点的KEGG通路富集分析
通过DAVID(https://david.ncifcrf.gov/)对关键靶点进行KEGG通路富集分析,并通过OmicShare(http://www.omicshare.com)平台对结果进行可视化处理。
2.3.4 总黄酮-靶点-通路网络构建
应用Cytoscape 3.6.0软件绘制关键靶点-通路网络和KCTF化合物-关键靶点网络。最后将KCTF化合物-关键靶点网络和关键靶点-通路网络进行合并。建立KCTF-靶点-通路网络。通过Network analyzer分析评价网络的拓扑结构特性。
2.4 昆仑雪菊总黄酮对A549细胞的抗瘤作用
2.4.1 细胞培养
A549细胞复苏后加入到10%的DMEM培养基中,置入37 ℃、5%CO2的培养箱中培养,待细胞进入快速生长期后传代培养。
2.4.2 CCK8法检测细胞活性
A549细胞接种于96孔板中(1×105/孔),经48 h细胞融合时进行实验。不同浓度的雪菊总黄酮提取物(400、800、1 600、2 400、3 200 μg/mL)的药物100 μL,以DDP作为对照组,继续培养24 h后,每孔加入CCK8 100 μL,将培养液倾去,酶联仪490 nm波长测各孔的OD值。按照如下公式计算细胞抑制率,半数抑制浓度(inhibitory concentration 50,IC50)值由IC50值计算软件求出。实验重复3次。
细胞生长抑制率=[1-OD实验/OD对照]×100%
2.4.3 流式细胞仪检测细胞凋亡
A549细胞接种至6孔板中,待细胞达到对数生长期后,分为三个处理组:阴性对照组;雪菊总黄酮干预组;阳性对照组(顺铂,DDP),干预处理细胞48 h,胰酶消化后收集细胞悬液,离心5 min;PBS洗涤、重悬后,取100 μL的细胞悬液与Annexin V-FITC 5 μL和PI 5 μL混匀后避光,室温孵育45 min;流式上机检测,CELL Quest软件分析。
2.4.4 细胞划痕实验观察细胞迁移
按“2.4.3”干预细胞48 h后,胰酶消化细胞;用完全培养基制备成1×105/mL单细胞悬液,细胞接种于培养皿中间的2孔插件Insert(70 μL/孔,即每孔7×104/孔),细胞长满Insert区域后用镊子移除Insert。每隔12 h拍照记录。根据收集图片数据分析实验结果。
2.4.5 RT-qPCR检测A549细胞Bax、Bcl-2和MMP-2 mRNA表达
收集“2.4.3”中平行处理的各组A549细胞,Trizol提取总RNA,按逆转录试剂盒说明书,获得cDNA后,以SYBRGreen荧光染料试剂盒进行实时荧光定量PCR扩增,反应条件设置为95 ℃预变性2 min;95 ℃变性5 s,60 ℃退火30 s,95 ℃延伸15 s,共设置40个循环。用2-△△ct法测定目的基因相对表达量。相关引物序列见表1。
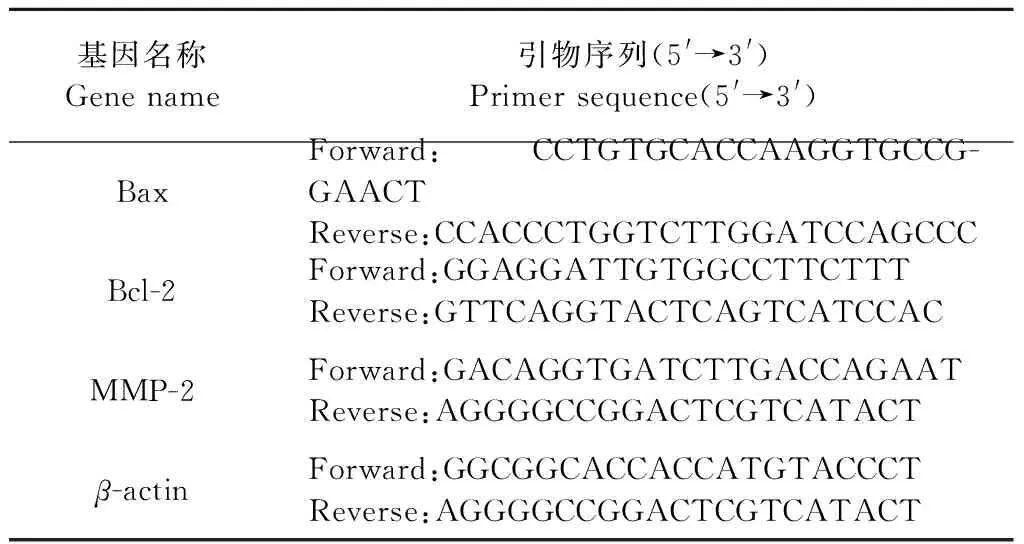
表1 Real-Time PCR所用引物序列表Table 1 Primer sequences used for Real-Time PCR
2.4.6 Western blot检测Bax、Bcl-2的表达
收集“2.4.3”中平行处理的各组A549细胞,提取细胞总蛋白,测定蛋白浓度,电泳分离40 μg蛋白质,转移至PVDF膜,用含5%脱脂奶粉的TBST封闭PVDF膜,室温2 h。一抗4 ℃孵育过夜,二抗室温孵育2 h,TBST充分洗涤PVDF膜5次,5 min/次。化学发光法曝光至医用X胶片上,灰度值扫描后统计处理,重复三次。
2.5 统计学处理
3 结果
3.1 KCTF活性成分筛选
通过HPLC方法对KCTF进行广靶代谢组分析,共得出68个黄酮化合物,根据化合物的分子量(MW)、口服生物利用度(OB)、类药性(DL)从TCMPS获得KCTF的23个活性药效成分(OB≥30%,DL≥0.18),其中表儿茶素没食子酸酯、表没食子儿茶素、芹菜素,紫云英苷4个成分含量较高将其纳入。共得到27个总黄酮的成分。KCTF活性化合物的化学信息(见表2)。

表2 KCTF主要的活性化合物Table 2 Active ingredients of KCTF

续表2(Continued Tab.2)
3.2 KCTF干预NSCLC潜在靶点选择
KCTF的27个活性成分(见表2)从TCMSP数据库和ETCM数据库中预测到891个靶点,通过STRING数据库进行基因-蛋白名称转换及去除重复的靶基因,共得到303个化合物靶点。将DiSGeNET数据库搜索的靶点信息与NSCLC相关的靶点取交集得到217个KCTF对NSCLC潜在的作用靶点(见图1)。
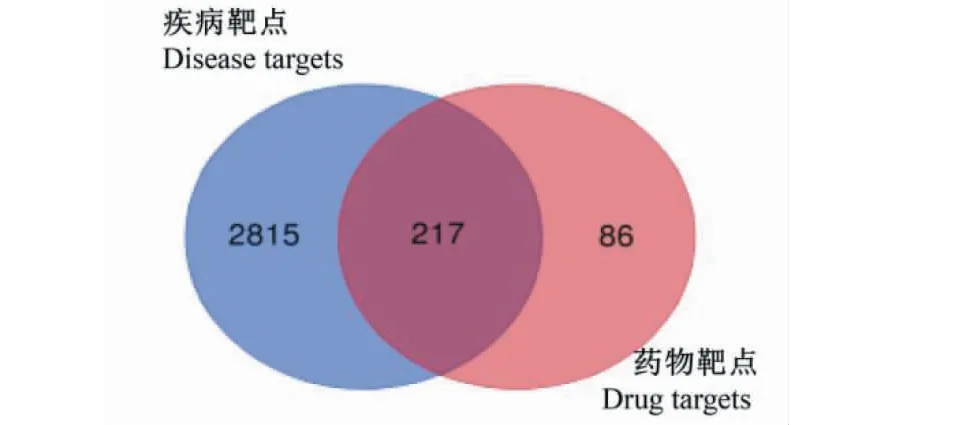
图1 疾病靶点-药物靶点韦恩图Fig.1 Disease targets-drug targets Venn diagram
3.3 PPI网络构建
将217个KCTF对NSCLC潜在的作用靶点导入STRING数据库,选择物种为人类,排除游离的无相互作用蛋白,将minimum required interaction score设置为大于0.998,获得蛋白质相互作用关系,边越粗意味着combine score越大,根据combine score的大小制作出68个关键蛋白节点(见图2)。

图2 PPI网络Fig.2 PPI network
3.4 KEGG通路富集分析结果
KEGG通路富集分析结果显示,88个通路被富集,P<0.01的通路有76条,依据P值大小,选择P值最小即相关度最高的20位,包括细胞凋亡(apoptosis)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、p53信号通路(p53 signaling pathway)、细胞周期(cell cycle)、肿瘤坏死因子信号通路(TNF signaling pathway)等。总黄酮治疗NSCLC关键靶点KEGG通路富集结果见图3。说明总黄酮有效成分的作用靶点分布在不同的信号通路,通过多成分、多靶点互相调节发挥治疗NSCLC的作用。

图3 KEGG通路分析Fig.3 KEGG pathway analysis
3.5 KCTF-靶点-通路网络分析
采用Cytoscape 3.6.0构建KCTF-靶点-通路网络网络模型(见图4),绿色三角形代表化合物,黄色圆形代表作用靶点,蓝色多边形代表通路。由KEGG反向分析得到的前20个通路中共有65个关键靶点。在KCTF的活性成分中表没食子儿茶素没食子酸酯((-)-epigallocatechin gallate)、槲皮素(quercetin)、芹菜素(apigenin)、木犀草素(luteolin)、漆黄素(fisetin)、黄芩素(baicalein)、金合欢素(acacetin)的自由度较高,具有较多的作用靶点,可能在KCTF治疗NSCLC的过程中起到较为核心的作用。在关键靶点方面,HSP90AA1、TP53、AKT1、CCND1、RELA、CDKN1A、MAPK1、CDK4、RB1、CASP3、MDM2、EGFR、CASP9、BAX的自由度均大于15,有较多的活性成分配体。在前20条通路中自由度较大的通路为癌症的途径(pathways in cancer)、细胞凋亡(apoptosis)、PI3K-Akt信号通路(PI3K-Aktt signaling pathway)、HTLV-I感染(HTLV-I infection)、病毒致癌(viral carcinogenesis)、细胞周期(cell cycle)、p53信号通路(p53 signaling pathway)、FoxO信号通路(FoxO signaling pathway)自由度均大于20,其中PI3K-Akt信号通路的自由度为28。KCTF有效成分作用靶点分布于的代谢通路,相互协调。

图4 KCTF-靶点-通路网络Fig.4 KCTF-target-pathways network
3.6 CCK8法检测KCTF对A549细胞的生长抑制作用
CCK8的结果表明,KCTF对A549细胞的生长有明显的抑制作用,且浓度越高对细胞的增殖抑制作用越强;KCTF干预A549细胞24、48及72 h后,计算IC50值(24 h:2 408.09 μg/mL;48 h:1 613.09 μg/mL;72 h:1 338.48 μg/mL),结果表明KCTF对A549细胞的增殖抑制作用具有一定的时间依赖性。根据上述实验结果,将KCTF干预浓度确定为1 000 μg/mL,干预时间确定为48 h,用于后续实验(见表3)。

表3 KCTF对A549细胞的生长抑制作用Table 3 Inhibitory effect of KCTF on A549
3.7 流式细胞检测KCTF对A549细胞凋亡的影响
流式的结果表明,与阴性对照组相比,KCTF干预组(1 000 μg/mL)干预A549细胞后明显促进了细胞的凋亡,差异有统计学意义(P<0.01)(见表4、图5)。
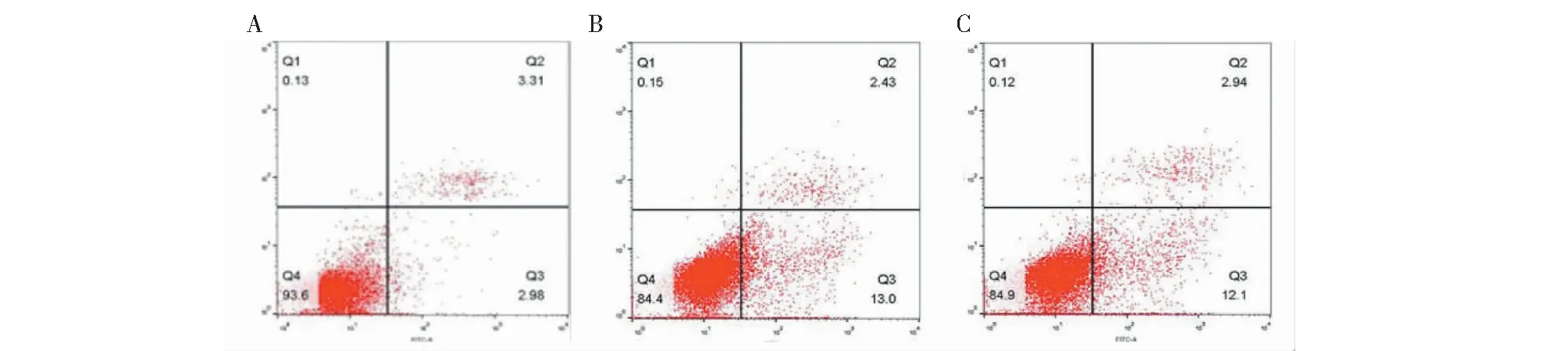
图5 KCTF对A549细胞凋亡的影响Fig.5 The apoptotic effect of KCTF on A549 cells注:A:阴性对照组;B:KCTF干预组;C:阳性对照组。Note:A:Negative control group;B:KCTF intervention group;C:Positive control group.

表4 KCTF对A549细胞凋亡的影响Table 4 The apoptotic effect of KCTF on A549
3.8 细胞划痕观察KCTF对A549细胞迁移的影响
细胞划痕后在0、12、24、36 h分别在镜下观察三组细胞划痕宽度恢复的情况,空白对照组基本保持原有的迁移能力,KCTF干预组(1 000 μg/mL)及阳性对照组在12、24、36 h细胞迁移受到抑制明显,说明KCTF对A549细胞有抑制肿瘤细胞迁移的能力(见表5)。

表5 KCTF对A549细胞迁移的影响Table 5 Effect of KCTF on A549 cell
3.9 RT-qPCR检测A549细胞中Bax、Bcl-2和MMP-2 mRNA表达水平
与阴性对照组比较,KCTF干预组(1 000 μg/mL)Bax的mRNA表达水平上调,差异具有统计学意义(P<0.05),而Bcl-2和MMP-2的mRNA表达水平与阴性对照组比较差异无统计学意义,但有下调趋势(P>0.05)(见表6)。

表6 KCTF对A549细胞中Bax、Bcl-2和MMP-2 mRNA表达水平的影响Table 6 The effect of KCTF on the expression of Bax and Bcl-2 mRNA in A549
3.10 Western blot检测A549细胞中Bax/Bcl-2蛋白的表达水平
如表7所示,与阴性对照组相比(n=3),KCTF干预组(1 000 μg/mL)对A549细胞内促凋亡因子Bax的水平显著升高(P<0.01),抗凋亡因子Bcl-2的表达明显下调(P<0.01),Bax/Bcl-2的比值上调,表明KCTF对A549细胞可能是通过上调Bax/Bcl-2的比值的表达来促进NSCLC的凋亡,从而抑制肿瘤的生长(见图6)。

表7 KCTF对A549细胞中Bax/Bcl-2蛋白表达水平的影响Table 7 The effect of KCTF on the expression of Bax and Bcl-2 protein in A549

图6 KCTF对A549细胞中Bax/Bcl-2蛋白表达的影响Fig.6 The effect of KCTF on the expression of Bax and Bcl-2 protein in A549 cells注:A:阴性对照组;B:KCTF干预组;C:阳性对照组。Note:A:Negative control group;B:KCTF intervention group;C:Positive control group.
4 讨论
广泛存在于各种植物中的黄酮化合物是一种很强的抗氧化剂,能有效地清除体内自由基,具有抗肿瘤、降血压、抗衰老等重要的药理作用。本研究通过HPLC技术对昆仑雪菊中的总黄酮进行成分分析,结果显示相对含量较高的有表没食子儿茶素没食子酸酯、槲皮素、木犀草素、儿茶素等,已有大量的研究结果表明槲皮素、木犀草素等黄酮类对多种实体瘤有较好的抗瘤活性[11,12]。体外的细胞实验已表明,昆仑雪菊总黄酮对人结肠癌HCTI16细胞、Caco-2细胞具有明显的增殖抑制作用[13]。但中药多成分、多靶点、多途径协同发挥药效的作用特点,使其作用机制的现代化研究存在困难。
2007年Hopkins[14]提出的网络药理学,将药物、靶点、疾病的关系在网络中表现出来。利用网络药理学可以系统分析中药的组成成分,挖掘药物与疾病的共同作用靶点,进而分析生物学功能和信号通路,这种整体、系统的研究模式与中医药的整体观理论是相一致的。
在本研究中,通过TCMSP对KCTF的68个成分进行筛选,预测27个黄酮成分的891个靶点,与NSCLC靶点交集后,获得217个KCTF干预NSCLC的可能靶点。其中MAPK1、EGFR、Tp53、Akt、Bax、Bcl-2、Caspase 3等重要靶点与多个化学成分存在关系,表明KCTF各活性成分间存在着密切的协同关系。为进一步对KCTF干预NSCLC的作用机制进行分析,将二者关系进行PPI网络构建与KEGG生物通路富集分析,结果表明PI3K-Akt信号通路、Bax/Bcl-2抗凋亡信号通路、p53信号通路、MAPK信号通路等与KCTF抗瘤作用有关。
诱导肿瘤细胞凋亡、阻遏周期、抑制迁移是抗瘤药物主要的作用机制。研究表明许多植物黄酮(如姜黄素、原花青素、表没食子儿茶素没食子酸酯、槲皮素等)可以通过干扰PI3K-Akt信号通路,直接抑制PI3k或阻断PI3K-Akt信号通路,进一步调节其下游效应分子的表达,从而加速肿瘤细胞周期、促进细胞凋亡和抑制细胞增殖,达到抗肿瘤的作用[15,16]。Xiang等[17]研究表明,槲皮素诱导HeLa细胞凋亡是通过下调PI3K-Akt信号通路中PI3k、Akt和Bcl-2表达,上调Bax表达,使细胞在G0/G1细胞周期阻滞。木犀草素可以通过抑制PI3K-Akt信号通路中MMP-2、MMP-9的表达抑制人黑色素瘤细胞的增殖,诱导其凋亡发挥抗瘤活性[18]。本研究细胞水平的实验结果表明,雪菊总黄酮明显抑制了A549细胞的增殖,促进了细胞的凋亡,抑制细胞的迁移,mRNA水平上验证了雪菊总黄酮上调Bax的表达及下调Bcl-2和MMP-2的表达。当细胞内Bax高表达时,细胞对死亡信号敏感,促进了细胞发生凋亡。当Bcl-2高表达时,Bcl-2可以和Bax形成异源二聚体,抑制细胞凋亡。所以细胞内Bax/Bcl-2的比例对决定细胞凋亡的敏感性起到重要作用,因此利用Western blot在细胞水平上的验证实验表明雪菊总黄酮明显上调Bax/Bcl-2的比值,促进了A549细胞的凋亡。结合网络药理学分析的结果,雪菊总黄酮可通过多靶点、多途径实现干预NSCLC的作用,其抗肿瘤活性可能与影响凋亡基因Bax及Bcl-2的表达有关。
本文在细胞水平观察到了雪菊总黄酮提取物对A549细胞的抗瘤作用,但由于大孔树脂纯化总黄酮的得率较低,药物对细胞抑制率的IC50较高,后续为进行体内的动物实验,将优化纯化方法,提高黄酮得率,降低药物使用浓度,结合网络药理学分析结果,进一步深入研究其抗瘤的分子作用机制。
