忍冬木层孔菌液体培养物的化学成分研究
2021-12-13张宏岐邓改改汪鋆植陈滢潞李堂丽
张宏岐,邓改改,汪鋆植,胡 昆,陈滢潞,李堂丽
1三峡大学医学院;2天然产物研究与利用湖北省重点实验室(三峡大学);3湖北省生物酵素工程技术研究中心(三峡大学),宜昌 443002
忍冬木层孔菌(Phellinuslonicerinus(Bond.) Bond.et Sing)为木层孔菌属的一种多孔真菌,其干燥子实体是药用真菌桑黄的品种之一,也是土家族常用药材,收载于《湖北省中药材质量标准》2009年版[1]。桑黄是目前国际公认的抗癌效果最好的药用真菌之一,作为桑黄使用的裂蹄针层孔菌P.linteus,鲍氏木层孔菌P.baumii等忍冬木层孔菌近缘品种的抗癌活性均有报道[2]。课题组前期对忍冬木层孔菌子实体化学成分[3]、抗肿瘤活性[4,5]、质量控制[6]进行了研究。但由于受气候条件、地理分布及寄主植物的影响,野生桑黄资源珍稀濒危,桑黄的人工发酵可以较容易地对各种生长影响因素进行控制和优化,获得稳定高产的培养物。为获得桑黄基源菌种培养物替代野生桑黄子实体的潜在价值,探究发酵培养物和子实体之间的共同之处并加以利用,本文对忍冬木层孔菌培养液及其菌丝体中的化学成分进行了研究并对单体化合物的体外抗肿瘤活性进行了测试,以期为桑黄培养物替代子实体来获得相关的活性化合物提供参考。
1 材料与方法
1.1 实验材料
1.1.1 仪器
Bruker 400 MHz核磁共振波谱仪(Bruker公司,瑞士);Finnigin电喷雾质谱仪(Finnigin公司,美国);Waters1525EF(Waters公司,美国)和Dionex Ultimate 3000高效液相色谱仪(戴安公司,美国);制备柱为Cosmosil Packed Column 5C-MS-Ⅱ10ID×250 nm;分析柱为Cosmosil Packed Column 5C-MS-Ⅱ4.6ID×250 nm(Nacalai公司,日本);WZZ-2S数字式自动旋光仪(上海精科实业有限公司);AL204电子天平(梅特勒-托利多仪器上海有限公司,瑞士);U-3010紫外-可见分光光度计(日立仪器(上海)有限公司,日本);N21001型旋转蒸发仪(上海爱朗仪器有限公司)等;柱色谱和薄层色谱用硅胶均为青岛海洋化工厂产品,其他试剂均为分析纯。
1.1.2 菌种及细胞株
实验用忍冬木层孔菌采自湖北宜昌,经中国科学院微生物研究所卯晓岚教授鉴定为忍冬木层孔菌(Phellinuslonicerinus(Bond.) Bond.et Sing),标本及菌种现保存于三峡大学生物与制药学院天然产物研究利用湖北省重点实验室。
胃癌细胞株HGC-27、宫颈癌细胞株HeLa、乳腺癌细胞株MCF-7及子宫内膜癌细胞株RL95-2均购买于中国科学院典型培养物保藏委员会细胞库。
1.2 实验方法
1.2.1 菌种发酵培养
将菌种从4 ℃冰箱中取出于25 ℃恒温培养箱中培养1天后转接至PDA固体平板上,25 ℃恒温培养7天。活化后的菌种长满平板后,用灭菌的打孔器打孔,取菌龄一致的5块菌块接种至液体培养基中(250 mL/500 mL三角瓶),25 ℃、150 rpm恒温震荡培养。培养6天后用匀浆机在超净工作台中匀浆,作为种子培养液以10%接种量接种至新的液体培养基内,28 ℃、150 rpm恒温震荡培养14天。新培养基配方:葡萄糖30 g/L,酵母膏5 g/L,蛋白胨4 g/L,KH2PO42 g/L,MgSO40.75 g/L,VB10.024 475 μg/L。
1.2.2 提取分离
菌株发酵14天后,发酵液经3~4层纱布过滤后除菌丝体,滤液用等体积乙酸乙酯萃取3次,合并有机相,45 °C真空浓缩后得乙酸乙酯萃取物2.5 g。过滤得到的菌丝体经烘箱45 °C干燥后,用适量95%乙醇冷凝回流提取3次,合并乙醇相,真空浓缩后乙酸乙酯萃取,回收溶剂得乙酸乙酯萃取物1.6 g。
发酵液乙酸乙酯萃取物2.5 g,甲醇溶解后,经200~300目正相硅胶柱层析分离,以石油醚-丙酮(100∶0、90∶10、80∶20、75∶25、70∶30、65∶35、60∶40、55∶45、1∶1)梯度洗脱,甲醇冲柱得10个组分(Fr.1~ Fr.10),Fr.3(200 mg)经Sephadex LH-20(氯仿:甲醇=1∶1)凝胶色谱,继而经反相HPLC半制备色谱(30%乙腈-水为流动相),反复纯化得化合物1(22.8 mg)、2(16.3 mg)、3(10.2 mg)、4(5.6 mg)。Fr.4(100 mg)经Sephadex LH-20(氯仿∶甲醇=1∶1)凝胶色谱,继而经硅胶柱色谱,以石油醚-乙酸乙酯(100∶0、90∶10、80∶20、70∶30、60∶40、1∶1)梯度反复纯化得化合物8(10.6 mg)、9(7.8 mg)、10(9.6 mg)。
菌丝体提取物乙酸乙酯萃取物1.6 g,丙酮溶解后,经200~300目正相硅胶柱层析分离,以石油醚-丙酮(100∶0、90∶10、80∶20、70∶30、60∶40、1∶1)梯度洗脱,甲醇冲柱得7个组分(Fr.1~Fr.7),Fr.3(300 mg)经Sephadex LH-20(氯仿∶甲醇=1∶1)凝胶色谱,继而经硅胶柱色谱,以石油醚-乙酸乙酯(100∶0、90∶10、80∶20、70∶30、60∶40、1∶1)梯度反复纯化得化合物5(30.2 mg)、6(11.6 mg)、7(22.3 mg)。
1.2.3 细胞毒活性筛选
用MTT法检测10个化合物对HGC-27、HeLa、MCF-7、RL95-2细胞株的细胞毒活性。从母液开始,依次4倍稀释,共5个梯度,对数生长期的HGC-27、HeLa、MCF-7及RL95-2细胞分别接种于96孔板,每孔100 μL(约1×104个细胞/孔),6 h后加入不同浓度药物100 μL,每一浓度3个重复孔,培养24 h后加入MTT 10 μL(质量浓度为5 mg/mL),继续培养4 h后弃上清,每孔加入二甲基亚砜100 μL后用酶联免疫检测仪测定492 nm处吸光度OD值,计算细胞生长抑制率。细胞生长抑制率=[(对照组平均OD值-实验组平均OD值)/对照组平均OD值]×100%。以浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法计算化合物的IC50值。
2 实验结果
2.1 结构鉴定


图1 化合物1~10的化学结构Fig.1 The chemical structures of compounds 1-10

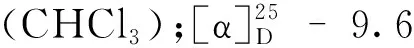


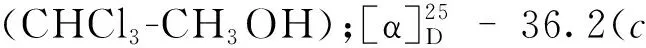

化合物8无色晶体(EtOAc);ESI-MS:m/z137 [M+H]+;1H NMR(400 MHz,CDCl3)δ:7.52(5H,m,H-2,3,4,5,6),3.65(2H,s,H-7);13C NMR(100 MHz,CDCl3)δ:178.4(C-8),133.8(C-1),129.9(C-5),129.2(C-6),129.2(C-3),127.9(C-4),127.9(C-5),41.6(C-7)。以上数据与文献[12]对照基本一致,故确定化合物8为苯乙酸。
化合物9白色结晶(EtOAc);ESI-MS:m/z267 [2M+Na]+;1H NMR(400 MHz,CDCl3)δ:9.88(1H,s,CHO),7.83(2H,d,J= 8.8 Hz,H-2,6),6.96(2H,d,J= 8.8 Hz,H-3,5);13C NMR(100 MHz,CDCl3)δ:191.1(CHO),167.8(C-4),132.5(C-2),132.5(C-6),130.2(C-1),115.9(C-5),115.6(C-3)。以上数据与文献[13]对照基本一致,故确定化合物9为对羟基苯甲醛。
化合物10无色晶体(EtOAc);ESI-MS:m/z151[M-H]-;1H NMR(400 MHz,(CD3)2CO)δ:7.52(2H,m,H-2,6),6.78(2H,s,H-3,5),3.48(2H,s,H-7);13C NMR(100 MHz,(CD3)2CO)δ:172.0(C-8),153.4(C-4),136.5(C-1),129.2(C-2),128.2(C-6),126.4(C-3),126.4(C-5),42.5(C-7)。以上数据与文献[14]对照基本一致,故确定化合物10为4-羟基苯乙酸。
2.2 体外细胞毒活性筛选
对忍冬木层孔菌液体培养物中分离得到化合物1~10进行了肿瘤细胞HGC-27、HeLa、MCF-7、RL95-2的体外细胞毒活性测试。结果显示化合物1~4对HGC-27和RL95-2细胞株有不同程度的抑制活性(见表1),其余化合物浓度为100 μM时对以上四种肿瘤细胞无明显的细胞毒活性,表中未列出。其中化合物3抑制活性最强,进一步复筛结果显示,阳性药顺铂对肿瘤细胞HGC-27、HeLa、MCF-7、RL95-2的IC50分别为15.36、38.36、36.16和1.53 μM;化合物3对HGC-27和RL95-2的IC50分别为6.69、12.81 μM,该化合物对HGC-27的抑制活性优于阳性药。

表1 化合物1~4对HGC-27、Hela、MCF-7及RL95-2的细胞毒活性Table 1 Cytotoxicity of compounds 1-4 on HGC-27,Hela,MCF-7 and RL95-2 cell
3 结论
本研究从忍冬木层孔菌液体培养物中分离得到10个化合物,除化合物5、6和7外,其余7个化合物均为首次从该种真菌中分离得到。化合物5~7为麦角甾醇类化合物,忍冬木层孔菌子实体中也存在大量的麦角甾醇类化合物[15],说明桑黄类真菌菌丝体在甾醇类化合物方面具有代替子实体的可能。化合物1~4为环二肽类成分,有研究报道在桑黄类真菌火木层孔菌的发酵液和菌丝体中分离鉴定了14个该类化合物[16],但在忍冬木层孔菌子实体中只报道过环(亮-缬)二肽成分[15],提示环二肽类成分同时存在于忍冬木层孔菌子实体及发酵培养物中。同时,体外细胞毒活性显示化合物1~4对HGC-27和RL95-2细胞株有不同程度的抑制活性,其中化合物3抑制活性最强,对HGC-27和RL95-2细胞株的IC50分别为6.69 μM和12.81 μM。上述研究说明桑黄基源真菌培养物中代谢产物与子实体具有一些共同的化学成分和药理作用,因此,加大对桑黄基源真菌培养物中有效成分和药理活性的研究,可为桑黄类真菌活性成分的工业化生产及可持续利用提供一个新的解决途径。
