新冠肺炎防疫用医疗器械生产企业80 家检查情况分析
2021-12-13袁兴东吴凡冯正西周宇星吴佩年刘文操
袁兴东,吴凡,冯正西,周宇星,吴佩年,刘文操
江西省药品检查员中心,江西 南昌 330001
近两年,新型冠状病毒(2019-nCoV)引起的群发性肺炎,简称新冠肺炎(novel coronavirus pneumonia,NCP),已成为全球性重大公共卫生事件[1-3],该病作为急性呼吸道传染病已纳入国家乙类传染病,按甲类管理[1]。在国内,疫情目前已得到有效控制,但全球疫情仍持续存在,我国仍然面临疫情传播和扩散的风险,积极组织开展新冠病毒疫苗接种和持续做好个人防护工作仍有必要。为了保障防疫用医疗器械产品的质量,江西省药品检查员中心对辖区内医疗器械生产企业开展了防疫医疗器械专项检查。本文将2021 年期间对80 家新冠肺炎防疫用医疗器械生产企业开展现场监督检查的缺陷项进行汇总分析,为进一步帮扶企业提高产品质量、规范质量管理体系、加强科学监管提供参考。
1 检查基本情况
2021 年3 月至5 月,共派出检查人员219 人次,依据《医疗器械生产质量管理规范》(以下简称《规范》)、“医疗器械生产质量管理规范附录无菌医疗器械”“药品医疗器械飞行检查办法”等文件,对防疫产品医疗器械生产企业开展了专项检查。
1.1 检查类型
在检查的80 家生产企业中,飞行检查20 家,日常通知检查60 家,飞行检查中有4 家是合规检查,16 家是有因飞检。
1.2 检查品种
此次检查涉及三个类别的防疫用医疗器械,分别是口罩、防护服、额温计,共检查的产品数量为175 个,口罩占比91.43%(其中一次性使用医用口罩占45.71%,医用外科口罩占42.29%,医用防护口罩占3.43%),医用一次性防护服占5.71%,红外额温计占2.86%(详见表1)。
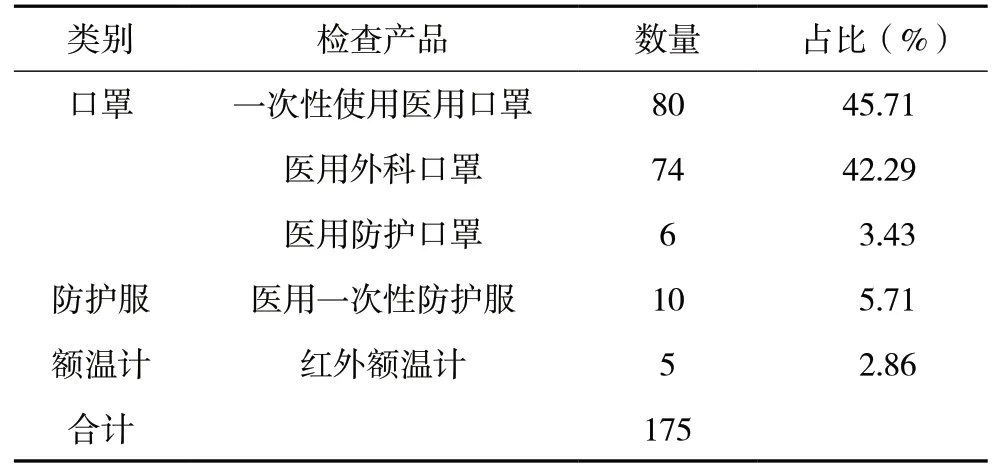
表1 检查品种分布情况
1.3 检查结果
通过检查发现,共有7 家企业因质量管理体系存在严重问题,列了关键不符合项,检查处理建议为“建议停产整改”,占比8.75%;只有一般不符合项的企业66 家,检查处理建议为“建议限期整改”,占比82.50%;检查前主动申请停产的企业7 家,占比8.75%。
2 缺陷项数据分析
2.1 缺陷项数量
73 家在正常生产的企业检查报告共列出缺陷项637 条,平均每家8.7 条,其中关键不符合项20 条,一般不符合项617 条。检查报告所列不符合项最多者14 项,最少者5 项。
2.2 缺陷项归类统计
经对637 条缺陷项分别归类到《规范》的11 个章节,再进行统计分析,缺陷项主要集中在厂房与设施(占比21.19%)、设备(占比19.15%)、生产管理(占比18.21%)、质量控制(占比17.43%)、机构和人员(占比11.30%),上述五章节缺陷项合计占比为87.28%。

图1 缺陷项归类情况
2.3 缺陷项频次统计
缺陷项数量排前五位的章节分别是厂房与设施、设备、生产管理、质量控制、机构和人员,分别将这五个章节缺陷项数量排前三的条款项频次等信息进行统计(详见表2),厂房与设施主要缺陷是仓储区未按要求划分或未按划分区域存放,仓储区温湿度控制和监测设备和洁净区压差计损坏未及时更换也是常见的缺陷。设备章节的主要缺陷是生产设备无状态标识,计量仪器超校准有效期使用和未建立仪器使用维护等记录。生产管理的主要缺陷主要有清场不彻底,半成品无标识,批号标注不符合要求等,其中清场不彻底是所有缺陷项中出现频次最高的,一共出现了37 次。

表2 缺陷项数前五名章节缺陷项频次统计情况
3 存在的主要问题
3.1 企业管理能力不足
缺陷项出现频次最高的前四位分别是清场不彻底、仓储区未划分区域、生产设备无状态标识和仪器超校准有效期使用。从这些缺项可以看出,企业并不是硬件设施不够,而是日常的管理跟不上,导致很多细节不符合《规范》要求。想要避免上述管理缺陷,就需要要求企业加大投入力度,聘请具有与企业规模相适应管理能力的人员,严格培训基础操作人员,抓小抓细,从细节上体现企业的质量管理水平。
3.2 企业检验能力不够
医疗器械生产企业检验能力的质量控制章节缺陷项占比为17.43%,主要问题有不能按《医疗器械工艺用水质量管理指南》[4]等相关要求对纯化水进行检验,不能提供部分成品检验的原始记录或记录不完整。究其原因主要是缺乏具有熟练检验能力的检验人员,部分小企业不愿意在检验方面投入资金,留不住专业的检验人员。部分企业甚至缺乏检验设备,无菌检验实验室未按标准建立无菌室、阳性对照室和微生物限度室。自2011 年国家对微生物检验要求建立“三室”以来[5-6],已经过去10 年了,还有部分企业未按要求建立。
3.3 企业良性运转不多
被检查的80 家生产企业有很多企业不能良性运转,有58 家在被检查期间未组织生产,占比72.50%,其中包括7 家已主动提交停产申请的企业和51 家临时性停产的企业。主要是因为2021 年上半年国内疫情控制良好,防疫用医疗器械需求大幅降低,而前期因为疫情大量资金投入到防疫用医疗器械生产领域,导致产能严重过剩。企业长期停产带来的风险不容小觑,很多企业在获得产品正式注册批件之后从未组织生产,部分企业甚至已经拆除了口罩生产线用于其他产品的生产,前期采购的大量熔喷布等原料也一直积压在原料库中,可能因存放时间过长等原因导致静电吸附能力减弱而导致产品达不到质量标准要求。
4 思考与建议
新冠肺炎疫情的突然来袭,改变了人们的生活,也改变了很多行业,医疗器械领域也不例外。很多企业在疫情的风口下投入大量资金到医疗器械行业,甚至很多其他行业的企业转产到医疗器械生产,这解决了疫情暴发之初防疫用医疗器械短缺的燃眉之急,然而,疫情一定程度缓解后,大量的防疫用医疗器械产能过剩,也将带来严重的后果。很多企业因为投入收不回成本,偷工减料、降低质量标准、压价恶性竞争,扰乱了市场,伤害的是人民的利益。
从防疫用医疗器械生产企业的检查缺陷项来看,主要问题是管理水平和检验能力的问题,说到底,还是资金投入的问题。长期或临时停产的企业在管理水平和质量体系建设方面均存在比较多的问题,检查只能从行为上帮扶企业符合《规范》,如何有序引导、逐步消化产能,是一个重大而且重要的研究课题,要从根本上解决产能过剩问题,让留下的企业能良性运转,才能从根本上保障防疫用医疗器械产品的质量。
