药品上市许可持有人药物警戒外包的风险因素分析
2021-12-10吴其聪刘颖许燕熊慧瑜刘佐仁
吴其聪 刘颖 许燕 熊慧瑜 刘佐仁

中圖分类号 R95 文献标志码 A 文章编号 1001-0408(2021)22-2689-06
DOI 10.6039/j.issn.1001-0408.2021.22.01
摘 要 目的:分析药品上市许可持有人(MAH)药物警戒外包的风险因素并提出风险管控策略,为MAH顺利实施药物警戒外包和监管部门制定相应监管策略提供参考。方法:基于委托-代理理论和头脑风暴法初步确定风险因素,并设计调查问卷,采用随机抽样的方式对广东省内200家MAH的药物警戒工作人员进行问卷调查。采用因子分析法对问卷数据进行统计分析,归纳得出综合性风险因素并计算其评分。结果与结论:共发放调查问卷200份,回收有效问卷154份,问卷有效回收率为77.00%。因子分析结果显示,MAH药物警戒外包活动涉及的综合性风险因素主要有4个,按其影响程度由高到低分别为服务提供商与外包管理因素(3.792分)、MAH因素(3.766分)、法规因素(3.626分)和市场因素(3.610分)。针对上述影响因素,建议MAH在开展药物警戒外包时,应重视完善外包合同、与服务提供商建立信息沟通机制、加强审计与管理工作、强化自身药物警戒能力及人才建设、明确适宜的药物警戒外包业务内容、充分做好对服务提供商的事前调查工作;建议相关部门应尽快制定药物警戒委托质量管理规范或指南,并加强对服务提供商的监管;建议尝试成立药物警戒外包行业协会,并通过充分发挥协会的影响力来规范行业行为,进而避免外包风险的发生。
关键词 药品上市许可持有人;药物警戒外包;风险因素;因子分析
Analysis of Risk Factors of MAH Pharmacovigilance Outsourcing
WU Qicong1,LIU Ying2,XU Yan2,XIONG Huiyu2,LIU Zuoren1,3(1. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. Center for ADR Monitoring of Guangdong, Guangzhou 510080, China; 3. NMPA Key Laboratory for Technology Research and Evaluation of Pharmacovigilance, Guangzhou 510006, China)
ABSTRACT OBJECTIVE: To analyze the risk factors of marketing authorization holder (MAH) pharmacovigilance outsourcing and propose risk management and control strategies, and to provide reference for MAH to successfully implement pharmacovigilance outsourcing and regulatory authorities to formulate corresponding regulatory strategies. METHODS: Based on the principal-agent theory and brainstorming method, the risk factors were preliminarily determined, and a questionnaire was designed. The questionnaire survey was carried out among pharmacovigilance staff of 200 MAH in Guangdong province by random sampling. The factor analysis method was used to statistically analyze the questionnaire data, and the comprehensive risk factors and their respective factor scores were summarized. RESULTS & CONCLUSIONS: A total of 200 questionnaires were distributed, and 154 valid questionnaires were returned, with effective recovery rate of 77.00%. The results of factor analysis method showed that there were 4 comprehensive risk factors involved in MAH pharmacovigilance outsourcing activities, which were service providers and outsourcing management factor (3.792 score), MAH factor (3.766 score), regulations factor (3.626 score) and market factor (3.610 score) from high to low. In view of the above factors, it is suggested that MAH should focus on improving outsourcing contract, establishing information communication mechanism with service providers, strengthening auditing and management, strengthening pharmacovigilance ability and personnel building, defining appropriate pharmacovigilance outsourcing business contents, and fully doing pre-service investigation of service providers, when MAH conducts outsourcing of pharmacovigilance. It is suggested that relevant departments should formulate pharmacovigilance entrusted quality management specifications or guidelines as soon as possible and strengthen the supervision of service providers. It is suggested to try to establish a pharmacovigilance outsourcing industry association, and standardize the industry behavior by giving full play to the influence of the association, so as to avoid the outsourcing risk.
KEYWORDS Marketing authorization holder; Pharmacovi- gilance outsourcing; Risk factors; Factor analysis
2019年新修订的《药品管理法》明确提出我国要“建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制”[1];2020年,国家市场监督管理总局发布的《药品生产监督管理办法》也明确提出:“药品上市许可持有人(MAH)应当建立药物警戒体系,按照国家药品监督管理局制定的药物警戒质量管理规范开展药物警戒工作”[2]。这标志着我国正式开始建立药物警戒制度,并从立法层面明确了MAH应主动承担开展药物警戒活动的责任与义务。然而,对于多数MAH而言,药物警戒工作并非其业务所长;且随着药物警戒工作的不断细化以及相关人力成本的不断增加,MAH的药物警戒部门现有的人员配备已难以满足药物警戒工作的需求。国外学者Stergiopoulos等[3]对部分大型生物制药组织进行的调查显示,将药物警戒工作外包可降低药物警戒操作成本。可以推测,MAH会青睐于将部分药物警戒工作委托给外部专业的药物警戒服务提供商(后文简称“服务提供商”)来完成,但药物警戒外包在具体实施过程当中所带来的风险不容忽视,如服务提供商人员流动率高或水平较低造成的药物警戒工作质量较差等。2021年5月13日,国家药品监督管理局出台的《药物警戒质量管理规范》(GVP)虽然从协议签订、受托方遴选以及定期审计等方面为MAH开展药物警戒外包工作提供了一定的指导[4],但并未对具体操作细节进行规范。因此,为确保我国MAH药物警戒外包活动能够顺利开展,有必要对MAH药物警戒外包的风险因素开展研究。为此,本研究拟在风险因素识别的基础上,对广东省内的MAH药物警戒工作人员进行问卷调查,分析影响MAH药物警戒外包的风险因素并提出风险管控策略,以期为MAH顺利实施药物警戒外包和监管部门制定相应监管策略提供参考。
1 资料与方法
1.1 问卷设计与预调研
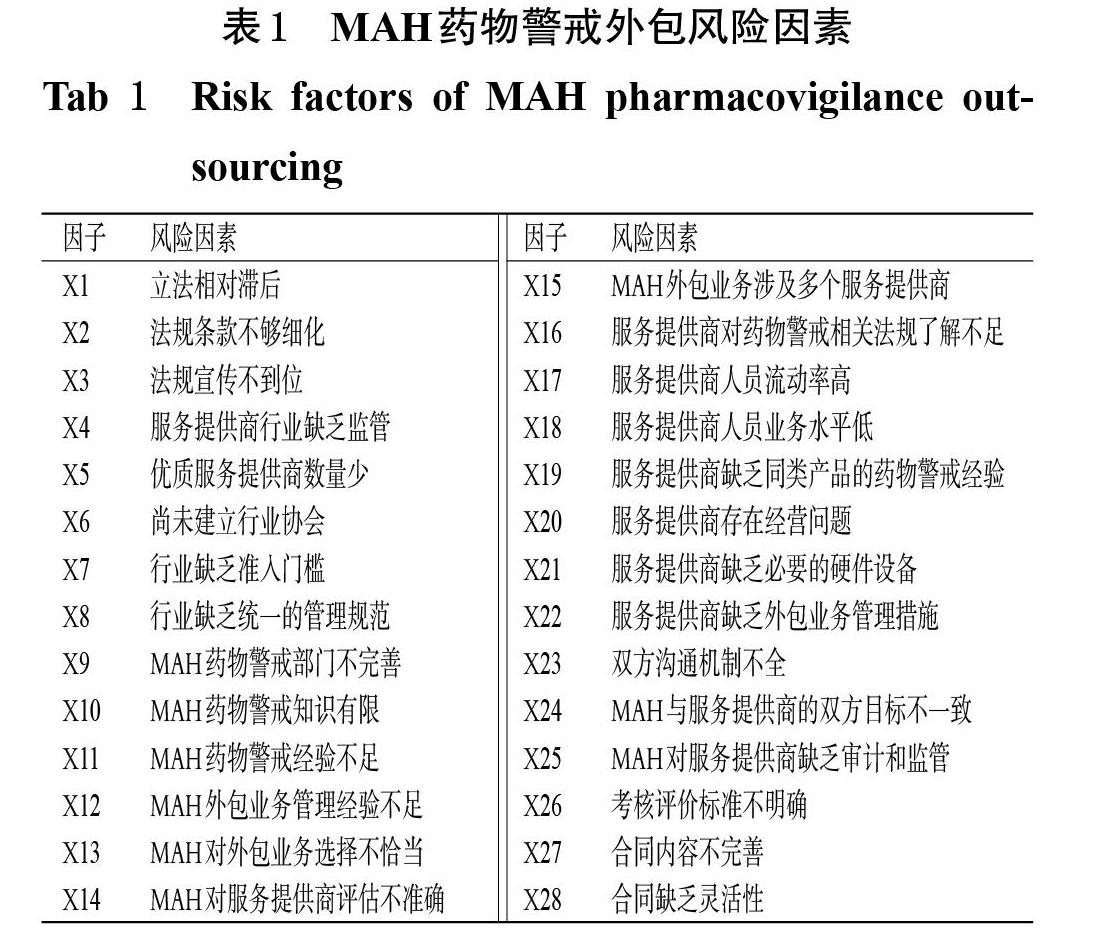
首先,本课题组基于委托-代理理论的5个基本假设[5-6],从理论层面初步识别出16个药物警戒外包的风险因素。其次,邀请13家已经实施了药物警戒外包的MAH药物警戒部门人员参加头脑风暴研讨会,让与会代表结合自身的工作实际从实践层面提出药物警戒外包的风险因素,并对初步识别出来的风险因素进行修正和完善,最终得到28个药物警戒外包风险因素(表1),并据此设计调查问卷。问卷包括调查对象的基本信息和调查对象对MAH药物警戒外包风险因素的影响程度评分两部分,其中影响程度评分采用Likert 5级评分法,按照“影响很大”“影响大”“一般”“影响小”“影响很小”分别评为5、4、3、2、1分。为进一步完善调查问卷并检验问卷信度,本研究在正式调查开始前进行了小范围的预调研(发放并回收有效问卷31份,回收率为100%),问卷整体的Cronbachs α系数为0.881,超过0.800,表明问卷的整体信度非常好[7]。
1.2 问卷调查与数据处理
本课题组采用随机抽样法,通过电子邮件向广东省内的200家MAH药物警戒部门的工作人员发放电子问卷。采用KMO检验和Bartlett球形检验对问卷数据进行适宜性檢验和信度分析;采用SPSS 24.0软件对问卷数据进行因子分析和描述性统计分析。
2 结果
本次调查共发放问卷200份,回收有效问卷154份,问卷有效回收率为77.00%。
2.1 调查对象的基本情况
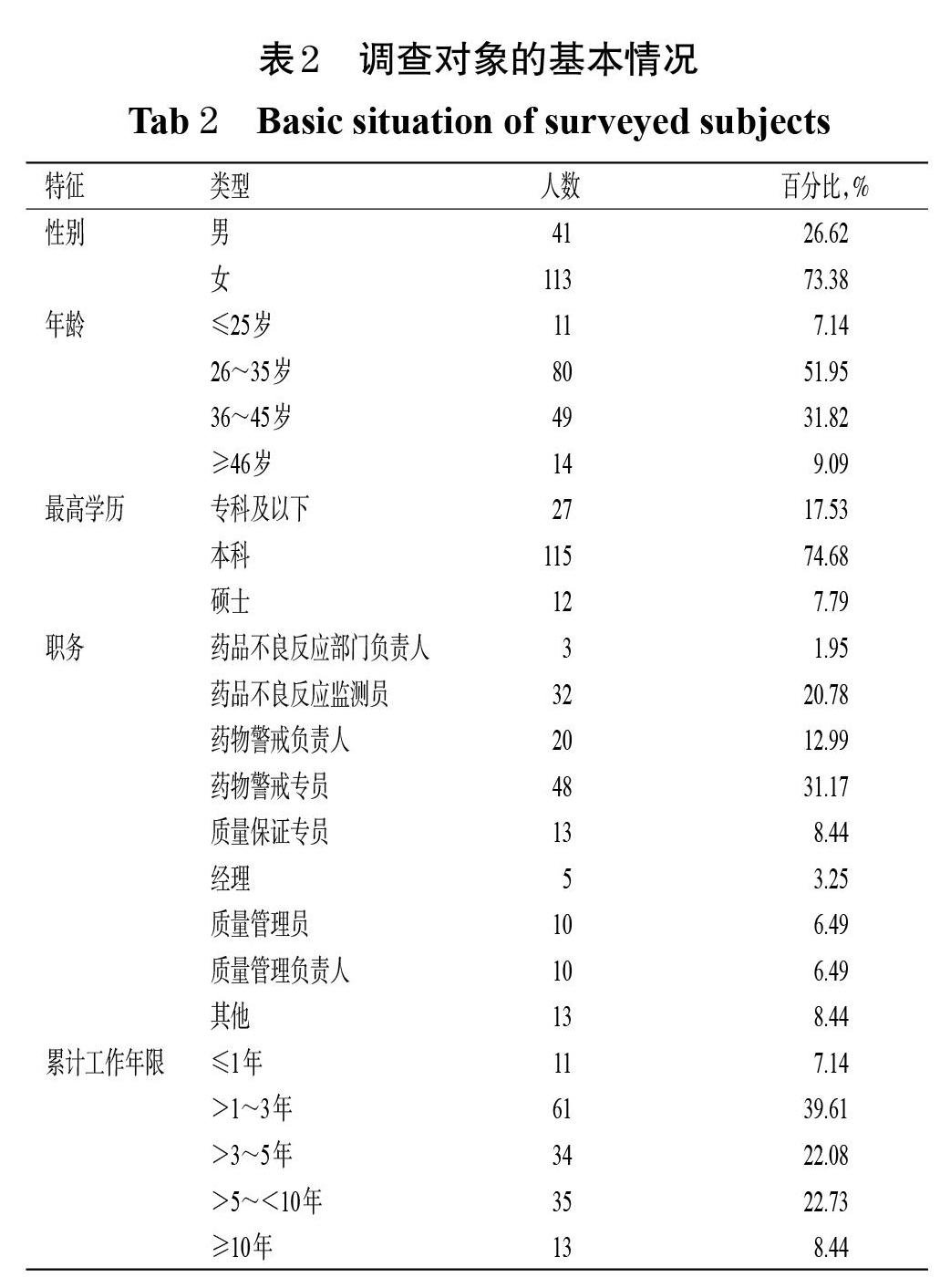
调查对象的基本情况见表2。
2.2 问卷数据检验
采用KMO检验和Bartlett球形检验对问卷数据进行适宜性检验,结果显示,KMO值为0.936;Bartlett球形检验的χ 2值为3 437.089,P<0.001,表明问卷数据适合开展因子分析[8]。
对问卷数据开展信度分析以明确其可靠性。经计算,问卷整体的Cronbachs α系数为0.963;随后逐一去掉某一因子后再计算Cronbachs α系数,结果显示,需删除X6这一因子,最终保留27个因子,此时的Cronbachs α系数为0.964,超过0.900,表明问卷数据的可靠性非常好[9]。
2.3 因子筛选
采用因子分析法对测量因子进行筛选,具体标准如下:(1)单个测量因子不能自成1个提取成分;(2)每个因子在其所属提取成分的载荷量应高于0.5;(3)每个因子在其所属提取成分上的载荷量接近1,而在其他提取成分上的载荷量接近0;(4)如果某个因子在所有提取成分上的载荷量均低于0.5,或者在2个及以上提取成分上的载荷量均高于0.5,则都需要删除该因子[10]。
对问卷数据进行初始因子分析,将其成分矩阵进行旋转,结果显示,因子X4同时在2个提取成分上的载荷量高于0.5;因子X22在所有提取成分上的载荷量均低于0.5。依据上述因子筛选标准,删除X4和X22这两个因子。
2.4 提取公因子
对剩余的25个因子重新开展因子分析,得到相关系数矩阵的特征值与方差贡献率,结果见表3。由表3可见,有4个提取成分的特征值>1,且累计方差贡献率达69.811%,超过60%,表明这4个提取成分能反映25个因子当中的关键信息[11]。
2.5 旋转成分矩阵及提取成分命名
对25个因子的初始载荷矩阵进行旋转,结果见表4。由表4可见,所有因子均仅在1个提取成分上具有高载荷(即载荷量>0.5)。提取成分1(包括X15~X21、X23~X28)主要与服务提供商以及外包管理有关,故将其命名为“服务提供商与外包管理因素”;提取成分2(包括X9~X14)主要与MAH有关,故将其命名为“MAH因素”;提取成分3(包括X1~X3)与法律规范有关,故将其命名为“法规因素”;提取成分4(包括X5、X7~X8)与市场环境有关,故将其命名为“市场因素”。
2.6 提取成分分析
对4个提取成分进行信度分析,并计算其评分均值,以此进一步判断这4个提取成分各自对MAH药物警戒外包的影响程度,结果见表5。由表5可见,4个提取成分的Cronbachs α系数均大于0.800,表明各个提取成分的内部一致性非常好[9]。4个提取成分的评分均值由高到低依次为:服务提供商与外包管理因素(3.792分)、MAH因素(3.766分)、法规因素(3.626分)和市场因素(3.610分)。可见,服务提供商与外包管理因素的得分最高,表示该因素对整个药物警戒外包活动风险的影响程度最大,需要MAH在开展药物警戒外包过程中予以重点关注。进一步分析可知,服务提供商与外包管理因素和MAH因素均属于药物警戒外包活动的内部风险因素,而法规因素和市场因素均属于药物警戒外包活动的外部风险因素,提示对于药物警戒外包而言,内部风险因素的影响程度要大于外部风险因素的影响程度。
3 讨论与建议
由上述分析结果可见,MAH药物警戒外包的风险大小受服务提供商与外包管理因素、MAH因素、法规因素以及市场因素的共同影响,故笔者针对上述风险因素提出相应的风险管控策略。
3.1 服务提供商与外包管理因素
服务提供商与外包管理因素对药物警戒外包风险的影响程度最大,包括合同不完善、双方沟通机制不全、MAH对服务提供商缺乏审计和监管、服务提供商自身能力不足等。基于此,本文提出如下建议:
3.1.1 完善外包合同 在正式签订药物警戒外包合同前,合同双方应当给予部分合同条款留有一定的弹性空间并明确双方的权责。一方面,合同双方应当明确可启动变更程序的基本情况(包括但不限于法律法规及监管文件变更、MAH产品线扩展及上市区域扩大、服务提供商的组织架构变更及服务中断、药物警戒系统更新升级导致的功能及费用变化等),并制定变更条款,以确保合同的灵活性。另一方面,合同双方应将外包业务开展过程的关键步骤进行详细分解,并明确各自的权责。例如,MAH应确保其提供的药物相关资料的真实性;服务提供商应确保其工作按照相关法规及合同要求开展,做好留痕保存工作、数据保密工作以及数据管理工作等。
3.1.2 建立信息沟通机制 MAH与服务提供商之间应建立适宜的沟通机制,加强沟通及信息共享。一方面,在药物警戒外包实施前,双方应当就外包合同当中的委托内容、工作时限、受托单位、对接人以及沟通方式等进行详细沟通,以明确外包的职责、范围与负责人,进一步强化合同的约束力;另一方面,双方应重点就发现药品风险信号、药物警戒质量不达标以及药品监管部门检查等特殊情况制定相应的沟通方案。
3.1.3 加强审计与管理工作 MAH应根据自身的标准操作程序,结合产品风险级别、服务提供商资质以及药物警戒经验等制定详细的药物警戒审计计划。在审计方式上,MAH可视情况采用问卷调查、现场审计等多种适宜的方式;审计内容包括但不限于服务提供商的企业概况、组织架构与人员情况、质量控制体系、药物警戒系统、风险管理系统、数据保护措施等。对于审计缺陷项目,MAH不仅应要求服务提供商做好整改以及反馈工作,还要做好缺项项目的整改追踪记录,及时确认整改的完成情况。
3.2 MAH因素
MAH因素对药物警戒外包风险的影响程度较大,主要包括MAH自身药物警戒能力不足、MAH对外包业务以及服务提供商的选择不恰当等因素。因此,建议MAH要强化自身药物警戒能力及人才建设,明确适宜的药物警戒外包业务内容,并充分做好对服务提供商的事前调查工作,进而有效避免外包风险的发生。
3.2.1 强化自身药物警戒能力及人才建設 首先,MAH应继续严格履行GVP相关法律和规范,提高自身的药物警戒水平;同时,应充分熟悉外包的各项业务,不断积累自身的药物警戒管理经验。其次,MAH应提高药物警戒人才队伍的素质水平并保持人才队伍的稳定性,充分评估服务提供商所需的支持信息,并做好药物警戒的外包审计和管理工作。
3.2.2 明确适宜的药物警戒外包业务内容 MAH应当结合自身药物警戒工作的实际情况,选择适宜的药物警戒外包业务。常见的药物警戒外包业务主要有:药品不良反应案例收集、录入、报告、评价,文献检索、翻译,定期安全性更新报告撰写,药物警戒培训,热线电话管理,药物警戒年度报告撰写等[12]。可以看出,适宜外包的业务主要有两个特征:一是简单且重复性较强;二是具有明确的审核评价标准,有利于MAH衡量外包的质量成果。然而,涉及产品安全要素的登记、风险效益的评估以及风险管理计划的制定等对业务决策有显著影响的关键活动或外包管理工作则不适宜外包[13-14]。
3.2.3 充分做好对服务提供商的事前调查工作 MAH对服务提供商的事前资质调查应当至少涉及如下3个方面:第一,应了解该服务提供商的基本信息情况,包括但不限于其基本情况、行业知名度和信誉度、核心业务人员资质及工作背景、药物警戒业务服务范围及所擅长的药物警戒服务领域等;第二,应了解服务提供商开展药物警戒工作的硬件设施情况,如药物警戒系统简介等;第三,应重点了解服务提供商既往承包过的药物警戒业务情况,如是否有同类产品药物警戒项目执行经验、对该类产品是否足够了解、能否根据药品的安全特性制定出相应的药物警戒计划和方案、能否及时识别药品风险信号等药物警戒能力,以及近年的客户解约情况和公共关系情况等,以明确服务提供商的业务服务能力。
3.3 法规因素
在外部风险因素中,法规因素对药物警戒外包风险的影响程度较大,主要包括GVP相关立法相对滞后、法规条款不够细化等。因此,建议相关部门在细化药物警戒外包相关法规条款的同时,还要进一步借鉴国外发达国家对服务提供商监管的先进经验,及时适应我国MAH药物警戒工作的新形势,规范MAH药物警戒外包工作的开展。
3.3.1 制定药物警戒委托质量管理规范或指南 当前能直接指导药物警戒外包工作开展的法规主要有GVP和《药物警戒委托协议撰写指导原则》[4,15]。两者虽然能从协议签订注意事项、受托方遴选基本要求以及定期审计等方面为药物警戒外包工作提供原则性的指导,但仍需要进一步具体化。因此,建议在上述法规的基础上,进一步制定药物警戒委托质量管理规范或指南,明确MAH遴选服务提供商的基本流程及考察要点、MAH对服务提供商的审计要点、不适宜委托的业务内容、外包合同中应当要求服务提供商承诺的事项等。同时,鉴于可以外包的药物警戒工作繁多,且MAH和服务提供商的特点各不相同、能力参差不齐,因此建议在制定相关管理规范或指南时,应详细说明药物警戒外包原则及主要步骤,而不是描述所有可能的外包任务及具体工作的开展细节[16]。
3.3.2 加强对服务提供商的监管 目前,部分国外发达国家已经开展了对药物警戒外包工作的监管,例如英国药品和健康产品管理局认为,针对服务提供商的药物警戒检查重点应该放在服务提供商对法规及工作流程的理解执行以及对不同MAH所委托的安全性数据进行正确归档这两个要点上[17]。因此,建议我国药品监管部门尝试探索对服务提供商的监管及其药物警戒业务的检查工作,明确检查的侧重点并制定针对服务提供商的管理及检查制度,定期检查服务提供商的专业人员资质、管理制度以及硬件设备等情况,促进其规范开展药物警戒工作。
3.4 市场因素
药物警戒外包属于市场交易行为的一种,因此市场因素对药物警戒外包的风险也具有重要影响,包括优质服务提供商数量少、行业缺乏准入门槛以及缺乏统一的管理规范等3个因素。基于此,笔者建议可尝试通过成立药物警戒外包行业协会并充分发挥协会的影响力来规范行业行为,进而避免外包风险的发生。
行业协会是国家治理体系和治理能力现代化的有机组成部分[18]。通过行业协会来统一规范相应操作,不仅有利于在宏观层面上提高行业自律和管理水平,还可以在学术和产业发展层面上加强交流协作、共同进步[19]。通过外包行业协会来搭建行业内部各服务提供商以及行业内部与MAH的信息沟通交流平台,一方面能够为MAH与服务提供商提供公开、透明的市场信息,另一方面还可以通过开展行业内部的交流活动,为行业内部的各个服务提供商提供良好的经验交流、信息共享平台,以规范行业行为、促进行业健康发展[20]。行业协会可以作为牵头人,推动相关操作指南、标准的出台,规范行业行为,进而能够有效避免不良市场行为的发生[19];同时,行业协会还可以促进行业内监管力度的提升,并对某些服务提供商降低服务质量的行为进行规范,从而确保行业的服务质量水平,以降低药物警戒外包的风险、推动药物警戒外包工作的顺利开展。
4 结语
本研究基于委托-代理理论和头脑风暴法创造性地识别出了28个药物警戒外包风险因素,并对广东省内的MAH药物警戒工作人员进行了问卷调查,找出了4个影响药物警戒外包的关键风险因素,即服务提供商与外包管理因素、MAH因素、法规因素以及市场因素等。该研究一方面可为MAH药物警戒外包工作的顺利开展提供参考,另一方面也能为相关部门的政策优化提供依据。
参考文献
[ 1 ] 全国人民代表大会.中华人民共和国药品管理法[EB/OL].(2019-08-26)[2021-04-23]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm.
[ 2 ] 国家市场监督管理总局.药品生产监督管理办法:国家市场监督管理总局令第28号[EB/OL].(2020-03-30)[2021-
04-23]. https://www.nmpa.gov.cn/yaopin/ypfgwj/ypfgbmgzh/20200330182901110.html.
[ 3 ] STERGIOPOULOS S,FEHRLE M,CAUBEL P,et al. Adverse drug reaction case safety practices in large biopharmaceutical organizations from 2007 to 2017:an indu- stry survey[J]. Pharmaceut Med,2019,33(6):499-510.
[ 4 ] 国家药品监督管理局.国家药监局关于发布《药物警戒质量管理规范》的公告:2021年 第65号[EB/OL].(2021-05-13)
[2021-05-31]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html.
[ 5 ] 李善良.供应链委托代理问题分析[D].上海:复旦大学,2005.
[ 6 ] 庞永红.委托代理理论的伦理考量[J].苏州科技学院学报(社会科学版),2006,23(3):46-51.
[ 7 ] 曾五一,黄炳艺.调查问卷的可信度和有效度分析[J].统计与信息论坛,2005(6):13-17.
[ 8 ] 牛建军,耿岳.普通高校公体课探究式教学评价指标体系构建:基于因子分析法的应用研究[J].体育科学研究,2016,20(6):73-76,92.
[ 9 ] 徐蓓雯.招聘流程外包风险影响因素研究[D].徐州:中国矿业大学,2015.
[10] 刘瑛,互联网健康传播:理论建构与实证研究[M].武汉:华中科技大学出版社,2013:106-121.
[11] 杨学军,曾国军.影响服务外包承接地竞争力的因子分析:基于示范城市软件外包企业的问卷调查[J].科技管理研究,2011,31(20):112-115,127.
[12] 高千秋,张浩嘉.欧盟药品上市许可持有人的药物警戒责任研究[J].中国药物评价,2019,36(1):77-80.
[13] LELE C. A successful path to fulfilling pharmacovigilance obligations[J]. Manuf Chemist,2013,84(7/8):24-26.
[14] 刘丽丽.国外药品上市许可持有人委托开展药物警戒监管对我国的启示[J].中国药物警戒,2020,17(11):773-776.
[15] 国家药品监督管理局药品评价中心.关于发布药物警戒委托协议撰写指导原则(试行)的通知[EB/OL].(2020-06-04)
[2021-05-01]. http://www.cdr-adr.org.cn/drug_1/zcfg_1/zcfg_zdyz/202006/t20200604_47472.html.
[16] VAN LEEUWEN B,EDWARDS B. The road to pharmacovigilance outsourcing guidance[J]. Ther Innov Regul Sci,2020,55(2):408-414.
[17] Medicines and Healthcare Products Regulatory Agency.Service provider inspections[EB/OL].(2019-10-09)[2020-
04-21]. https://www.gov.uk/guidance/good-pharmacovigilance-practice-gpvp.
[18] 楊盛峰.培育发展行业协会商会要把握好“三个关系”[N].定西日报,2021-03-25(003).
[19] 郑航,蒋君好,严波.重庆市医药研发外包服务产业发展现状与提升路径研究[J].中国处方药,2020,18(10):31-33.
[20] 刘凯鑫,杨铮.建立档案外包行业协会必要性探析[J].北京档案,2020(2):34-36.
(收稿日期:2021-05-12 修回日期:2021-10-18)
(编辑:孙 冰)
