HPLC-QAMS法同时测定榆槐片中11种有效成分的含量
2021-12-10迟静毕夏刘志民刘德军
迟静 毕夏 刘志民 刘德军

中圖分类号 R944.2+7;R927.2 文献标志码 A 文章编号 1001-0408(2021)22-2713-07
DOI 10.6039/j.issn.1001-0408.2021.22.05
摘 要 目的:建立同时测定榆槐片中栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷等11种有效成分含量的方法。方法:采用高效液相色谱-一测多评(HPLC-QAMS)法。以Agilent TC-C18为色谱柱,以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速为1.0 mL/min,柱温为30 ℃,检测波长为238 nm(栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷和栀子苷)、203 nm(地榆皂苷Ⅰ和地榆皂苷Ⅱ)、283 nm(芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷)。以栀子苷为内参物,计算其余10种成分相对于该成分的相对校正因子,从而计算10批样品中各成分的含量,并与外标法所得结果进行比较。结果:栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷检测质量浓度的线性范围分别为0.87~43.50、1.99~99.50、4.06~203.00、7.35~367.50、12.97~648.50、28.98~1 449.00、3.79~189.50、1.57~78.50、18.05~902.50、0.66~33.00和14.38~719.00 μg/mL(r均大于0.999 0),精密度、重复性、稳定性(24 h)试验的RSD均小于2%(n=6),平均加样回收率为96.90%~100.10%,RSD为0.67%~1.74%(n=9)。HPLC-QAMS法与外标法所测得的10批榆槐片中栀子新苷等10种有效成分的含量比较,差异均无统计学意义(P>0.05)。结论:本研究所建立的HPLC-QMAS法操作简便、结果准确,可用于榆槐片中栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷含量的同时测定。
关键词 榆槐片;高效液相色谱-一测多评法;多指标成分;相对校正因子;含量
Simultaneous Determination of 11 Active Components in Yuhuai Tablets by HPLC-QAMS
CHI Jing1,BI Xia2,LIU Zhimin3,LIU Dejun1(1. Preparation Center, the Third Affiliated Hospital of Liaoning University of TCM, Shenyang 110003, China; 2. Dept. of Clinical Pharmacy, the Third Affiliated Hospital of Liaoning University of TCM, Shenyang 110003, China; 3. Northeast Pharmaceutical Group Co., Ltd., Shenyang 110026, China)
ABSTRACT OBJECTIVE:To establish the method for simultaneous determination of 11 active components in Yuhuai tablets,such as gardoside,shanzhiside,gardenoside,genipin 1-gentiobioside,geniposide,ziyuglycoside Ⅰ,ziyuglycoside Ⅱ,narirutin,naringin,hesperidin and neohesperidin. METHODS:HPLC-QAMS method was adopted. The determination was performed on Agilent TC-C18 column (250 mm×4.6 mm,5 μm) with mobile phase consisted of acetonitrile(A)-0.1% phosphoric acid solution(B) (gradient elution) at the flow rate of 1.0 mL/min. The column temperature was set at 30 ℃. The detection wavelengths were set at 238 nm for gardoside,shanzhiside,gardenoside,genipin 1-gentiobioside and geniposide,203 nm for ziyuglycoside Ⅰ and ziyuglycoside Ⅱ,and 283 nm for narirutin,naringin,hesperidin and neohesperidin. Using geniposide as an internal reference,the relative correction factors of other 10 components relative to this component were calculated,and the contents of each component in 10 batches of samples were calculated. The results obtained by HPLC-QAMS method were compared with those obtained by external standard method. RESULTS: The linear ranges of gardoside,shanzhiside,gardenoside,genipin 1-gentiobioside,geniposide,ziyuglycoside Ⅰ,ziyuglycoside Ⅱ,narirutin,naringin,hesperidin and neohesperidin were 0.87-43.50,1.99-99.50,4.06-203.00,7.35-367.50,12.97-648.50,28.98-1 449.00,3.79-189.50,1.57-78.50,18.05-902.50,0.66-33.00 and 14.38-719.00 μg/mL(all r>0.999 0). RSDs of precision,repeatability and stability (24 h) tests were all less than 2%(n=6). The average recoveries were 96.90%-100.10%, and RSDs were 0.67%-1.74%(n=9). There was no significant difference in the contents of 10 active components as gardoside between HPLC-QAMS method and external standard method in 10 batches of Yuhuai tablets(P>0.05). CONCLUSIONS: The HPLC-QMAS method established in this study is convenient and accurate. It can be used for the simultaneous determination of gardoside,shanzhiside,gardenoside,genipin 1-gentiobioside,geniposide,ziyuglycoside Ⅰ,ziyuglycoside Ⅱ,narirutin,naringin,hesperidin and neohesperidin in Yuhuai tablets.
KEYWORDS Yuhuai tablets; HPLC-QAMS; Multi-index component; Relative correction factor; Content
榆槐片由地榆、槐花、黄芩、牡丹皮、栀子、枳壳和甘草加工而成,具有清热燥湿、凉血止血的功效,主要用于治疗具有肛门肿痛、出血、脱垂等症状的内外痔[1]。榆槐片方中地榆可凉血止血、解毒敛疮,槐花可凉血止血、清肝泻火,黄芩可清热燥湿、泻火解毒,三者合为君药;牡丹皮能清热凉血、活血化瘀,栀子能泻火利湿、凉血解毒,二者共为臣药;枳壳能理气宽中、行滞消胀,是为佐药;甘草可清热解毒、缓急止痛,是为使药[2]。该药成分众多,但目前相关国家药品标准仅以牡丹皮中的芍药苷含量作为其质控指标[3],难以体现该药的内在整体质量。
传统的多指标定量控制方法可能会因为某些对照品不易获取或成本太高而无法得以广泛应用,而高效液相色谱-一测多评(HPLC-QAMS)法选取易得、价廉的单一对照品作为内参物,通过相对校正因子计算其他成分的含量,可实现对多种成分的同步定量检测,大大降低了检验成本。鉴于此,本研究以榆槐片方中君药之一地榆所含的代表性成分地榆皂苷Ⅰ、地榆皂苷Ⅱ,臣药之一栀子的主要活性成分栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷,以及佐药枳壳的主要活性成分芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷作为指标[4-6],选取质量稳定、价廉易得的栀子苷作为内参物,采用HPLC-QAMS法同时测定该药中上述11种成分的含量,并与外标法检测结果进行比较,以期为该药质量标准的提升提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括1200型高效液相色谱(HPLC)仪及配备的可变波长紫外检测器、四元泵、真空脱气机、柱温箱、自动进样器和ChemStation工作站(美国Agilent公司),2695型HPLC仪及配备的紫外-可见光检测器、四元泵、在线脱气机、自动进样器、柱温箱和Empower 3工作站(美國Waters公司),CPA225D型电子分析天平(精度为0.01 mg,德国Sartorius公司),CH-250型超声波清洗器(北京创新德超声电子研究所)等。
1.2 主要药品与试剂
本研究所用的主要药品与试剂包括榆槐片(太极集团重庆桐君阁药厂有限公司,规格为每片0.45 g,批号分别为19080016、19120026、20060014、20080011、20090010、20090015、20100008、20110012、20110016、20120003,依次编号为S1~S10),栀子苷、柚皮苷、橙皮苷、新橙皮苷对照品(中国食品药品检定研究院,批号分别为110749- 201919、110722-201815、110721-202019、111857-201804,纯度依次为97.1%、91.7%、95.3%、99.4%),栀子新苷对照品(武汉天植生物技术有限公司,批号CFS201901,纯度98.0%),山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷对照品(成都普瑞法科技开发有限公司,批号分别为PRF9071641、PRF9040843、PRF9051521、PRF8060821、PRF8060201、PRF9062802,纯度依次为97.7%、99.3%、98.9%、98.7%、98.0%、99.8%);乙腈为色谱纯,其余试剂均为分析纯,水为纯净水。
2 方法与结果
2.1 溶液的制备
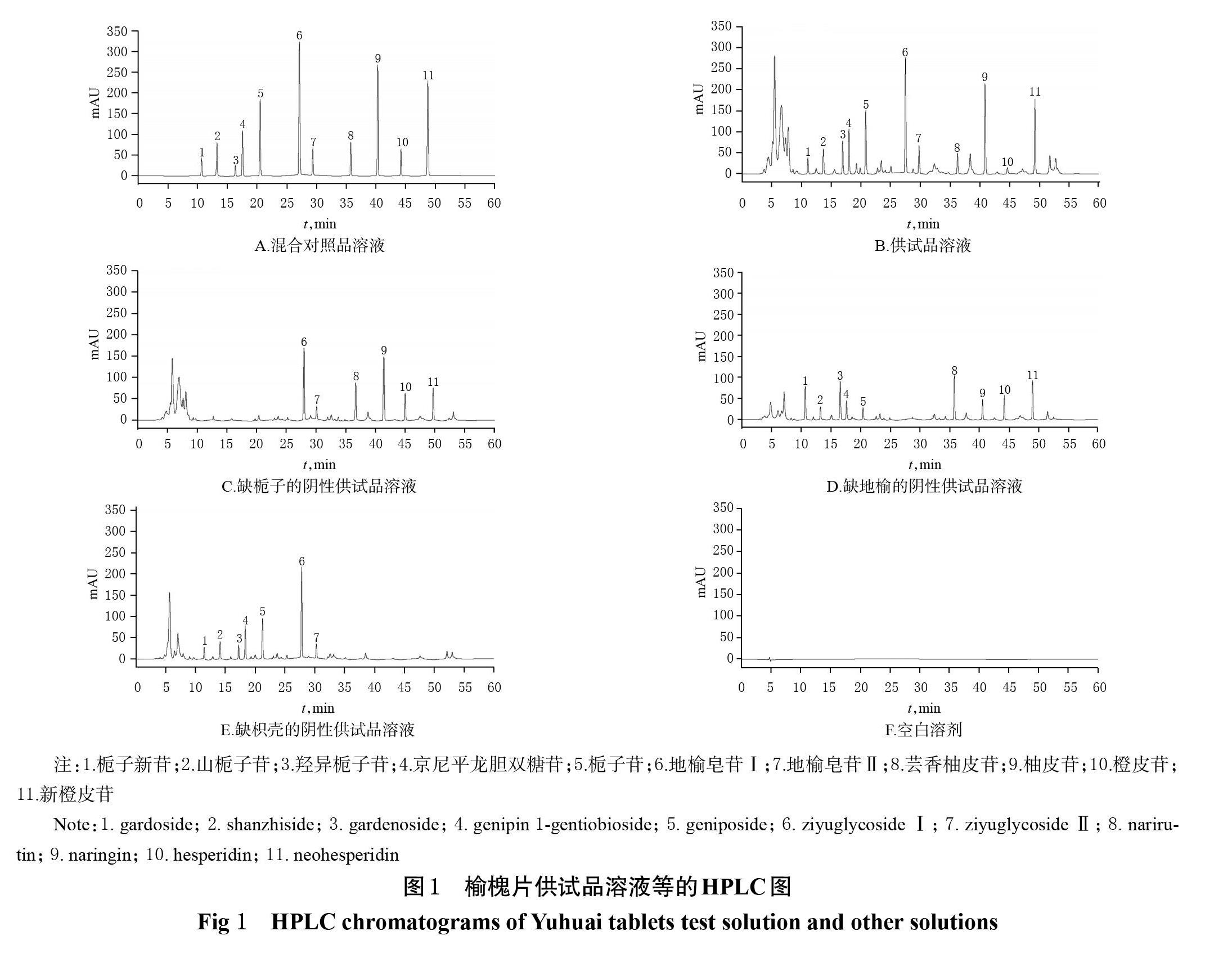
2.1.1 混合对照品溶液 精密称取栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷对照品各适量,用甲醇溶解、稀释,制得每1 mL含栀子新苷0.174 mg、山栀子苷0.398 mg、羟异栀子苷0.812 mg、京尼平龙胆双糖苷1.470 mg、栀子苷2.594 mg、地榆皂苷Ⅰ5.796 mg、地榆皂苷Ⅱ0.758 mg、芸香柚皮苷0.314 mg、柚皮苷3.610 mg、橙皮苷0.132 mg和新橙皮苷2.876 mg的混合对照品贮备液。精密吸取该混合对照品贮备液1.0 mL,置于20 mL量瓶中,用甲醇定容,摇匀,制得上述成分质量浓度依次为0.008 7、0.019 9、0.040 6、0.073 5、0.129 7、0.289 8、0.037 9、0.015 7、0.180 5、0.006 6和0.143 8 mg/mL的混合对照品溶液。
2.1.2 供试品溶液 取榆槐片适量,研成细粉,精密称定1.0 g,置于25 mL量瓶中,加入甲醇20 mL,超声(功率250 W,频率40 kHz)处理30 min,放冷,用甲醇定容,摇匀,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.3 阴性供试品溶液和空白溶剂 按照榆槐片质量标准中的处方和制备方法分别制得缺少栀子、地榆、枳壳的阴性样品[3],再按“2.1.2”项下方法制得相应的阴性供试品溶液。另取甲醇,作为空白溶剂。
2.1.4 加样回收混合对照品溶液 精密称取栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷对照品各适量,用甲醇溶解、稀释,制得上述成分质量浓度依次为0.115、0.269、0.451、0.845、1.431、3.472、0.398、0.185、2.023、0.091和1.587 mg/mL的加样回收混合对照品溶液。
2.2 色谱条件
以Agilent TC-C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~9 min,18.0%A;9~23 min,18.0%A→32.0%A;23~32 min,32.0%A→65.0%A;32~52 min,65.0%A→80.0%A;52~60 min,80.0%A→18.0%A);流速为1.0 mL/min;柱温为30 ℃;检测波长为238 nm(0~23 min,测定栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷)[7-8]、203 nm(23~32 min,测定地榆皂苷Ⅰ、地榆皂苷Ⅱ)[9]、283 nm(32~60 min,测定芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷)[10-11];进样量为10 ?L。
2.3 系统适用性试验
精密吸取“2.1”项下混合对照品溶液、供试品溶液、阴性供试品溶液和空白溶剂各适量,按“2.2”项下色谱条件进样测定,记录色谱图(图1)。结果显示,供试品溶液中栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷与相邻色谱峰间的分离度均大于1.5,理论板数均大于5 000,阴性供试品溶液和空白溶剂均不干扰待测成分的检测。
2.4 线性关系考察
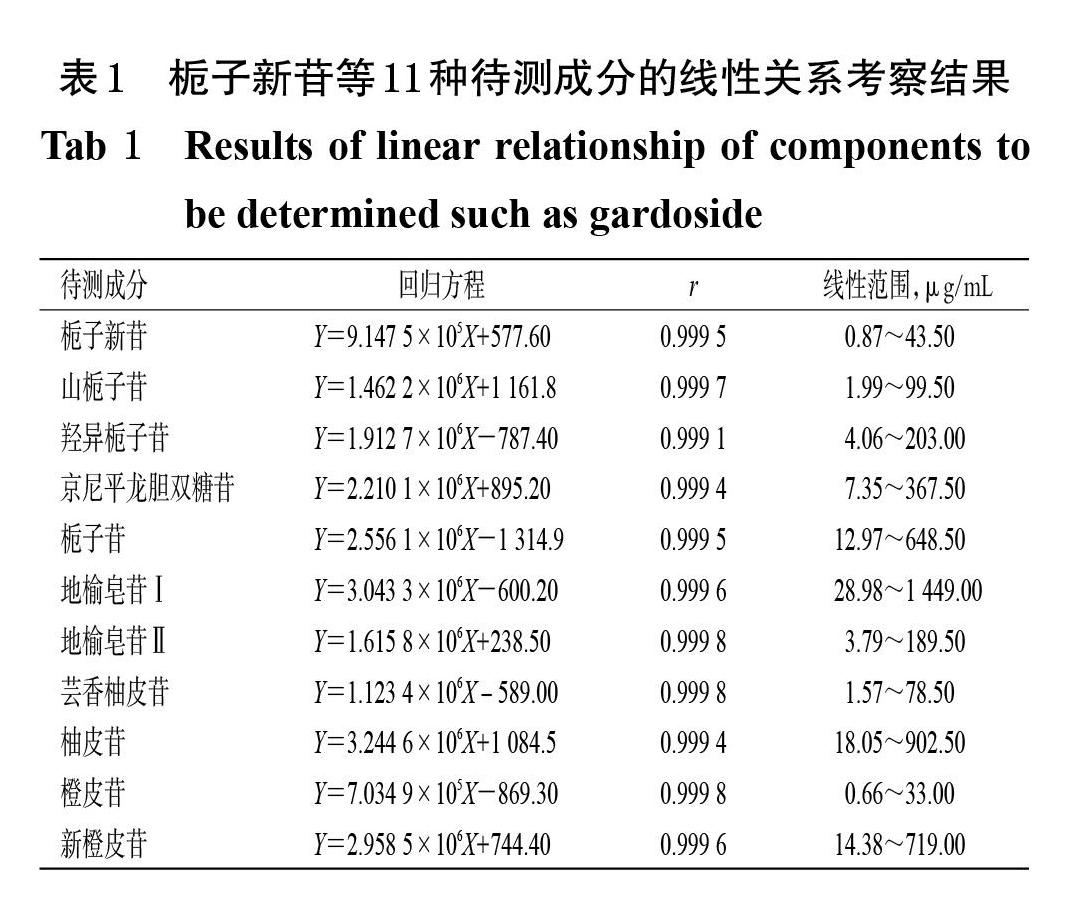
精密吸取混合对照品贮备液0.1、0.2、0.5、1.0、2.0、5.0 mL,分别用甲醇释释并定容至20 mL,摇匀,制得不同质量浓度的系列混合对照品溶液Ⅰ~Ⅵ,按“2.2”项下色谱条件进样测定,记录峰面积。以栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷的峰面积(Y)为纵坐标、其质量浓度(X)为横坐标进行线性关系考察,结果如表1所示。
2.5 精密度试验
精密吸取“2.1.1”项下混合对照品溶液适量,按“2.2”项下色谱条件连续进样测定6次,记录峰面积。结果显示,栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷峰面积的RSD分别为1.27%、1.06%、0.99%、0.71%、0.60%、0.53%、1.02%、1.13%、0.66%、1.31%和0.59%(n=6),表明仪器精密度良好。
2.6 重复性试验
取榆槐片(批号19080016)适量,共6份,分别按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积并按外标法计算各待测成分的含量。结果显示,栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、蕓香柚皮苷、柚皮苷、橙皮苷和新橙皮苷含量的RSD分别为1.82%、1.76%、1.29%、1.33%、0.90%、0.83%、1.12%、1.66%、1.01%、1.87%和1.05%(n=6),表明本方法重复性良好。
2.7 稳定性试验
取榆槐片(批号19080016)供试品溶液适量,分别于室温条件下放置0、2、5、9、16、24 h时按“2.2”项下色谱条件进样测定,记录峰面积。结果显示,栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷峰面积的RSD分别为1.33%、1.15%、1.07%、0.83%、0.68%、0.59%、1.14%、1.20%、0.72%、1.35%和0.71%(n=6),表明榆槐片供试品溶液在室温条件下放置24 h内稳定性良好。
2.8 加样回收率试验
取已知栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷含量的榆槐片(批号19080016)共9份,研细,精密称取细粉0.5 g,平行3组,每组精密加入“2.1.4”项下加样回收混合对照品溶液0.8、1.0、1.2 mL,按“2.1.2”项下方法制备加样回收供试品溶液,再按“2.2”项下色谱条件进样测定,计算加样回收率。结果显示,上述11种待测成分的平均加样回收率分别为99.05%、97.50%、98.85%、100.10%、99.76%、99.83%、96.90%、98.60%、100.04%、96.96%、99.09%,RSD分别为0.87%、1.74%、1.18%、0.73%、0.67%、0.76%、1.27%、0.93%、0.82%、1.24%、1.46%(n=9),表明本方法准确度良好。
2.9 相对校正因子计算及耐用性考察
2.9.1 相对校正因子计算 精密吸取“2.4”项下系列混合对照品溶液Ⅰ~Ⅵ各适量,分别按“2.2”项下色谱条件进样测定,记录峰面积。以栀子苷为内参物,计算栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷、新橙皮苷相对于栀子苷的相对校正因子(fk/s):fk/s=fk/fs=(ck×As)/(cs×Ak)。式中,f、c和A分别代表相对校正因子、成分质量浓度和峰面积,下标k和s分别代表待测成分和内参物。相对校正因子的计算结果如表2所示。
2.9.2 不同仪器、色谱柱对相对校正因子的影响 选用不同HPLC仪(Agilent 1200型、Waters 2695型HPLC仪)和不同色谱柱(Agilent TC-C18、Capcell C18、Kromasil C18,规格均为250 mm×4.6 mm,5 μm),其余条件同“2.2”项,精密吸取“2.1.1”项下混合对照品溶液适量,进样测定并记录栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷的峰面积,按“2.9.1”项下方法计算上述各待测成分(栀子苷除外)的相对校正因子,结果如表3所示。由表3可知,栀子新苷等10种待测成分相对校正因子的RSD为0.53%~1.89%(n=6),表明不同仪器及色谱柱对相对校正因子的计算结果无显著影响。
2.9.3 不同流速对相对校正因子的影响 选用不同流速(0.8、0.9、1.0、1.1、1.2 mL/min),其余条件同“2.2”项,精密吸取“2.1.1”项下混合对照品溶液适量,进样测定并记录栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷的峰面积,按“2.9.1”项下方法计算上述各待测成分(栀子苷除外)的相对校正因子,结果如表4所示。由表4可知,栀子新苷等10种待测成分相对校正因子的RSD为0.80%~1.88%(n=5),表明不同流速对相对校正因子的计算结果无显著影响。
2.9.4 不同柱温对相对校正因子的影响 选用不同柱温(28、29、30、31、32 ℃),其余条件同“2.2”项,精密吸取“2.1.1”项下混合对照品溶液适量,进样测定并记录栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷的峰面积,按“2.9.1”项下方法计算上述各待测成分(栀子苷除外)的相对校正因子,结果如表5所示。由表5可知,栀子新苷等10种待测成分相对校正因子的RSD为0.52%~1.84%(n=5),表明不同柱温对相对校正因子的计算结果无显著影响。
2.10 目标色谱峰的定位
选用不同HPLC仪(Agilent 1200型、Waters 2695型HPLC仪)和不同色谱柱(Agilent TC-C18、Capcell C18、Kromasil C18,规格均为250 mm×4.6 mm,5 μm),其余条件同“2.2”项,精密吸取“2.1.1”项下混合对照品溶液适量,进样测定并记录栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷的色谱峰保留时间,采用相對保留时间法对目标色谱峰(栀子苷除外)进行定位,结果如表6所示。由表6可知,栀子新苷等10种待测成分相对保留时间的RSD为0.65%~1.59%(n=6),表明采用相对保留时间法能够对目标色谱峰进行准确定位。
2.11 样品含量测定及结果比较
取10批榆槐片,每批平行3份,分别按“2.1.2”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,采用外标法计算样品中上述11种有效成分的含量;同时,以栀子苷为内参物,按“2.9.1”项下方法计算其余10种成分的相对校正因子并采用QAMS法计算成分含量。采用SPSS 26.0统计软件对两种方法所得结果进行t检验(检验水准α=0.05),结果如表7所示。由表7可知,采用HPLC-QAMS法所得栀子新苷等10种有效成分的平均含量与外标法所得平均含量比较,差异均无统计学意义(P>0.05)。
3 讨论
3.1 供试品溶液制备方法的选择
本研究在制备榆槐片供试品溶液时,以栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷含量之和较高且单个成分含量要高于其平均值的综合提取效果为指标,同时考虑杂质干扰等影响因素,分别考察了以不同体积分数(50%、60%、100%)的甲醇和不同体积分数(70%、100%)的乙醇为溶媒[5-11],以及超声提取和加热回流提取两种提取方式的效果,发现以甲醇为溶媒进行超声提取的效果较好。随后,本研究对提取时间20、30、45、60 min进行优化,最终筛选出以甲醇超声提取30 min为供试品溶液的制备方法。
3.2 色谱条件的优化
在筛选流动相时,本研究考察了乙腈-水、乙腈-磷酸溶液、乙腈-甲酸溶液和乙腈-冰醋酸溶液等4个流动相体系[4-5,7,11-13],综合基线噪音、分离度、目标成分灵敏度、检测用时等情况,发现以乙腈-水、乙腈-甲酸溶液和乙腈-冰醋酸溶液为流动相时,所得色谱峰均出现不同程度的拖尾和变形现象,仅乙腈-磷酸溶液能满足检测要求;再经过对磷酸溶液有机相、水相比例的摸索,最终确定以乙腈-0.1%磷酸溶液为流动相,按“2.2”项下色谱条件进行梯度洗脱。同时,本研究参考文献[6-14]对色谱柱类型(C18柱和C8柱)进行了筛选,结果发现C18色谱柱的分离效果较佳;随后对色谱柱(Agilent TC-C18、Capcell C18和Kromasil C18)、柱温(28、29、30、31、32 ℃)、流速(0.8、0.9、1.0、1.1、1.2 mL/min)进行了考察,发现上述3种色谱柱均能满足检测要求,且柱温和流速对检测结果的影响不大。综合色谱峰峰形、理论板数、分离度、色谱响应值等因素分析,最终选择色谱柱为Agilent TC-C18(250 mm×4.6 mm,5 μm)、柱温为30 ℃、流速为1.0 mL/min。
3.3 两种检测方法的比较
由表7可知,经t检验分析,采用HPLC-QAMS法和外标法所测得的榆槐片中栀子新苷等10种有效成分的含量比较,差异均无统计学意义(P>0.05);但HPLC- QAMS法的操作更简便、成本更低廉,更具有优势。
综上所述,本研究所建立的HPLC-QMAS法操作简便、结果准确,有效地降低了检验成本,可用于榆槐片中栀子新苷、山栀子苷、羟异栀子苷、京尼平龙胆双糖苷、栀子苷、地榆皂苷Ⅰ、地榆皂苷Ⅱ、芸香柚皮苷、柚皮苷、橙皮苷和新橙皮苷含量的同时测定,可为该药的多指标质量评价提供实验依据。
参考文献
[ 1 ] 陈辉.榆槐片配合熏洗法治疗痔疮50例[J].中国中医药现代远程教育,2009,7(11):101.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:88-89,130-131,179-180,257-260,314-315,370.
[ 3 ] 国家药品监督管理局.国家药品标准:WS-10932(ZD-0932)-
2002-2012Z[S/OL]. [2012-09-27]. https://www.dayi.org. cn/
drug/1019137.
[ 4 ] 王雪,戴衍朋,徐波,等.不同产地地榆饮片中地榆皂苷Ⅰ和地榆皂苷Ⅱ的含量测定及比较分析[J].中南药学,2018,16(3):400-404.
[ 5 ] 吴亚超,杨文静,张磊,等.栀子中栀子苷等7个化学成分测定及质量评价[J].中国药学杂志,2016,51(10):841- 847.
[ 6 ] 田芳,何小芳,谭梓君,等.枳壳HPLC特征图谱及6个黄酮苷类成分含量测定[J].中草药,2020,40(6):1090- 1096.
[ 7 ] 黄跃前,程学仁,吴文平,等.基于指纹图谱与多元统计分析的栀子不同炮制品评价[J].广东药科大学学报,2020,36(6):765-770.
[ 8 ] 付小梅,杨超,吴志瑰,等.不同采收期栀子中8个有效成分含量动态变化与颜色的相关性研究[J].中国中药杂志,2020,45(13):3191-3202.
[ 9 ] 范奎,代良敏,熊永爱,等. HPLC-ELSD法测定地榆总皂苷中地榆皂苷-Ⅰ和地榆皂苷-Ⅱ的含量[J].中华中医药杂志,2017,32(6):2639-2642.
[10] 刘姗姗,蒋波,石雨荷,等. HPLC法同时测定湘产枳壳中5种成分含量的研究[J].湖南中医杂志,2019,35(5):143-146.
[11] 田芳,谭梓君,何小芳,等.枳壳饮片标准汤剂质量评价研究[J].中国现代应用药学,2021,38(1):42-48.
[12] 冯敬骞,胡卫南,徐礼萍,等. HPLC法同时测定不同采集地衢枳壳中12种黄酮类成分的含量[J].中国药房,2020,31(5):571-575.
[13] 靳贝贝,裴香萍,梁惠珍.青皮药材的HPLC指纹图谱建立及聚类分析和主成分分析[J].中国药房,2018,29(24):3336-3339.
[14] 唐俊,张杰,孙伟,等. LC-MS/MS法同时测定大鼠血浆中地榆皂苷Ⅰ和地榆皂苷Ⅱ的血药浓度及其药代动力学[J].生物加工过程,2019,17(5):536-541.
(收稿日期:2021-05-08 修回日期:2021-10-07)
(编辑:胡晓霖)
