LC-MS/MS法测定大鼠血浆中芦荟苦素浓度及其药动学研究
2021-12-10谭银丰孙墨箫张蕾杨雯悦李海龙李友宾
谭银丰 孙墨箫 张蕾 杨雯悦 李海龙 李友宾

中圖分类号 R969.1 文献标志码 A 文章编号 1001-0408(2021)22-2701-05
DOI 10.6039/j.issn.1001-0408.2021.22.03
摘 要 目的:建立测定大鼠血浆中芦荟苦素浓度的方法,并考察芦荟苦素的药动学特征。方法:血浆样品经甲醇沉淀蛋白后,以芦荟新苷D为内标,采用液相色谱-串联质谱法测定大鼠血浆中芦荟苦素的血药浓度。以Synergi Hydro-RP为色谱柱,以0.1‰甲酸溶液-甲醇为流动相进行梯度洗脱,流速为0.50 mL/min,柱温为30 ℃,进样量为5 ?L;采用电喷雾离子源,以多反应监测模式进行负离子检测,用于定量分析的离子对分别为m/z 393.1→272.9(芦荟苦素)、m/z 555.3→144.9(内标)。采用上述方法测定大鼠尾静脉注射(3.35 mg/kg)和灌胃(16.75 mg/kg)芦荟苦素后0.083、0.167、0.333、0.667、1、1.5、2.5、4、6、8、10 h静脉血中芦荟苦素的质量浓度,采用DAS 3.0软件计算药动学参数。结果:芦荟苦素检测质量浓度的线性范围为1~600 ng/mL(r=0.994 5),定量下限为1 ng/mL,批内、批间RSD均小于15%,批内、批间准确度在±15%内,基质因子为(92.74±4.33)%~(94.84±2.57)%,提取回收率为(69.04±2.13)%~(75.03±2.84)%,稳定性试验的实测结果与理论值的偏差在±15%内。大鼠静脉注射和灌胃芦荟苦素后,主要药动学参数cmax分别为(10 693.3±2 745.3)、(223.3±36.2) ng/mL,t1/2分别为(2.45±1.45)、(3.33±1.91) h,AUC0-24 h分别为(4 190.6±883.6)、(1 210.1±93.9) ng·h/mL(n=3),口服绝对生物利用度为11.13%。结论:本研究成功建立了一种快速、灵敏的芦荟苦素血药浓度测定方法,适用于其药动学研究。
关键词 芦荟苦素;芦荟新苷D;血药浓度;药动学;液相色谱-串联质谱法;大鼠
Determination of Aloesin in Rat Plasma by LC-MS/MS and Its Pharmacokinetic Study
TAN Yinfeng,SUN Moxiao,ZHANG Lei,YANG Wenyue,LI Hailong,LI Youbin(School of Pharmacy, Hainan Medical University/Hainan Provincial Key Laboratory for Research and Development of Tropical Herbs/Haikou Key Laboratory of Li Nationality Medicine, Haikou 571159, China)
ABSTRACT OBJECTIVE: To establish a method for the determination of aloesin in plasma of rats, and to investigate pharmacokinetic characteristics of aloesin. METHODS: The plasma samples were precipitated with methanol. Using aloeresin D as internal standard, the plasma concentration of aloesin was determined by LC-MS/MS. The determination was performed on Synergi Hydro-RP column with mobile phase consisted of 0.1‰ formic acid-methanol (gradient elution) at the flow rate of 0.50 mL/min. The column temperature was 30 ℃, and sample size was 5 ?L. The electrospray ionization source was applied to carry out negative ion detection with multiple reaction monitoring mode. The ion transitions for quantitative analysis were m/z 393.1→272.9 (aloesin) and m/z 555.3→144.9 (internal standard), respectively. The concentration of aloesin in venous blood was determined by above method at 0.083, 0.167, 0.333, 0.667, 1, 1.5, 2.5, 4, 6, 8, 10 h after intravenous injection (3.35 mg/kg) and intragastric administration (16.75 mg/kg) of aloesin. DAS 3.0 software was used to calculate pharmacokinetic parameters. RESULTS: The linear range of aloesin were 1-600 ng/mL (r=0.994 5). The lower limit of quantification was 1 ng/mL, and RSDs of within and between batches were less than 15%; accuracies within and between batches were within ±15%. The matrix factors were (92.74±4.33)%-(94.84±2.57)%, and extraction recoveries were (69.04±2.13)%-(75.03±2.84)%; the deviation between the measured results of the stability test and the theoretical values were within±15%. After intravenous injection and intragastric administration of aloesin, main pharmacokinetic parameters were as follows: cmax were (10 693.3±2 745.3) and (223.3±36.2) ng/mL; t1/2 were (2.45±1.45) and (3.33±1.91) h; AUC0-24 h were (4 190.6±883.6) and (1 210.1±93.9) ng·h/mL (n=3). Absolute bioavailabi- lity was 11.13%. CONCLUSIONS: The established method is rapid and sensitive for plasma determination of aloesin, and suitable for its pharmacokinetic study.
KEYWORDS Aloesin; Aloeresin D; Plasma concentration; Pharmacokinetics; LC-MS/MS; Rats
芦荟苦素是一种色酮苷类物质,存在于多种百合科芦荟属植物中,在芦荟中的含量约为3‰[1]。芦荟为百合科植物库拉索芦荟Aloe barbadensis Miller、好望角芦荟Aloe ferox Miller或其他同属近缘植物叶的汁液浓缩干燥物,具有泻下通便、清肝泻火、杀虫疗疳之功效[2-3]。相关研究显示,芦荟苦素是芦荟的重要活性物质之一[4-5],其主要功效如下:(1)抑制酪氨酸酶活性,阻止黑色素的合成,具有美白功效[6];(2)调节细胞炎症因子和生长因子的释放,具有抗炎作用[7];(3)诱导Sam蛋白、Mad蛋白及其类似蛋白(Smad)和丝裂原活化蛋白激酶(MAPK)的激活,促进伤口愈合[7];(4)激活Wnt信号通路,下调Notch信号通路,调节消化系统功能,改善结肠炎模型大鼠的病理状态[8-9];(5)促进脂联素分泌,调节糖脂代谢,具有抗糖尿病作用[10]。毒理学研究表明,芦荟苦素基本无毒副作用[11]。药动学属性是评估活性化合物成药性的重要指标,然而,针对芦荟苦素的药动学研究很少,有关报道仅采用二维液相色谱法测定了芦荟苦素的含量,并没有提供其具体的药动学参数,所用分析技术相对落后且操作繁琐[12]。本文拟采用液相色谱-串联质谱(LC-MS/MS)法测定大鼠血浆中芦荟苦素的浓度,并考察其药动学特征,为芦荟苦素的成药性研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括Nexera XR型超高效液相色谱(UHPLC)仪(日本Shimadzu公司)、AB-SCIEX API 4000+型串聯四极杆质谱仪及配备的Analyst 1.6.3数据处理软件(美国Applied Biosystem公司)、5922型冷冻离心机(日本Kubota公司)、XS105DU型十万分之一电子分析天平(瑞士Mettler Toledo公司)、LabTower EDI15型超纯水一体机(美国Thermo Fisher Scientific公司)、Vibrax型圆周振荡器(德国Ika公司)等。
1.2 主要药品与试剂
芦荟苦素对照品(批号20190530,纯度≥98%)购自昊睿化学(上海)有限公司;芦荟新苷D对照品(内标,批号19072605,纯度≥98%)购自成都普菲德生物技术有限公司;异氟烷(批号2018/08)购自北京吉安得尔科技有限公司;甲醇(色谱级)购自德国Merck公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
本研究所用动物为7周龄SPF级SD雄性大鼠,共6只,体质量为243~300 g,由长沙市天勤生物技术有限公司提供,生产许可证号为SCXK(湘)2014-0011。所有大鼠均在温度(22±2)℃、相对湿度40%~70%、12 h明暗交替的环境下饲养,自由进食、饮水。
2 方法与结果
2.1 色谱与质谱条件
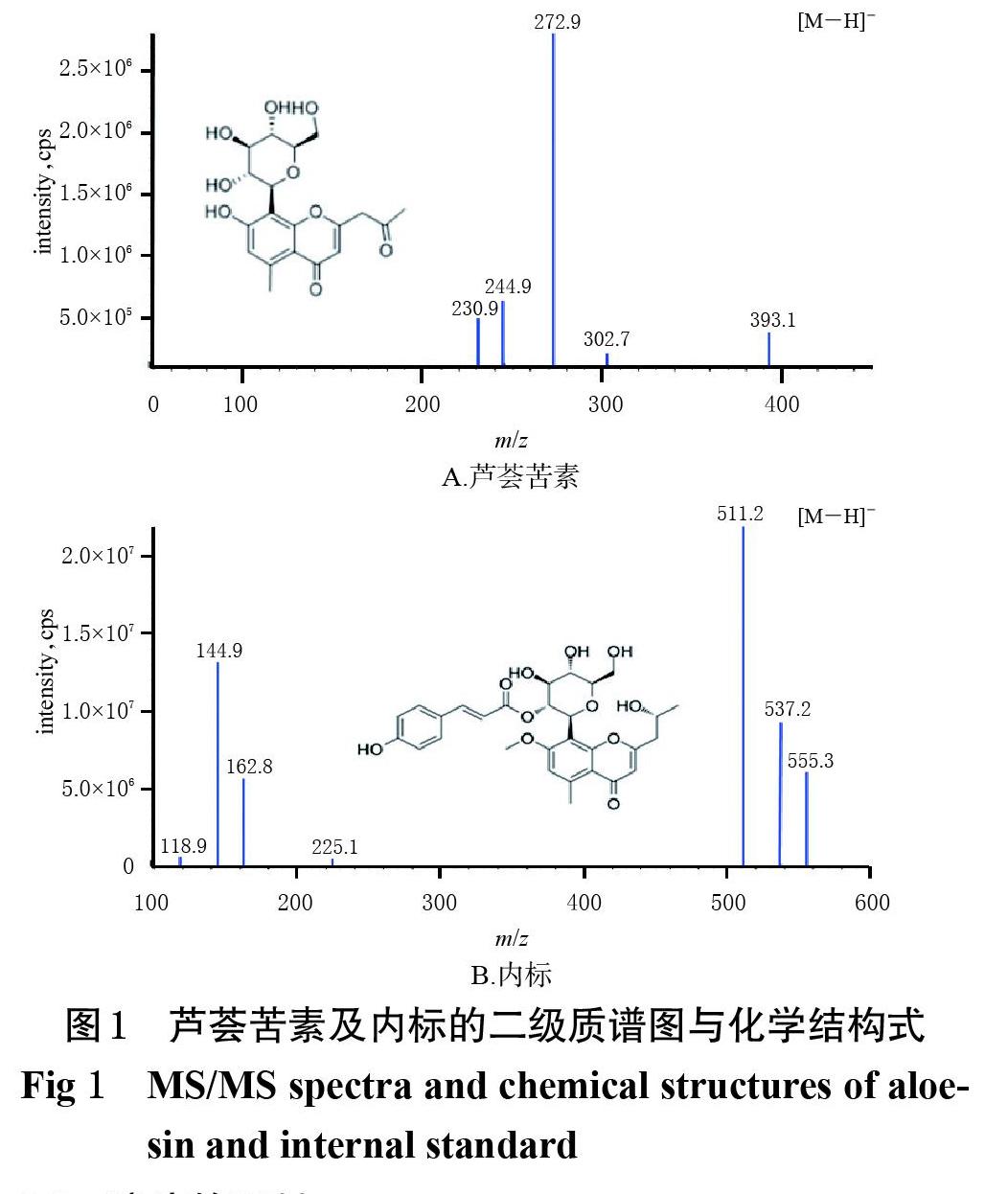
以Synergi Hydro-RP(2.10 mm×50 mm,4 ?m)为色谱柱,以0.1‰甲酸溶液(A)-甲醇(B)为流动相进行梯度洗脱(0~0.50 min,5%B;0.51~3.00 min,5%B→90%B;3.01~4.00 min,90%B;4.01~5.00 min,5%B);流速为0.50 mL/min;柱温为30 ℃;进样量为5 ?L。采用电喷雾离子源(ESI),以多反应监测模式(MRM)进行负离子检测;喷雾电压为4 500 V;离子源气体1(氮气)压力为50 psi;离子源气体2(氮气)压力为50 psi;气帘气(氮气)压力为30 psi;喷雾温度为550 ℃;碰撞气压力为2 psi。芦荟苦素及内标的质谱参数见表1,二级质谱图及化学结构式见图1。
2.2 溶液的配制
2.2.1 芦荟苦素贮备液 取芦荟苦素对照品适量,精密称定,加甲醇溶解、稀释,制成质量浓度为0.1 mg/mL的贮备液,于4 ℃下保存,备用。临用时,用甲醇稀释至所需质量浓度即可。
2.2.2 内标溶液 取内标对照品适量,精密称定,加甲醇溶解、稀释,制成质量浓度为50 ng/mL的内标溶液,于4 ℃下保存,备用。
2.3 血浆样品的处理
取血浆样品50 ?L,置于离心管中,加入内标溶液150 ?L,以2 000 r/min涡旋10 min,充分沉淀蛋白,再于4 ℃下以13 000 r/min离心10 min,取上清液置于微量进样管中,进行LC-MS/MS分析。
2.4 方法学考察
按2020年版《中国药典》(四部)通则“生物样品定量分析方法验证指导原则”的要求,进行方法学考察[13]。
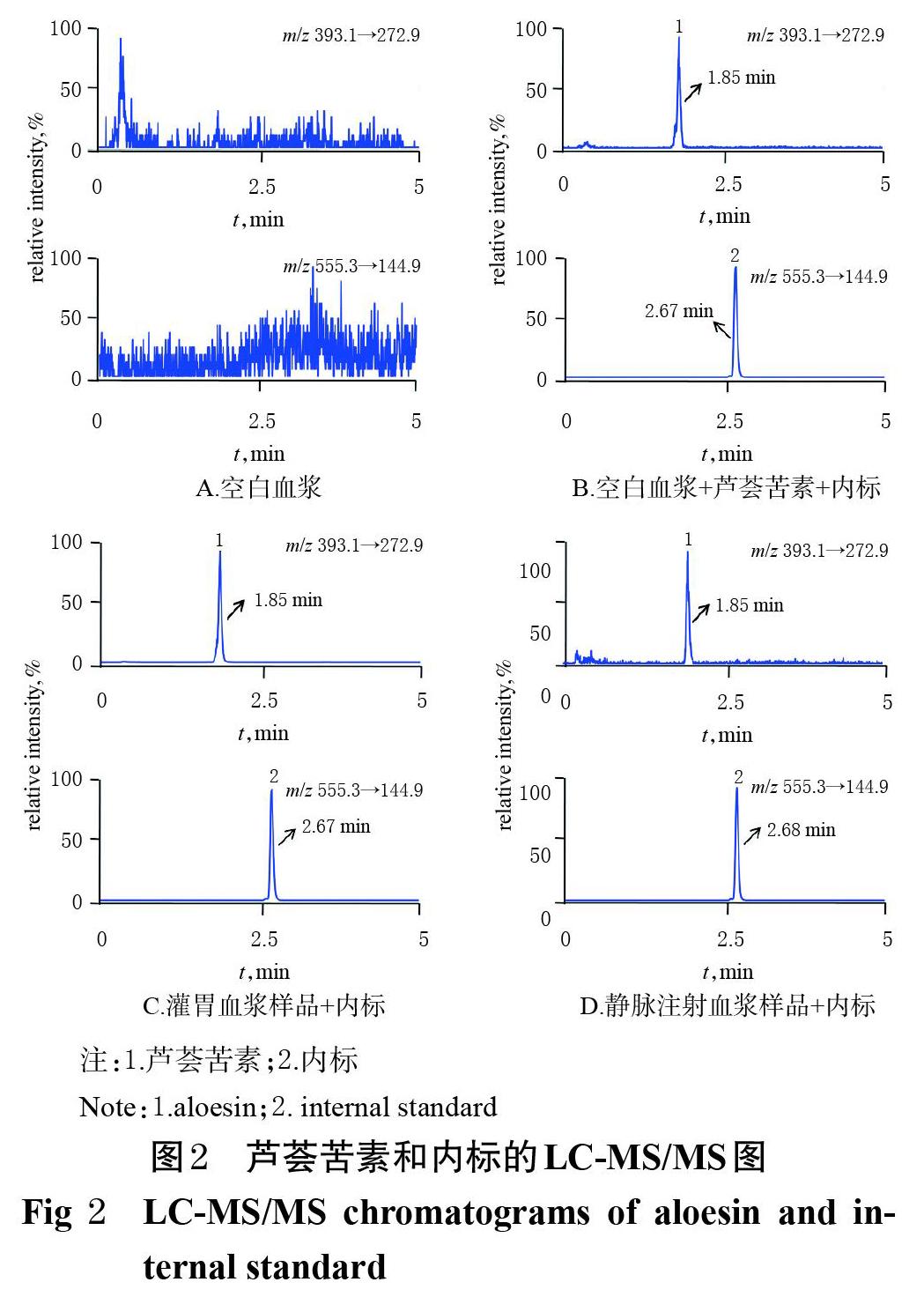
2.4.1 专属性考察 取不同来源的大鼠空白血浆、空白血浆+芦荟苦素(1 ng/mL)、静脉注射给药8 h时经眼眶静脉采集到的大鼠血浆样品、灌胃给药8 h时经眼眶静脉采集到的大鼠血浆样品,按“2.3”项下方法处理(空白血浆不加内标)后,再按“2.1”项下条件进样分析,记录色谱图(图2)。结果显示,芦荟苦素、内标的出峰时间分别约为1.85、2.67 min,分离效果良好,内源性物质对测定无干扰,表明本方法专属性良好。
2.4.2 线性关系与定量下限考察 取空白血浆,分别加入0.1 mg/mL的芦荟苦素贮备液适量,配制成质量浓度分别为600、400、200、40、10、2、1 ng/mL的系列标准曲线血浆样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积。以待测物与内标的峰面积之比(y)为纵坐标、待测物的质量浓度(x)为横坐标,采用加权最小二乘法(权重为1/x2)进行线性回归,得回归方程为y=0.006 17x+0.001 13(r=0.994 5)。结果显示,芦荟苦素在1~600 ng/mL质量浓度范围内与峰面积成良好的线性关系,定量下限为1 ng/mL。
2.4.3 准确度与精密度试验 取空白血浆,分别加入0.1 mg/mL的芦荟苦素贮备液适量,配制成定量下限质量浓度(1 ng/mL)和低、中、高质量浓度(3、50、500 ng/mL)的质控血浆样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积,根据随行回归方程计算实测质量浓度。每个质量浓度平行分析5个样品,考察批内精密度[以相对标准差(RSD)表示,下同]和批内准确度[以实测质量浓度的均值与理论质量浓度的相对误差(RE)表示,下同];于3 d内分析3个分析批,考察批间精密度和批间准确度。结果见表2。
2.4.4 残留效应考察 取“2.4.2”项下标准曲线线性范围上限的血浆样品(芦荟苦素质量浓度为600 ng/mL)适量,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析;随后取空白血浆样品适量,不加内标,同法处理后进样分析,考察残留效应。结果显示,芦荟苦素的残留峰面积小于定量下限质量浓度质控血浆样品芦荟苦素峰面积的20%,内标的残留峰面积小于上述质控血浆样品内标峰面积的5%,表明本方法残留效应符合要求[13]。
2.4.5 稀释可靠性考察 用空白血浆配制芦荟苦素质量浓度为15 000 ng/mL的稀释质控样品,再用空白血浆稀释30倍(稀释后的理论质量浓度为500 ng/mL)后,按“2.3”项下方法处理,再按“2.1”项下条件进样分析,考察稀释可靠性。共平行分析5个样品。结果显示,经稀释后质控样品的准确度(RE)在±15%内。
2.4.6 基质效应和提取回收率试验 按文献[14-15]方法考察基质效应和提取回收率。取不同来源的大鼠空白血浆适量,按“2.4.3”项下方法配制芦荟苦素低、中、高质量浓度(3、50、500 ng/mL)的质控血浆样品,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积A1(以内标峰面积进行归一化处理,下同)。用甲醇配制芦荟苦素和内标质量浓度与前者对应的标准溶液,按“2.1”项下条件进样分析,记录峰面积A2。取按“2.3”项下方法处理后的大鼠空白血浆适量,配制芦荟苦素和内标质量浓度与前者对应的血浆样品,按“2.1”项下条件进样分析,记录峰面积A3。每个质量浓度平行分析5个样品,并按如下公式计算基质因子和提取回收率,基质因子=A3/A2×100%,提取回收率=A1/A3×100%。结果见表3。
2.4.7 稳定性考察 取空白血浆适量,按“2.4.3”项下方法配制芦荟苦素低、中、高质量浓度(3、50、500 ng/mL)的质控血浆样品,分别考察样品在下列情况下存放的稳定性:①样品按“2.3”项下方法处理后放置于自动进样器(25 ℃)中8 h,进样分析;②样品经反复冻融(-20~25 ℃)3次后再同法处理,进样分析;③样品在室温下放置4 h后再同法处理,进样分析;④样品在-20 ℃下存放15 d后再同法处理,进样分析。每个质量浓度平行制备20份,每种情况各5份,按“2.4.3”项下方法计算RE。结果见表4。
2.5 药动学实验
取SD大鼠6只,适应性饲养5 d,并于给药前禁食不禁水12 h。取3只大鼠经尾静脉注射芦荟苦素3.35 mg/kg(溶剂为生理盐水),另取3只大鼠灌胃芦荟苦素16.75 mg/kg(溶剂为生理盐水),剂量参考文献[12]并结合检测方法的定量下限设置。分别于给药后0.083、0.167、0.333、0.667、1、1.5、2.5、4、6、8、10 h经眼眶静脉采血约0.1 mL,置于预先用肝素钠溶液润洗的离心管中,以4 000 r/min离心10 min,取血浆于-80 ℃下保存。在定量分析时,用空白血浆将上述血浆样品稀释至芦荟苦素线性范围内,按“2.3”项下方法处理后,再按“2.1”项下条件进样分析,记录峰面积,根据随行回归方程计算质量浓度。采用DAS 3.0軟件绘制药-时曲线,并计算药动学参数。结果显示,给药8 h后,静脉注射或灌胃给药大鼠血浆中芦荟苦素的质量浓度均低于定量下限(1 ng/mL),芦荟苦素在大鼠体内的口服绝对生物利用度[(灌胃AUC0-∞×静脉注射剂量)/(静脉注射AUC0-∞×灌胃剂量)×100%)为11.13%,详见图3(给药8 h后的数据略)、表5。
3 讨论
芦荟苦素是极性较大的化合物,易溶于水,在开发LC-MS/MS定量分析方法的过程中,笔者曾使用Kinetex XB-C18(2.10 mm×50 mm,2.6 ?m)进行分离,结果显示,芦荟苦素在0.5 min左右即出峰,且色谱峰峰形较差。经过筛选,笔者改用对极性化合物有更好分离效果的Synergi Hydro-RP(2.10 mm×50 mm,4 ?m)进行分离,结果显示,芦荟苦素的分离效果较好,满足实验要求。
本研究前期使用了荭草苷作为芦荟苦素定量分析的内标化合物,因为该成分与芦荟苦素都是碳苷,结构差异主要在于荭草苷苷元是黄酮。然而,荭草苷的极性比芦荟苦素小,在甲醇中的溶解度低于1 mg/mL,色谱峰拖尾严重,笔者通过在流动相中加入甲酸以改善峰形,却导致芦荟苦素出现前延峰,表明荭草苷不适合用作芦荟苦素定量分析的内标化合物。经过筛选发现,芦荟新苷D和芦荟苦素都是从芦荟中分离得到的色酮苷类化合物,且化学性质相近[1]。本研究结果表明,芦荟新苷D适宜用作芦荟苦素定量分析的内标化合物。
本研究通过LC-MS/MS法测定不用给药方式下大鼠血浆中芦荟苦素的药动学参数发现,芦荟苦素在大鼠体内的口服绝对生物利用度为11.13%。由此推测,芦荟苦素的亲水性分子结构可能阻碍了其跨膜转运,减少了其体内吸收,提示在芦荟苦素的后续药物研发中应通过结构改造、制剂研究或其他方法来提升其有效血药浓度,提高其生物利用度。
综上所述,本研究成功建立了一种快速、灵敏的芦荟苦素血药浓度测定方法,并适用于该化合物的药动学研究。
参考文献
[ 1 ] 杨月红.芦荟苦素的提取与分離纯化工艺研究[D].上海:华东理工大学,2012.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:170.
[ 3 ] GAO Y,KUOK K I,JIN Y,et al. Biomedical applications of Aloe vera[J]. Crit Rev Food Sci Nutr,2019,59(Sup1):S244-S256.
[ 4 ] 闫昌誉,李晓敏,李家炜,等.芦荟的研究进展与产业化应用[J].今日药学,2021,31(2):81-90.
[ 5 ] S?NCHEZ M,GONZ?LEZ-BURGOS E,IGLESIAS I, et al. Pharmacological update properties of Aloe vera and its major active constituents[J]. Molecules,2020,25(6):1324.
[ 6 ] KIM J H,YOON J Y,YANG S Y,et al. Tyrosinase inhibitory components from Aloe vera and their antiviral acti- vity[J]. J Enzyme Inhib Med Chem,2017,32(1):78-83.
[ 7 ] WAHEDI H M,JEONG M,CHAE J K,et al. Aloesin from Aloe vera accelerates skin wound healing by modulating MAPK/Rho and Smad signaling pathways in vitro and in vivo[J]. Phytomedicine,2017,28:19-26.
[ 8 ] PENG C,ZHANG W J,DAI C,et al. Study of the aqueous extract of Aloe vera and its two active components on the Wnt/β-catenin and Notch signaling pathways in colorectal cancer cells[J]. J Ethnopharmacol,2019,234:112029.
[ 9 ] PARK M Y,KWON H J,SUNG M K. Dietary aloin, aloesin,or aloe-gel exerts anti-inflammatory activity in a rat colitis model[J]. Life Sci,2011,88(11):486-492.
[10] YIMAM M,ZHAO J,CORNELIUSEN B,et al. UP780,a chromone-enriched aloe composition improves insulin sensitivity[J]. Metab Syndr Relat Disord,2013,11(4):267-275.
[11] LYNCH B,SIMON R,ROBERTS A. In vitro and in vivo assessment of the genotoxic activity of aloesin[J]. Regul Toxicol Pharmacol,2011,61(2):215-221.
[12] BAEK M,JEONG J H,KIM D H. Determination of aloesin in rat plasma using a column-switching high-performance liquid chromatographic assay[J]. J Chromatogr B Biomed Sci Appl,2001,754(1):121-126.
[13] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版. 北京:中国医药科技出版社,2020:466-468.
[14] 黄翠云,张凤,柳珂,等. LC-MS/MS法测定肿瘤患者恶性腹水中紫杉醇的含量[J].中国药房,2020,31(1):86- 90.
[15] 王鹏,蒋学华,王凌. LC-MSn应用于生物样品检测中基质效应的评价[J].中国新药杂志,2011,20(20):1953- 1956.
(收稿日期:2021-07-01 修回日期:2021-10-09)
(编辑:邹丽娟)
