白及组培苗原球茎诱导培养基优化研究
2021-12-08莫盛龙黄晔李才清黄明进刘红昌
莫盛龙,黄晔,李才清,黄明进,刘红昌
(1.贵州大学农学院,贵州贵阳550025;2.贵州大学石斛研究院,贵州贵阳550025;3.贵州省中药材繁育与种植重点实验室,贵州贵阳550025;4.镇远县科学技术服务中心,贵州镇远557700)
兰科植物白及[Bletilla striata(Thunb.)Riechb.f.]的干燥块茎药用价值高,具有收敛止血、消肿生肌之功效[1],是治疗内外伤出血症的要药;现代药理研究表明,白及还具有抗菌[2]、抗肿瘤[3,4]等作用。现在野生白及资源已枯竭,人工栽培将成为解决资源短缺的有效途径。但要规模化种植白及,必须快繁白及种苗,而白及组培苗原球茎的形成和膨大又是白及种苗培育的关键[5]。
白及的人工栽培较晚,白及种苗的人工繁育未获得成功制约了白及的规模化种植,分株繁殖系数低,成活率不高,难以在短时期内解决白及种苗短缺的问题,采用白及种子培育种苗已成为白及种苗快繁的有效途径[6,7]。目前白及组织培养技术已经相当成熟,其组培快繁体系一般包括白及种子萌发及原球茎诱导、原球茎增殖分化、壮苗生根和炼苗移栽4个阶段[8],普遍认为白及炼苗的成活率是白及规模化生产的关键,炼苗成活率高的白及组培苗大田的栽培成活率高,而白及原球茎的诱导形成则是提高炼苗成活率的根本措施。探究培养基类型(MS、3/4MS和1/2MS)、6-BA浓度、NAA浓度对白及组培苗原球茎诱导的影响,观测原球茎形成的变化规律,筛选促进原球茎诱导生长膨大的最优配方,有效提高白及组培苗的炼苗成活率,从而为白及的工厂化生产提供理论参考。
1 材料与方法
1.1 蒴果材料
试验材料于2017年10月6日采集自贵州省毕节市大方县羊场镇湾子组——大方县济民林木中药材种植专业合作社紫花白及蒴果(栽培品种),蒴果未开裂,果皮浅黄色,自封袋密封后保存于4℃普通冰箱中备用。
1.2 仪器与试剂
高压蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂);超净工作台(苏州净化设备有限公司);直尺;电子天平(0.001g);75%医用酒精;0.1% HgCl2溶液;6-苄基腺嘌呤(6-BA);萘乙酸(NAA);土豆;纯化琼脂粉;蔗糖;活性炭等。
1.3 培养基
1.3.1 种子培养基MS培养基,土豆泥80 g L-1,蔗糖28 g L-1,琼脂6 g/L,NAA 1 mg L-1,活性炭0.1 g L-1。
1.3.2 原球茎诱导培养基见表1,其他成分均为蔗糖28 g L-1,琼脂6 g L-1,活性炭0.1g L-1。
表1 白及原球茎的诱导培养正交试验设计表Table 1 The orthogonal experimental design of induction culture for PLB of
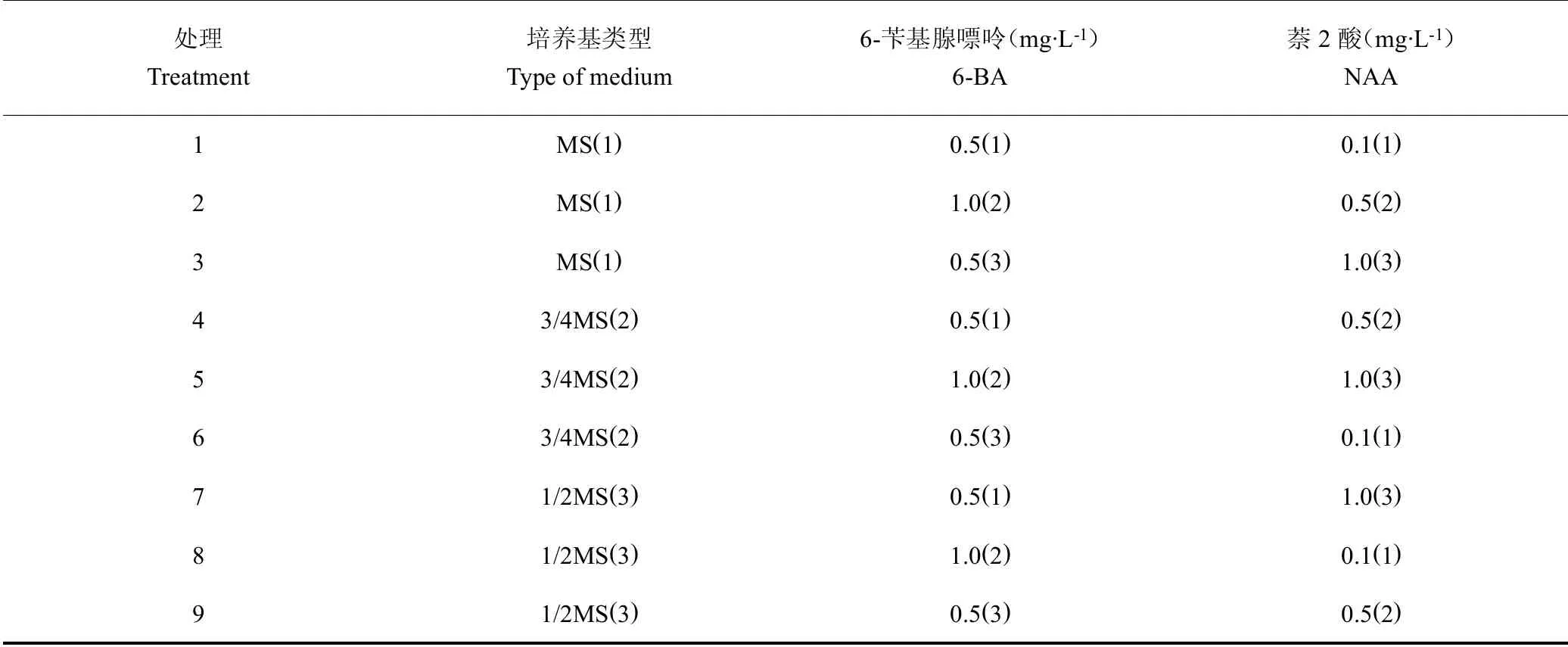
表1 白及原球茎的诱导培养正交试验设计表Table 1 The orthogonal experimental design of induction culture for PLB of
处理Treatment培养基类型Type of medium 6-苄基腺嘌呤(mg·L-1)6-BA萘2酸(mg·L-1)NAA 1 MS(1) 0.5(1) 0.1(1)2 MS(1) 1.0(2) 0.5(2)3 MS(1) 0.5(3) 1.0(3)4 3/4MS(2) 0.5(1) 0.5(2)5 3/4MS(2) 1.0(2) 1.0(3)6 3/4MS(2) 0.5(3) 0.1(1)7 1/2MS(3) 0.5(1) 1.0(3)8 1/2MS(3) 1.0(2) 0.1(1)9 1/2MS(3) 0.5(3) 0.5(2)
1.4 白及种子无菌萌发培养
将白及蒴果一端剪掉,抖出种子于50mL小烧杯中,用牛皮纸封口,烧杯外壁喷适量75%酒精,用无菌棉花擦拭消毒后转移到超净工作台中,用75%酒精浸泡30 s,细胞筛过滤,无菌水清洗3次,再用0.1%HgCl2溶液浸泡10min,细胞筛过滤,无菌水清洗3次,无菌操作接种到种子培养基中,在25±2℃、光照强度1 500lx、光照时间10 h/d的条件下培养60 d。
1.5 培养基类型、6-BA和NAA浓度诱导白及原球茎及组培苗形成
待种子萌发长出小苗至2~3 cm后,无菌转接到原球茎的诱导培养基中,试验采用L9(34)正交试验,试验因素为培养基类型(A)、6-BA(B)、NAA(C)。培养基类型:A1、A2、A3分别为MS、3/4MS、1/2MS;6-BA浓度:B1、B2和B3分别为0.5mg/L、1.0mg/L和2.0 mg/L;NAA浓度:C1、C2和C3分别为0.1 mg/L、0.5 mg/L和1.0 mg/L。本试验每个组合培养16瓶,每瓶20株,设3个重复,采用返置抽签法每次定期各取3瓶。将已培养0 d、20 d、40 d、60 d、80 d和100 d的白及幼苗取出,观察其生长情况,用自来水清洗后,再用吸水纸将表面的水分吸去,选择长势较一致的幼苗,原球茎取下称量其重量,培养100 d时,除称量原球茎重外,还对组培苗的生长情况,包括整株重,株高,根系数和根系长度进行测定。
1.6 公式与计算

2 结果
2.1 白及组培苗原球茎重动态分析
各处理原球茎重在80 d内均呈现上升趋势,处理1在20~60 d时上升速较慢,仅为0.66 mg d-1;在61~100 d之间时上升速度最快,为0.71 mg d-1,呈线性增长,且在100 d时数值最大,为88.28 mg/株;处理8在20~80 d时上升速度稳定,80 d后平缓;处理3在20~40 d上升速度最快,41~80 d上升平缓,81~100 d速度变快,100 d时仅次于处理1;处理7在20~40 d之间时上升速度最快,为1.14 mg d-1,在100 d时出现下降趋势;处理9原球茎重变化趋势与处理3类似,但到100d时,其原球茎重较低,仅为42.89mg/株(图1)。
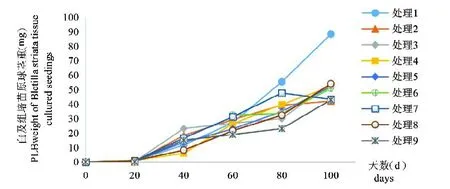
图1 100天内白及组培苗原球茎重动态分析Fig.1 The dynamic analysis of the PLB weight of Bletilla striata tissue cultured seedlings within 100 days
2.2 100 d时白及组培苗原球茎重正交分析
通过直观分析[9](表2),比较各因素极值排出影响因素大小(R越大的因素越重要):NAA>培养基>6-BA,选取较好的水平组合,3因素应选k值最大的水平:A1、B1、C1。
表2 100 d时白及组培苗原球茎重正交试验结果计算表Table 2 The calculation table of orthogonal test results of the PLB weight of tissue cultured seedlings at 100 days
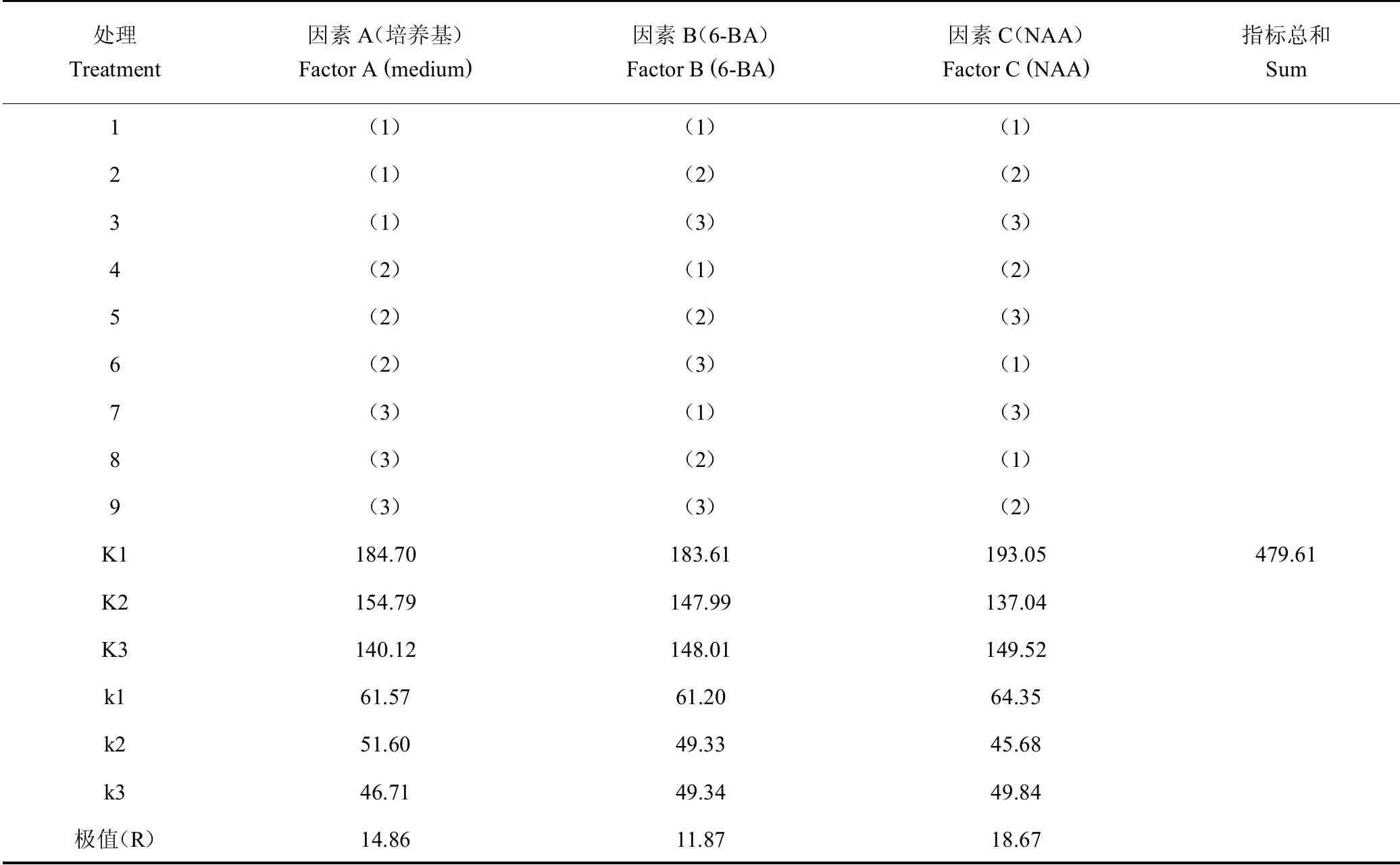
表2 100 d时白及组培苗原球茎重正交试验结果计算表Table 2 The calculation table of orthogonal test results of the PLB weight of tissue cultured seedlings at 100 days
处理Treatment因素A(培养基)Factor A(medium)因素B(6-BA)Factor B(6-BA)因素C(NAA)Factor C(NAA)指标总和Sum 1(1) (1) (1)2(1) (2) (2)3(1) (3) (3)4(2) (1) (2)5(2) (2) (3)6(2) (3) (1)7(3) (1) (3)8(3) (2) (1)9(3) (3) (2)K1 184.70 183.61 193.05 479.61 K2 154.79 147.99 137.04 K3 140.12 148.01 149.52 k1 61.57 61.20 64.35 k2 51.60 49.33 45.68 k3 46.71 49.34 49.84极值(R) 14.86 11.87 18.67
经方差分析[9](表3),A、B、C三因素的F值均小于F0.05(2,2),因此3个水平白及组培苗原球茎重差异均不显著,所以选择平均数大的作为最优组合,即A1、B1、C1。
表3 100 d时白及组培苗原球茎重方差分析表Table 3 The variance analysis table of the PLB weight of tissue cultured seedlings at 100 days
?
2.3 100 d时白及组培苗生长情况分析
经过方差分析(表4),处理1的原球茎重、整株重和株高均最大分别为88.28 mg/株、421.29 mg/株以及6.12 cm,除整株重与处理3差异不显著外,与其他处理差异极显著,根系数和根系长度分别为6和3.29 cm,处理3原球茎重次之为54.36 mg/株,与处理1差异显著,与其他处理差异不显著,整株重为396.50 mg/株,与处理1和处理7差异不显著,与其他处理均差异显著,根系数为8,与其他处理均差异极显著,根系长度最低为2.19 cm,与处理7差异极显著,而处理2除株高和根系长度不是最低外,在各个方面均表现最差。
表4 100 d时白及组培苗生长情况Table 4 The growth oftissue culture seedlings at 100 days
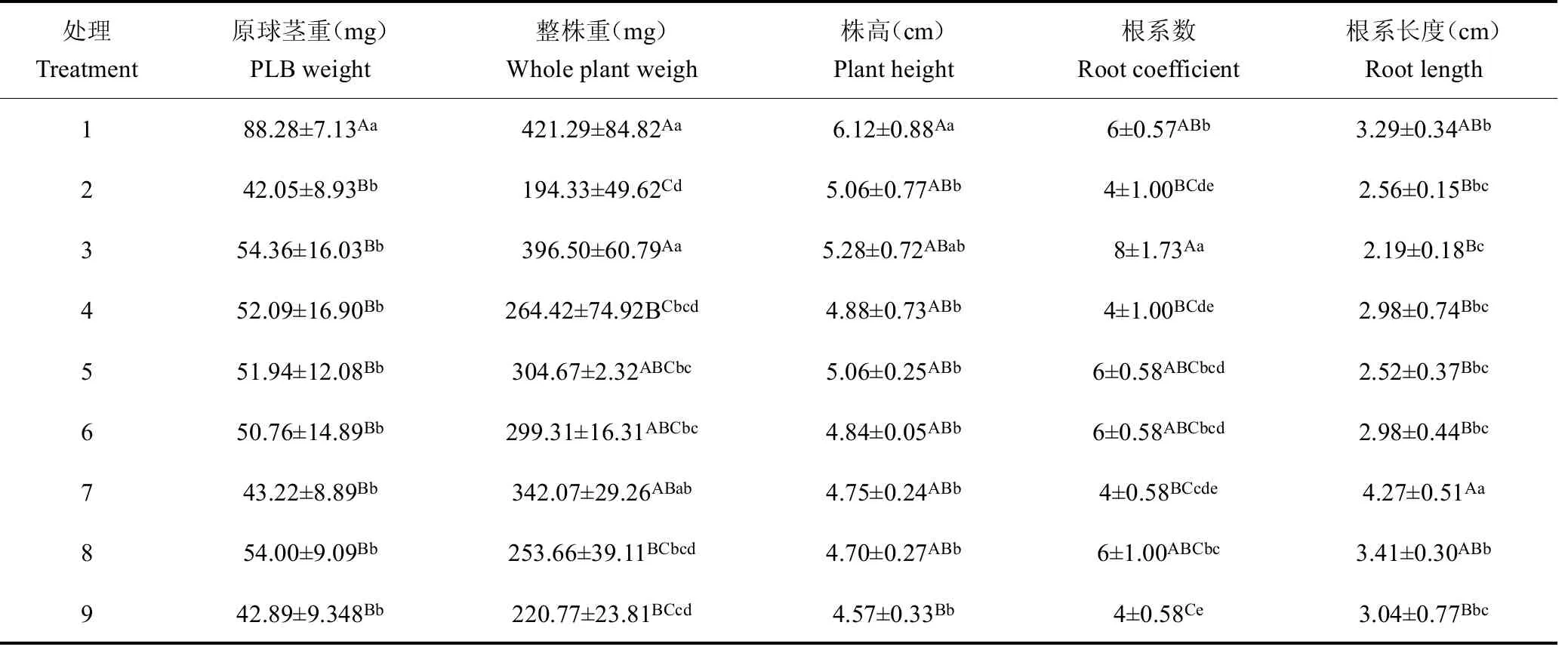
表4 100 d时白及组培苗生长情况Table 4 The growth oftissue culture seedlings at 100 days
注:采用字母标记法对数据的显著性进行标记,大写字母表示极显著(P<0.01),小写字母表示显著(P<0.05)。Note:The significance of data is marked by letter marking.Capital letters are extremely significant(P<0.01)and lowercase letters are significant(P<0.05).
?
经相关分析(表5),原球茎重与整株重,整株重与株高均为显著正相关,相关系数分别为0.694和0.704,原球茎重与株高相关性达到极显著,相关系数为0.887,而株高与根系长度以及根系数与根系长度,存在较弱的负相关。
表5 100 d时白及组培苗生长情况相关性分析Table 5 The correlation analysis of the growth oftissue culture seedlings at 100 days
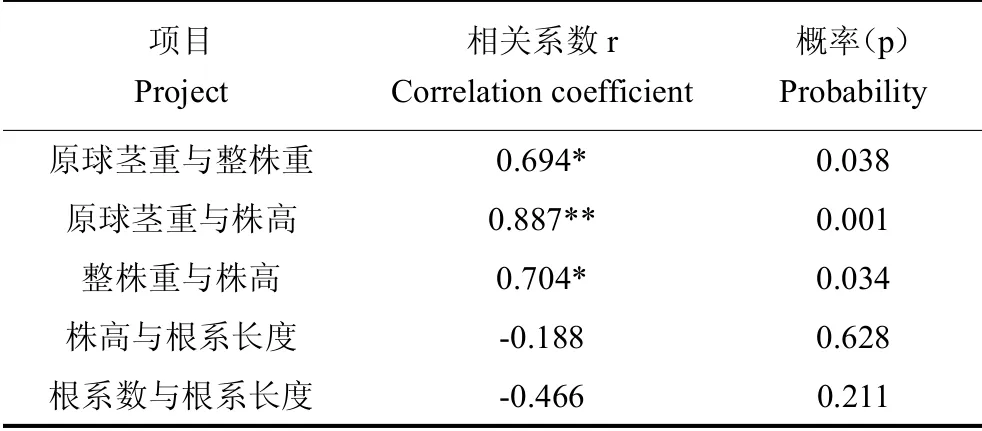
表5 100 d时白及组培苗生长情况相关性分析Table 5 The correlation analysis of the growth oftissue culture seedlings at 100 days
注:采用星号标记法对数据的显著性进行标记,**表示极显著(P<0.01),*表示显著(P<0.05)。Note:The asterisk marking method was used to mark the significance of the data.**was extremely significant(P<0.01),and*was significant(P<0.05).
项目Project相关系数r Correlation coefficient概率(p)Probability原球茎重与整株重 0.694* 0.038原球茎重与株高 0.887** 0.001整株重与株高 0.704* 0.034株高与根系长度 -0.188 0.628根系数与根系长度 -0.466 0.211

图2 不同培养基类型、6-BA浓度和NAA浓度条件下培养100 d时的白及组培苗原球茎图Fig.2 Procorms of PLB induction of tissue culture seedlings at different medium types,6-BA concentration and NAA concentration at 100 days
3 讨论
通过研究白及组培苗培养基的基本培养基类型、6-BA浓度和NAA浓度对其原球茎及幼苗的影响,进行3因素3水平正交试验,从而得出结论:影响原球茎形成和膨大因素的重要顺序为NAA浓度>培养基类型>6-BA浓度,同时在6-BA、NAA浓度降低且6-BA与NAA的比值大时,有利于诱导白及组培苗原球茎的膨大,浓度增大或比值降低时,则表现为缓慢增长。筛选出白及原球茎诱导较好的水平组合为MS+6-BA0.5 mg L-1+NAA 0.1 mg L-1,在20~60 d时上升速度一般,仅为0.66 mg d-1,在61~100 d时上升速度最快,为0.71 mg d-1,呈线性增长,且在100 d时数值最大,为88.28mg/株,与其他处理均差异极显著,并且植株长势良好,株高、根系数量及根系长度适中。
朱玉球等[10]较早采用黄花白及种子作为外植体材料,先诱导原球茎的形成,再将原球茎进行切割,诱导生根,培育成苗,该研究为白及种苗生产提供了一定借鉴,但没有进行大田生产实践,更没有提到白及种球茎的形成在白及种苗生产中的关键作用,相反作者还将球茎切割成块再诱导成苗,没有考虑到田间生产对白及种苗的要求;之后,彭丽丽[11]、余朝秀[12]、袁宁[13]、管常东[14]等也对白及组培快繁技术进行了相关研究,研究内容都重点放在白及增殖培养和生根培养方面,为白及种苗生产研究进一步提供了参考,但也没有提出种苗球茎的形成在白及种苗生产中的重要作用;李慧敏等[5]在白及瓶内假鳞茎诱导研究中明确提出了假鳞茎是白及组培苗成功的关键。王高鹏等[15]以改良白及组培苗增殖的最好培养基配方及育苗进程为重点,确立了白及快繁组织培养体系;史俊等[16]利用液体培养和固体培养的方式,探究影响诱导白及原球茎形成的因素。以上这些研究方法和研究结果对白及种苗繁育提供了重要的参考资料。缩短培养时间和减少人工成本是白及组培快繁的目的之一,因此筛选更加适宜诱导营养茎形成和膨大的培养基以及减少继代次数可能会成为研究的重要内容。
