黔茶1号与黔湄601号种子生物学特性比较与胚根特异表达基因分析
2021-12-08陈蓉邹启红杨杰赵德刚黄小贞
陈蓉,邹启红,杨杰,赵德刚,黄小贞,※
(1.贵州大学生命科学学院,山地植物资源保护与种质创新省部共建教育部重点实验室,贵阳550025;2.贵州大学茶学院,贵阳550025)
根系组织是高等植物长期适应陆生环境而不断进化形成的重要地下器官[1],它具有多种功能,包括固着植株、吸收水分、矿质元素合成和储藏各种生理活性物质等[2,3]。旺盛生长的根系和树冠部分具有协同促进作用,即“根深叶茂,本固枝荣”[4]。茶树[Camellia sinensis(L.)O.Kuntze]是世界范围内重要的木本经济作物[5],和绝大多数植物类似,其根系的生长情况直接影响茶叶栽培质量和产量。茶氨酸作为茶树重要的特征性代谢产物之一,与茶叶品质密切相关,而茶树根部组织是茶氨酸重要的合成场所[6,7]。因此,了解茶树根系生长发育规律,培育根系发达的茶树品种是当前茶树育种的主要研究方向之一。
植物根系划分大体可以分为直根系和须根系两类,茶树有性繁殖的根系为直根系,与大部分双子叶植物如拟南芥一样[8],茶籽萌发后胚根向下生长,向地性极强;茶树无性繁殖的幼苗根系则表现为无明显主根和侧根,根系系统为不定根系,主要分布于浅层土壤[9]。相比茶树不定根发育,胚根发育的直根系统目前研究较少。近年来根系特异表达基因的鉴定及其相应功能基因的分析已经成为研究的热点,比如,调节茶树根系激素代谢,并对共生体系以及茶树根系生长产生影响的茶树根系基因HMGR[10]、番茄SlTRY基因在拟南芥中的表达产物可促进根毛细胞的分化,与拟南芥TRY基因功能相似,均可调控根的发育[11]。水稻OsRMC基因在水稻根系发育、根弯曲和卷曲过程中扮演十分重要的角色,通过调控茉莉酸信号转导来影响水稻的生长发育[12]。尽管调控茶树根系发育的基因已有较多研究[13-15],但是不同品种中胚根特异表达基因的相关分析还未见报道。由于不同植物组织在生长发育过程中执行特定的生理功能,因此研究根系特异表达基因,从利用根系功能的角度来说更有重要价值和理论意义。
黔茶1号(C.sinensis.cv.Qiancha 1,QC 1)和黔湄601号(C.sinensis.cv.QianMei 601,QM 601)是贵州省推广的地方优良茶树品种,目前国内外针对这两个品种茶籽的研究非常少。本研究一方面通过对QC 1和QM601两个本地优良品种茶籽生物学特性的研究,为充分利用茶树资源、推广优良品种以及茶籽的综合利用提供理论参考依据;另一方面,以QC 1和QM 601胚根组织和芽叶组织为材料,利用转录组测序技术,比较分析了不同品种胚根基因表达与叶片组织基因表达的差异,筛选出品种特异的胚根基因,并对其中与生长发育密切相关的激素以及在调控网络中起重要作用的转录因子进行了详细分析。本研究发掘了大量可能参与茶树胚根发育调控的关键基因,为后续深入解析茶树胚根的生长与发育过程的分子调控机制提供了重要的理论依据。
1 材料与方法
1.1 实验材料
本研究所用茶树品种为贵州省内推广的地方品种黔茶1号和黔湄601号,茶籽于2019年11月采集自“湄潭星兴茶叶专业合作社”茶园基地。茶籽萌发并种植于贵州大学“山地植物资源保护与种质创新教育部重点实验室”茶园种质资源圃以及人工气候温室。
1.2 茶籽生物学特性
1.2.1 茶籽外部形态观察随机选取饱满、无病害茶籽各50粒,利用Olympus SZX16体式显微镜观察茶籽外部形状并拍照,利用Image-Pro Plus图像分析软件测量茶籽粒径。
1.2.2 茶籽千粒质量将茶籽充分混合均匀,随机选取饱满、无病害茶籽100粒,设置8个重复,用电子天平测量其质量,然后将其平均值乘以10得到千粒质量。
1.2.3 茶籽活力测定采用相对电导率法测定茶籽活力。随机选取大小一致、饱满且无损伤的茶籽各20粒,去除种壳,用蒸馏水冲洗3次,吸干水分,在室温下用蒸馏水浸泡茶籽,测定烧杯中溶液电导率(E0),将浸泡茶籽的烧杯放于25℃恒温箱24 h,取出摇匀测溶液电导率(E1),将烧杯放入100℃沸水煮30 min,取出冷却至室温,充分混摇,测定溶液电导率(E2)。重复3次。相对电导率根据如下公式计算:

1.2.4 茶籽含水量测定将干净烧杯放入80℃烘箱中6~8 h,直至烘干后取出,放入干燥器中冷却至室温,称重(G1),将茶籽放入烧杯中,再次称重(G2),接着放入80℃烘箱24 h,冷却至室温,称重(G3)。设置3次重复取样测量。含水量参照如下公式计算:
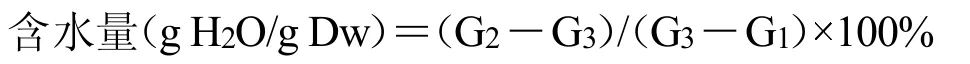
1.2.5 茶籽密度和孔隙度测定随机取茶籽放入一个100 mL的量筒,种子的上表面与刻度相平行,称重(M1)。取有精确刻度的50mL小量筒内装25 mL的水,将50粒种子称质量,即为种子的绝对质量(M2),将种子放入量筒中,再次观察记录液面水平升高的刻度,即为种子样品的绝对体积(V)。根据公式求出种子的比重,重复3次。根据容重计算种子密度与孔隙度。参照如下公式计算:

1.2.6 茶籽的吸胀特性随机抽取茶籽50粒,称其干质量,放入烧杯,并加入25℃蒸馏水,置于25℃的恒温培养箱中。在前12 h内每隔2 h取出1次,用滤纸吸干种子表面的水分后称质量;再隔12 h取出称质量;然后每隔24 h称质量计数,直至120 h为止。计算茶籽各自的吸水率、吸水量和吸收速度,绘制吸水曲线,重复3次。参照如下公式计算:吸水率=(茶籽总质量-茶籽干质量)/茶籽干质量100%

1.2.7 萌发率将茶籽浸泡吸水2 d后,将漂浮在水面的茶籽去除,随机挑选大小一致、无病害的茶籽100粒,种在营养土中,每隔2 d浇一次水,30 d后统计茶籽发芽数量,重复3次。参照如下公式计算:
1.3 转录组测序
1.3.1 转录组组织材料和RNA的提取取QM 601和QC 1两个品种对应萌发后2个月实生苗的胚根组织,分别用QM 601-R和QC 1-R表示;对应的一芽二叶组织,分别用QM601-BL和QC1-BL表示(图2A)。随机采集新鲜组织,各组织混合后迅速放入液氮保存。设2个生物学重复。胚根和芽叶分别提取总RNA后进行cDNA文库建立,并进行转录组测序。建库及测序委托深圳华大基因股份有限公司完成。
1.3.2 数据检测和功能注释将构建好的文库用高通量基因组分析仪(DNBSEQ)进行测序。将原始图像数据经碱基识别(base calling)转化为序列数据,使用SOAPnuke将数据进行过滤等处理,去除原始数据的低质量读数之后,使用Bowtie2将cleanreads比对到参考基因序列(http://tpdb.shengxin.ren/),再使用RSEM计算基因和转录本的表达水平[16,17],分别用Ericscript(v0.5.5)和rMA TS(V3.2.5)融合基因和对差异基因进行剪接(DSGs)。根据KEGG PATHWAY注释分类,使用R软件中的phyper函数进行富集分析,计算P-value,然后对其进行FDR校正,Q-value≤0.05视为显著富集。
1.3.3 根中特异表达基因的筛选根据FPKM(fragmentperkbpermillionfragments)计算基因的表达量[18]。如果某基因在芽叶组织中FPKM表达数值大于1,但在胚根组织中FPKM数值等于0,则认为该基因为胚根特异表达的基因。
1.3.4 转录因子使用getorf(http://emboss.sourceforge.net/apps/cvs/emboss/apps/getorf.htmlHmmseach)检测Unigene的ORF(开放阅读框),利用database中分类定义的转录因子(transcription factor,TF)家族,然后使用hmmsearch(https://www.ebi.ac.uk/Tools/hmmer/search/hmmscan)将ORF比对到转录因子蛋白结构域,最后根据PlantTFDB描述的转录因子家族特征对Unigene进行鉴定。
2 结果与分析
2.1 QC 1与QM 601生物学特性分析
茶籽颜色为黄色,形状呈球状,QC 1表面皱纹稍多而不规则;QM 601表面稍光滑,体积较大(图1 A)统计分析结果表明,QC 1千粒质量平均值为(1 620.57±3.527)g,种子小而均匀,属于小粒种子,QM 601千粒质量平均值为(1 760.09±2.70)g,属于中粒种子;QC 1茶籽含水量较少,仅为25.75%,QM 601茶籽含水量较高,为49.97%;进一步茶籽活力测定结果表明,QC 1活力值为0.14%,QM 601活力值为0.03%。萌发实验结果表明,QC1的萌发率高于QM601(图1B)。茶籽吸胀特性结果表明,吸水过程大体上分为3个阶段(图1 C、D):I(急剧吸水阶段,0~48 h)阶段,茶籽的吸水率呈快速增加趋势,尤其在4 h内干茶籽吸水速率最大,4 h后,吸水速率相对下降,但其吸水率仍迅速增加,此阶段的吸水主要由物理吸胀作用引起;II(平稳吸水阶段,48~96 h)阶段,种子的吸收速率相对平稳,达到0.3 g/h,种子质量缓慢增加,至96 h时吸水率达80%以上,此阶段是生理性吸水阶段,用于激活种子萌发过程各种新陈代谢;III(吸水饱和阶段,96~120 h)阶段,茶籽的吸收速率几乎为0,种子吸水量处于饱和状态,种子质量几乎不再增加。综上所述,通过生物学特征的比较,QC 1较QM 601更适合直播。
图1 茶籽外部形态、萌发率与吸胀特性Fig.1 The morphology,germination rate and imbibition characteristics of tea seeds
2.2 QC 1与QM 601芽叶和胚根组织转录组测序分析
对QC 1与QM 601胚根和芽叶组织进行转录组测序,数据质量分析如表2所示。各组织样品的原始数据Raw reads均为43.82 M。经过过滤后,在芽叶中产生的clean reads为42.82~43.21M,总质量为6.42~6.48 Gb,Q20(测序错误率低于1%的序列百分比)为97.45%~97.58%,Q30百分比(测序错误率低于0.1%的序列百分比)为93.19%~93.34%。在根中共产生的clean reads为43.12~43.21 M,总质量为6.47~6.48 Gb,Q20和Q30百分比(测序错误率分别代于1%和0.1%的序列百分率)分别约为97.56%和93.53%。通过与茶树参考基因组的数据进行比对(http://tpia.teaplant.org/),根组织的clean reads从头组装了38 312~41 308个单基因,叶组织cleanreads从头组装了45132~47887个单基因(表1)。这些结果表明不同茶树品种以及胚根和芽叶不同组织部位,其基因数量和种类存在较大差异。进一步在QC1中筛选获得268个胚根特异表达基因,在QM 601中,筛选获得827个胚根基因表达基因。这些胚根组织特异基因的表达可能参与调控特定生物学功能,它们只在胚根中特异表达,而在芽叶中没有检测到表达量,FPKM=0。对两个品种胚根和叶芽的热图分析结果可以看出(图2 B),数据的疏密和频率高低程度,两个重复之间相关性很强,根和叶芽的相关系数不大,说明根系和叶芽基因表达差异很大,有各自的组织特异性。
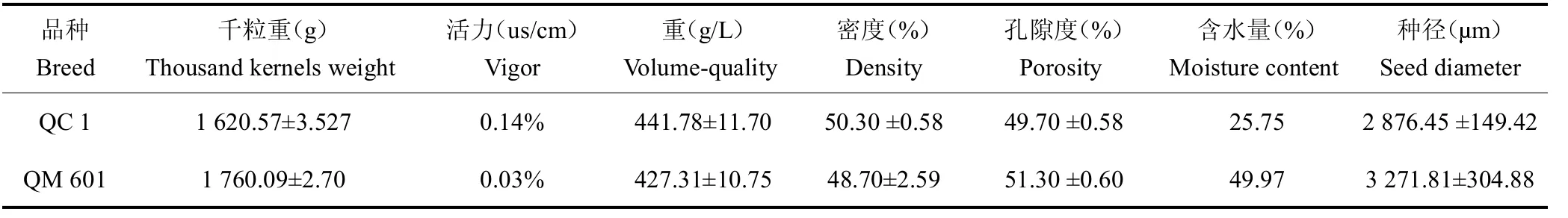
表1 茶籽生物学特征Table 1 The biological characteristics of tea seeds
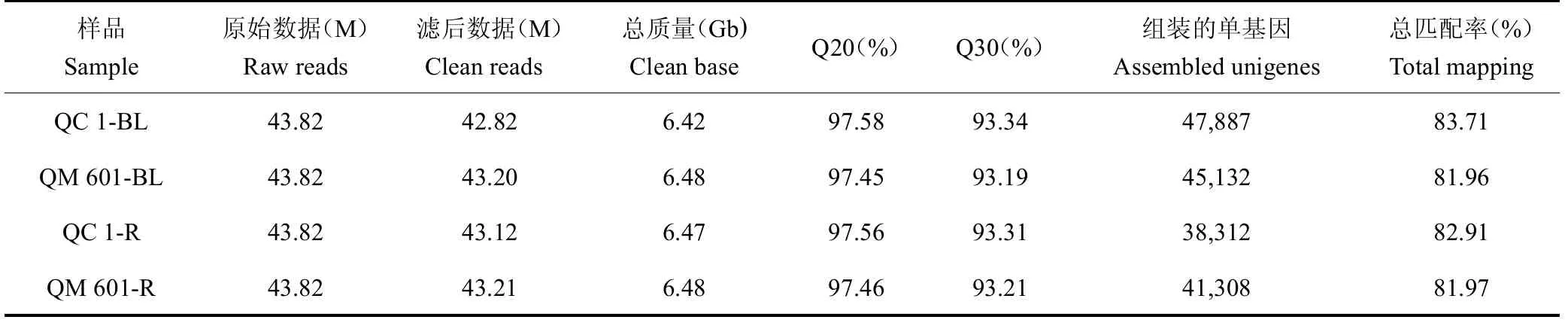
表2 QC 1和QM 601不同组织测序分析Table 2 The transcriptome analysis of different tissues samples in QC 1 and QM 601
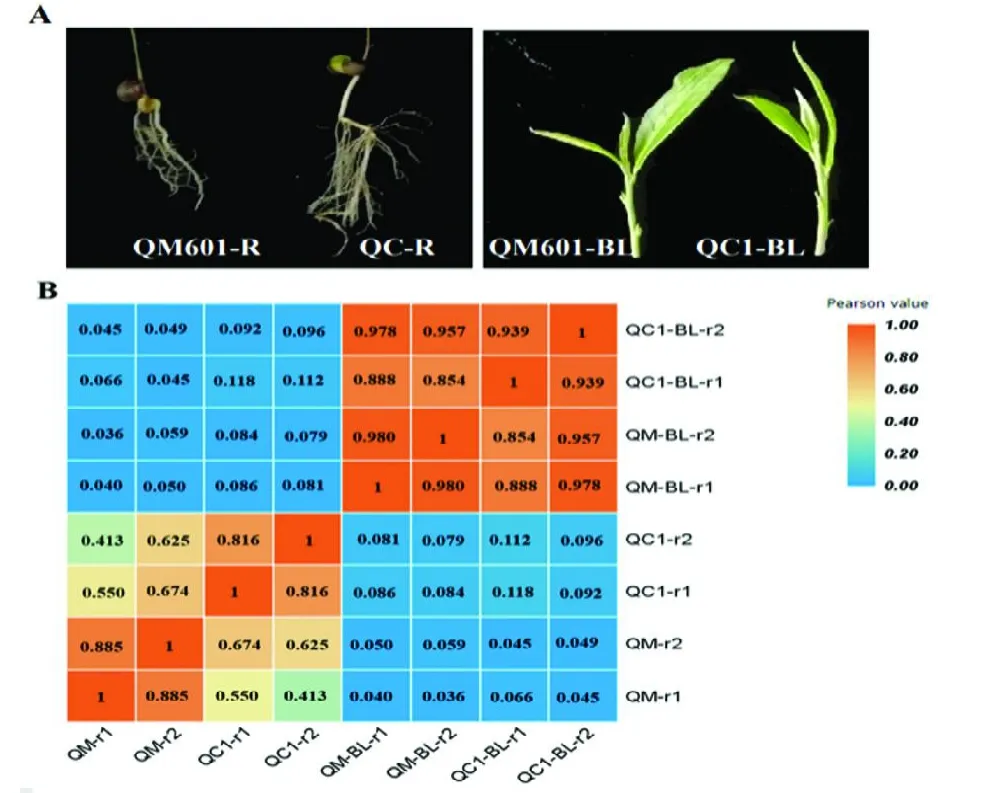
图2 转录组测序组织材料及相关性热图Fig.2 Transcription group sequencing tissue materials and related heat maps.
2.3 QC 1与QM 601胚根特异基因分析
对QC 1中268个胚根特异基因进行GO功能分类,显著富集到的前5个功能组主要涉及到胞外区域、氧化还原酶活性、结合活性、细胞壁和药物代谢过程(图3 A)。KEGG功能富集分析,前5个途径主要涉及硒化合物代谢、苯丙烷生物合成、戊糖和葡萄糖醛酸的相互转化、真核生物核糖体的生物合成和氨酰tRNA生物合成(图3 B)。

图3 QC 1中胚根特异基因的GO和KEGG富集分析Fig.3 The GO and KEGG enrichment analysis of radicle specific genes in QC 1
对QM 601中870个胚根特异基因进行GO功能分类,显著富集到的前5个功能组主要涉及到氧化还原酶活性、胞外区域、转录调控活性、转录因子活性和结合活性(图4 A)。KEGG功能富集分析,前5个途径主要涉及戊糖和葡萄糖醛酸的相互转化、谷胱甘肽代谢、氨酰tRNA生物合成、精氨酸和脯氨酸代谢以及硒化合物代谢(图4 B)。QC 1和QM 601两个品种的GO和KEGG富集的途径表现出一定程度的相似,表明不同品种的相同胚根组织虽然表达的基因存在差异,但是功能具有保守性。

图4 QM 601中胚根特异基因的GO和KEGG富集分析Fig.4 The GO and KEGG enrichment analysis of radicle specific genes in QM 601
2.4 QC 1与QM 601胚根特异转录因子分析
转录因子在植物的生长发育过程中有重要调控作用,能启动或者关闭关键基因的表达。进一步分析发现,QC 1胚根特异表达的268个基因中,包含45个转录因子(图5)。QM 601胚根特异表达的870个基因中,包含60个转录因子(图6)。其中有18个转录因子是在两个品种中都特异表达的,包括MYB、C3H、
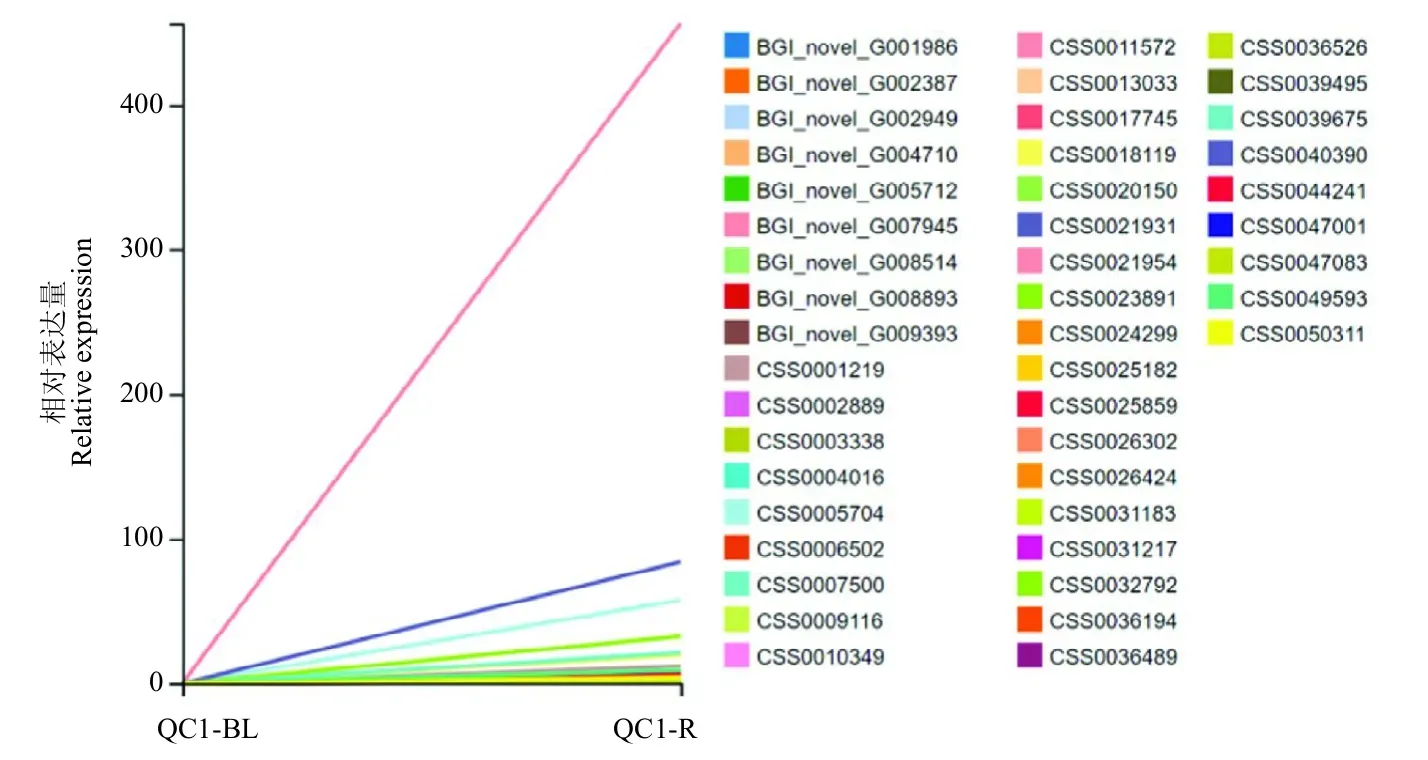
图5 QC 1胚根特异表达的转录因子Fig.5 Radicle specific expressed transcription factors in QC 1
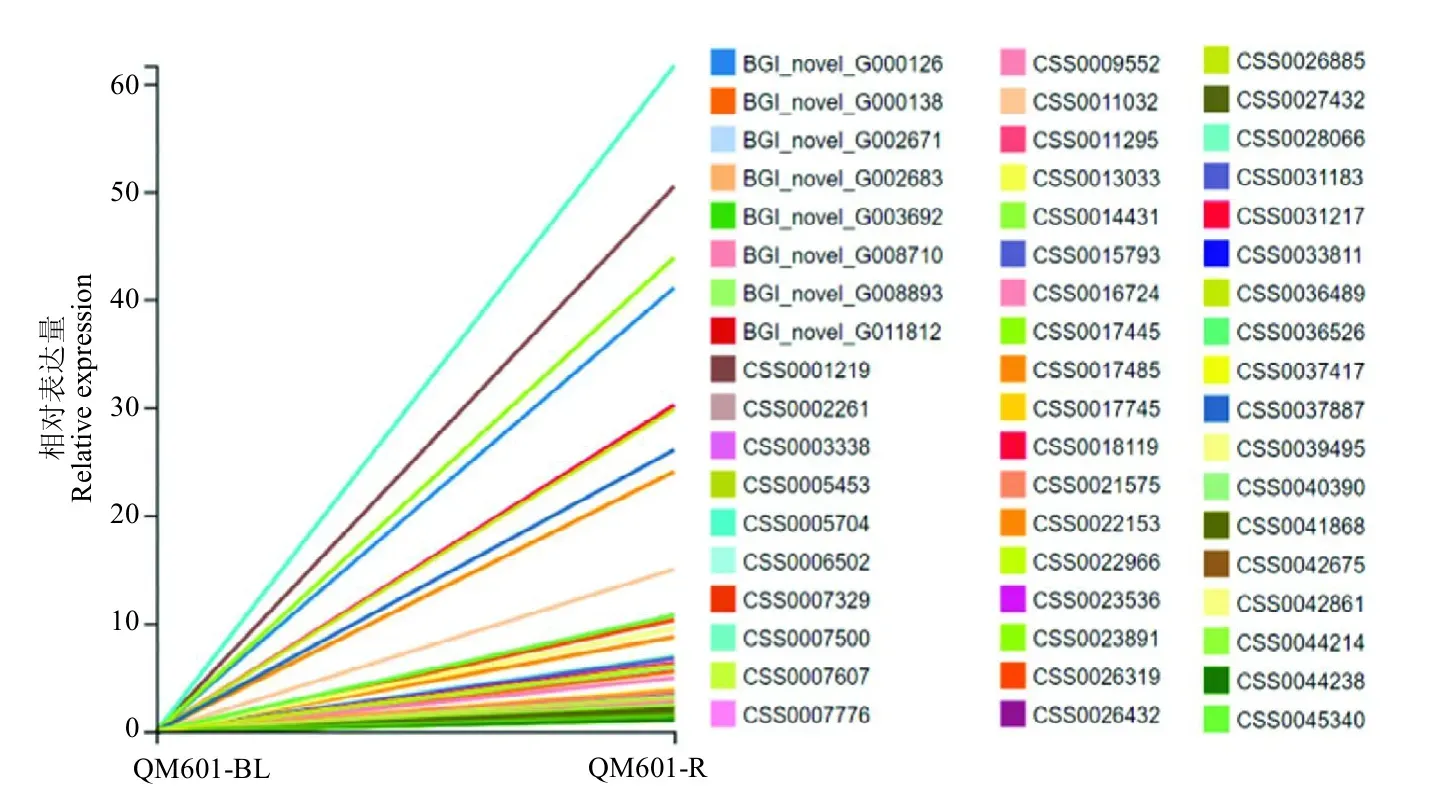
图6 QM 601胚根特异表达的转录因子Fig.6 Radicle specific expressed transcription factors in QM 601
AP2-EREBP、bHLH、C2H2、HB、bZIP、NAC、WRKY、Orphans和GRAS等(图7)。这些组织特异表达的转录因子基因可能在胚根的发育与生理功能等方面起重要的调控作用。

图7 QC 1和QM 601共同的胚根特异表达的转录因子Fig.7 The common radicle specific expressed transcription factors in QC 1 and QM 601
3 讨论
种子千粒质量、容重、活力、含水量、种径、密度及孔隙度是衡量种子品质的重要指标[19]。比较茶籽千粒质量和种径大小发现,QM 601较QC 1的体积更大,更饱满,但从种子容积、密度与孔隙度看出,QC 1茶籽颗粒大小更均匀;种子活力和含水量可预估种子萌发能力,QM 601的含水量高达49.97%,而活力仅为0.03%,萌发率也较QC 1低,而大部分植物种子萌发初期的生长需要大量养分和水分参与种胚细胞活化和基础的细胞器合成修复[20],如图1 B所示,QM 601原生质的水合程度趋向饱和,细胞膨压增加以及种子的体积膨胀受种皮的束缚,这些因素阻碍了细胞的进一步吸水,所以QM 601的吸收速率小于QC 1。种子吸水萌动期间内部的生理生化变得旺盛[21],但含水量太高不利于种子储存,故建议QM 601茶籽采摘后及时干燥,采用合适方法运输和贮藏;而QC 1更便于作为种质保存。不同种子生活力差异极明显,这些差异可能来源于遗传基础、发育阶段及种子含水率的损失,相关原因有待进一步研究。与许多其他木本植物一样,研究茶籽发育分子基础薄弱,目前主要集中在茶籽脱水、低温等不同状态[22,23]和茶籽提取物方面[24,25]的研究,随着茶产业不断北移,北方气候等条件的局限,急需便于贮藏、萌发率高的茶籽种质,因此研究茶籽生物学特征对茶籽的萌发和贮藏条件具有指导意义。本研究分析发现,QC 1萌发率更高、储存和运输更方便,因此认为它作为北方地区直播茶园的推广候选品种。
目前,转录组测序技术已在许多植物中得到应用,研究内容涉及功能基因的挖掘[26]、发育机制研究[27]、分子标记的开发[28]和基因调控网络构建[29]等方面。本研究采用高通量测序技术,首次报道对贵州地方茶树QC 1和QM 601的茶籽萌发实生苗胚根和芽叶进行的测序分析,通过与茶树参考基因组的数据进行比对,根组织的clean reads从头组装了38 312~41 308个单基因,叶组织clean reads从头组装了45 132~47 887个单基因,进一步在QC 1中筛选获得268个胚根特异表达基因,在QM 601中筛选获得827个胚根基因表达基因。张欢等[30]分析了杜梨的根、茎和叶转录组,得到了各组织中的特异表达基因1 245个、971个和846个。Shulaev等[31]分析了草莓的果实和根部转录组,获得了25 050个基因,不但鉴定了1 753个和2 151个组织特异性表达基因,而且发现根中与胁迫相关基因有较高表达。Garg等[32]分析了鹰嘴豆不同组织转录组,得到新稍、根、成熟叶片、花芽和幼荚各10 000余个基因,其中各组织中有929个、408个、123个、1132个和696个基因呈特异表达。这些结果表明,不同品种以及品种间不同组织部位,其基因数量和种类存在较大差异。根特异基因为进一步揭示植物在抗旱、抗寒方面的分子机制以及不同组织功能方面的差异奠定基础。对QC 1中268个胚根特异基因和QM 601中870个胚根特异基因进行GO功能分类,结果显示,显著富集到胞外区域、氧化还原酶活性和结合活性等,KEGG功能富集分析主要涉及硒化合物代谢、苯丙烷生物合成、戊糖和葡萄糖醛酸的相互转化等,QC 1和QM 601两个品种的GO和KEGG富集的途径表现出一定程度的相似,表明不同品种的相同胚根组织虽然表达的基因存在差异,但是功能具有保守性,其“代谢途径”与杜梨、草莓和鹰嘴豆不同组织富集结果相似,如根中苯丙烷生物合成途径等,但硒化合物代谢途径是茶树独有的,推测可能是茶树较其他3种植物硒含量有较大不同。
植物生长发育和响应胁迫的过程,转录因子起到了重要的调控作用,MYB、AP2-EREBP、WRKY和bHLH等转录因子家族广泛参与了植物根[33]、茎[34]、叶[35]、花[36]、果实[37]以及种子[38]的生长发育,而且与植物细胞形态、次生代谢、信号转导和抗逆反应等有密切关系。本研究中发现,MYB、C3H和AP2-EREBP等多种转录因子在两个品种胚根中特异表达,推测这些基因可能参与调控胚根的生长发育及对环境的响应。其中,编号为CSS0005704的基因,预测编码转录因子MYB4,在QM 601和QC 1的胚根中均特异表达,且基因表达量最高。该结果与Tea Plant Information Archive(TPIA)网站搜索比对结果一致。下一步可对该基因是否具有调控根系发育的功能进行深入研究。
综上所述,对两品种茶籽生物学特性的比较结果表明,QC 1茶籽的生物学活性高于QM 601,可能更适合应用于北方新建茶园的直播育种。胚根转录组测序结果,筛选鉴定并挖掘了较多胚根特异表达的差异基因,为后续研究茶树胚根发育以及胚根形成的分子机制提供了新的参考依据。
