NBZ-2.7型电槽估算电流效率公式的探讨和应用
2021-12-07周星邑周建国郭伦莲
周星邑,周建国,郭伦莲,杜 军
(1.北京化工大学,北京102200;2.蓝星(北京)化工机械有限公司,北京100176)
针对NBZ-2.7型电槽操作手册提供的电流效率计算公式,根据加酸后消耗的酸量和阳极气相产物来计算电流效率,此公式计算简单、实用,需要的分析项目少,可以单独计算每台电槽的电流效率,在一定条件下,计算结果是精确的,本文主要从公式的适用条件及公式依据进行推导和探讨。
操作手册表述,相对于阳极液酸度对电流效率CE估算,离子膜电解过程中,随着氢氧根的反迁移,阳极液的酸度将降低,因此电流效率可以根据进料阳极液和出料阳极液之间的酸度不同来计算,当阳极出口酸度足够中和氢氧根离子的时候,此公式的计算值是精确的,公式如下。
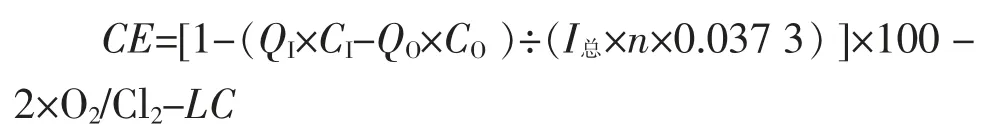
式中:CE—电流效率,%;
CI—入口阳极液的酸度,N;
CO—出口阳极液的酸度,N;
QI—入口阳极液的流量,L/h;
QO—出口阳极液的流量,(=0.75QI,L/h);
I总—电槽的实际运行电流,A;
n—电槽上的电极对数,
LC—泄漏电流比率(常数),%;
O2/Cl2—氯气含氧量,%。
根据法拉第定律、电化学等内容对公式进行推导和探讨,从而加深对公式需要条件和依据的理解,探讨得到精确计算结果需满足的条件。
1 阳极室的反应
1.1 主要反应

1.2 次要反应

1.3 副反应
(1)氯气在阳极液中与H2O发生如下反应。
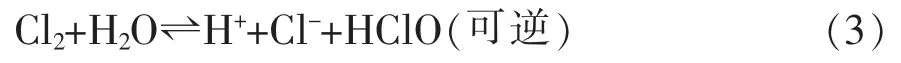
(2)离子交换膜的特性是只选择透过Na+,若阴极室OH-由于离子膜的选择性不够理想而透过离子膜到阳极室,则可能发生如下反应。
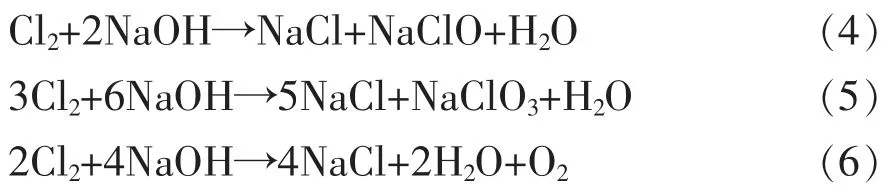
(3)盐水中带入Na2CO3,发生如下反应。
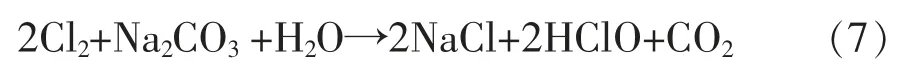
(4)OH-通过离子膜反迁移到阳极,若阳极添加足够的HCl去中和反迁移OH-,只有(1)(2)(3)(7)反应发生,抑制(4)(5)(6)反应式,减少(2)反应中O2的生成。阳极加酸量不足,即(4)(5)(6)反应发生的情况,本文不进行探讨。
2 根据Na+通过离子膜导电、反迁移OH-、泄漏电流计算电流效率的探讨
(1)离子膜在理想状态下对离子具有选择性,Na+从阳极通过离子膜进入阴极实现导电,但实际情况中,由于阴极OH-在电极的作用下有向阳极迁移的趋势,而离子膜不可能完全阻挡OH-迁移,总有少量的OH-从阴极迁移到阳极,与Na+一同完成导电任务,结果引起有效电流Na+迁移量的减少,从而造成产品的损失,使实际产量低于理论产量,示意图见图1。
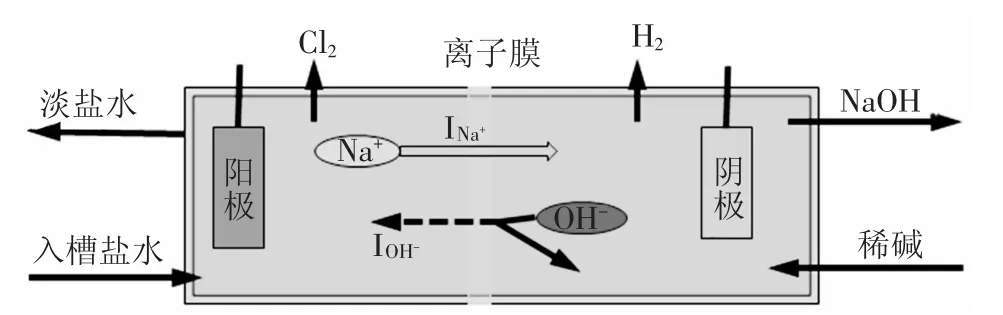
图1 离子膜电解示意图
(2)INa+为Na+导电电流,IOH-为OH-导电电流,I总为总电流。
(3)根据法拉第第一定律,电流通过电解质溶液时,在电极上析出或溶解的物质的质量M与通过的电荷量Q成正比,即M=KQ=K×I总×t

式中:ηOH-—迁移OH-损失电流效率。
(4)根据阳极反应(2)(4)(5)(6),消耗OH-,生成ClO-、ClO3-、O2,以上公式转换成。
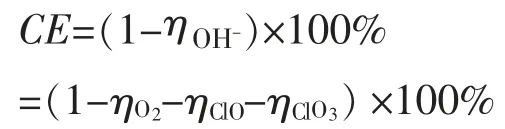
式中:ηO2—产生O2消耗OH-损失的电流效率;
ηClO—产生ClO-消耗OH-损失的电流效率;
ηClO3—产生ClO3-消耗OH-损失的电流效率。
(5)若加HCl足够时,消耗的酸中和OH-,抑制(4)(5)(6)反应式,阻制了ClO-、ClO3-生成,减少了O2生成,阳极室反应只有(1)(2)(3)(7)发生,反迁移的OH-大部分被所加酸中和,部分在电极上放电,产生氧气。
a.以上公式转换成
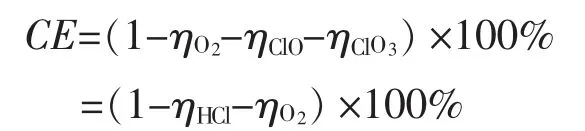
式中:ηHCl—被HCl中和的OH-损失电流效率。
b.在此条件下探讨估算电流效率公式。
(6)电流通过电槽时,有极少部分电流通过进出口软管内液体进行流动,此部分电流叫泄漏电流,泄漏电流损失的电流效率需要扣除,以上公式转换成。
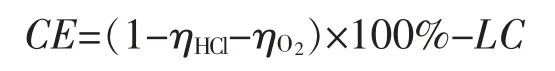
式中:LC—泄漏电流比率,%。
3 公式需要满足的条件及阳极液出口酸度“足够”的探讨
损失电流效率主要是反迁移的OH-,若添加的HCl恰好能中和除了反应(2)中消耗后的反迁移OH-(氢离子的摩尔浓度,mol/L),完全抑制(4)(5)(6)反应,只有(1)(2)(3)(7)反应发生,只有反应(3)产生[H+],此时对阳极液酸度的影响可以近似理解为主要是反应(3)产生的[H+],表明阳极液出口酸度已足够。
阳极液出口酸度“足够”时,酸度值的探讨。
(1)NBZ-2.7型电槽操作手册的阳极出口酸度控制指标是(0.003±0.002)N,pH值控制为2.0~2.5。
(2)若出口酸度控制在(0.003±0.002)N时,通过多年的运行经验,此公式计算的电流效率与阴极成品碱产量计算的结果误差极小,实际运行结果表明达到规定的酸度,加酸量已足够。
(3)阳极液出口酸度恰好中和OH-,酸度已足够,对阳极液出口酸度影响,主要是氯气在阳极液中与H2O的可逆反应(3)产生的[H+]的计算。
在实际生产中,阳极出口液取样到实验室,样品冷却到室温进行酸度分析,此时的条件已不是电槽内的运行条件,为了与分析的条件接近且便于计算,以下在25℃,氯气分压PCl2=1 atm条件下进行探讨,探讨的[H+]更接近实验室分析结果,根据可逆反应对应的能斯特方程计算如下。
a.氯气在阳极液中与H2O可逆反应如下。
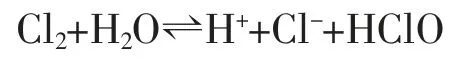
b.根据可逆反应对应的能斯特方程计算[H+]。
这是一个氧化还原平衡反应,25℃时,利用两个相关标准电极电势间的关系,该平衡反应对应的能斯特方程为:φ°Cl2/Cl-=1.358 3(V),φ°HClO/Cl2=1.63(V)。
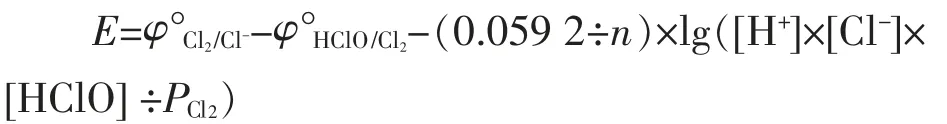
式中:0.059 2—在25℃时,能斯特方程常数;
n—转移电子数;
[Cl-]—氯离子的摩尔浓度,mol/L;
[HClO]—HClO的摩尔浓度,mol/L。
平衡时,上式左端的数值“E=0”,所以有
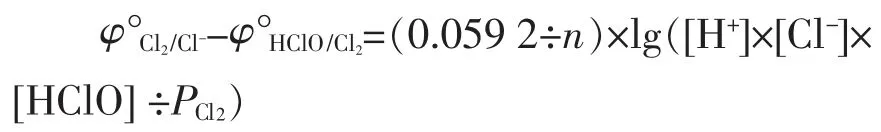
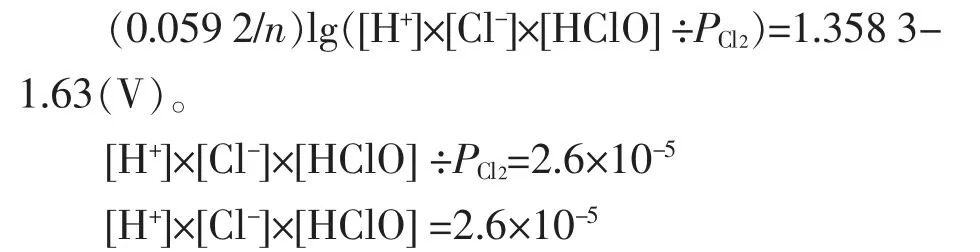
阳极淡盐水中,25℃时、1 atm,NaCl=200(g/L),[Cl-]活度为3.221 mol/L,若所加酸不过量且恰好中和OH-时,[H+]=[HClO],[H+]计算如下。
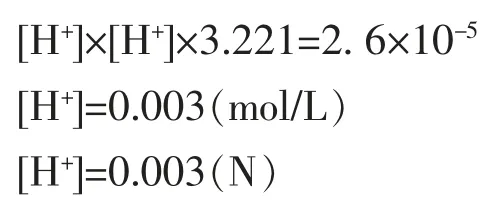
c.以上计算结果基本与操作手册规定酸度最佳控制指标0.003 N一致。
d.根据以上计算结果,若阳极液在25℃时分析的酸度值为(0.003±0.002)N(最佳0.003 N),可以近似理解只有(3)反应产生[H+],表明阳极出口酸度已“足够”,加酸量已中和除了(2)式中消耗后的反迁移OH-,达到了完全抑制(4)(5)(6)反应。
(4)根据操作手册,阳极液酸度控制的实际操作中需要注意以下方面。
a.针对每台电槽操作手册给了一个电流效率在93%、94%、95%、96%、97%时的加酸曲线,参考此曲线加酸,再结合酸度分析和在线pH值进行调整。
c.为了避免牺牲阳极和离子膜受到损害,操作指标规定,阳极入口酸度上限0.15 N,如进口酸度接近0.15 N,出口酸度仍达不到(0.003±0.002)N,用此公式计算的电流效率有较大的误差,此时电流效率已在92%以下,从安全运行、高效运行、保护电极等角度考虑,认为本批次离子膜使用周期已到了末期,需要考虑更换离子膜。
4 消耗酸量和损失电流效率ηHCl推导
(1)消耗的酸量
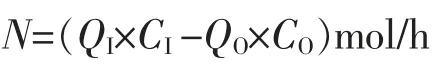
式中:CI—入口阳极液的酸度,mol/L;
CO—出口阳极液的酸度,mol/L;
QI—入口阳极液的流量,L/h;
QO—出口阳极液的流量,L/h。
(2)根据法拉第定律和电化学原理,用中和OH-消耗的盐酸计算损失的电流效率
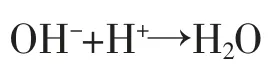
根据中和OH-消耗的H+来计算消耗的电流。
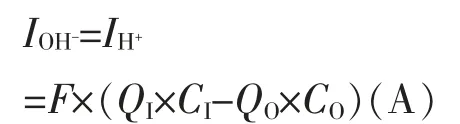

表1 一定条件下淡盐水酸度和pH值关系表
式中:F—法拉第常数,(26.8 A·h/mol,以下同)。
(3)中和OH-消耗的酸计算损失的电流效率ηHCl
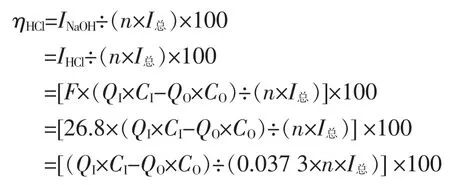
式中:I总—电槽的实际运行电流,A;
n—电槽电极对数。
(4)若加酸量不足,没有完全抑制ClO-、ClO3-生成,但公式中已按完全抑制ClO-、ClO3-生成进行计算,故加酸量不足时,计算的电流效率偏高。
5 反应(2)中OH-生成O2造成的电流效率的损失ηO2推导
(1)OH-迁移生成O2,计算这部分电效率的损失需要知道电极上O2的生成量,因无法直接测定出O2的生成量,应用法拉第定律和电化学原理,只能依靠整个阳极主要气体产物的关系加以推导。
(2)首先假定阳极气体产物的气相总量为T,得出阳极生成各气体产物所消耗的电流。
a.Cl2在阳极气相中的生成量为VCl2,(VCl2为Cl2的体积分数),由主反应2Cl--2e→Cl2可知生成1 mol Cl2需2 mol电子,那么生成这部分Cl2所消耗的电流为ICl2=2 TFVCl2
式中:F—法拉第常数,(26.8 A·h/mol,以下同)。
b.O2在阳极气相中的生成量TVO2(VO2为含O2的体积分数),由次反应4OH--4e→O2+2H2O可知生成1 mol的O2需4 mol电子,那么生成O2所消耗的电流IO2=4TFVO2
c.CO2在阳极气相中的生成量TVCO2(VCO2为含CO2的体积分数),由副反应2Cl2+Na2CO3→2NaCl+2HClO+CO2可知生成1 mol的CO2需耗4 mol电子,这种氯气来自电极生成的氯气,必然消耗一部分电流,这部分电流以CO2的体积分数来表示。
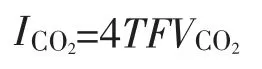
(3)阳极液中产生主要气体所消耗总电流
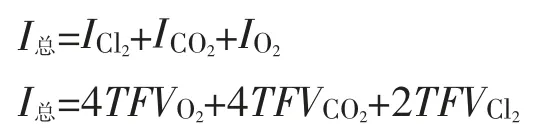
(4)OH-迁移生成O2造成的电流效率的损失ηO2
a.等式两边除以总电流
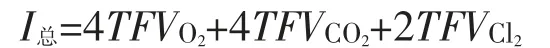
两边除I总等式,上式整理得:
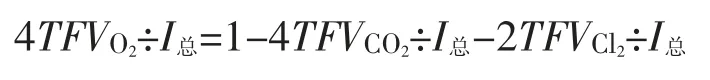
b.OH-迁移生成O2造成的电流效率的损失
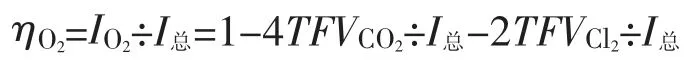
上式经整理得:
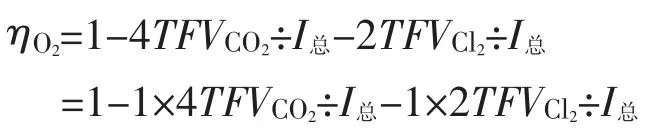
设1=2VO2÷2VO2

因ηO2=4TFVO2÷I总
代入及整理得:

c.阳极气体产物中主要成分为氧气、氯气、二氧化碳,阳极加入足量的酸,中和了反迁移的OH-,实际分析结果中,氯气含量超过99%以上,含氧约0.5%,盐水Na2CO3过量0.4 g/L,含CO2约0.3%,三种气体中CO2、O2占比极少,公式整理得:
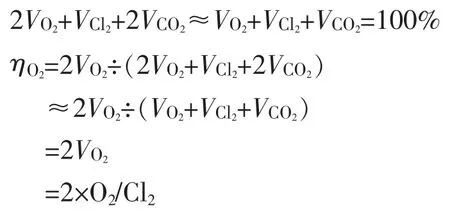
以上得出OH-迁移生成O2电流效率的损失ηO2=2×O2/Cl2,以上推导过程可以得出,氯中含氧(O2/Cl2)指的是主要阳极产生的气体中的氧气的体积分数VO2。
6 式中LC泄漏电流的取值
(1)有以下经验值公式

式中:n—电极对数。
(2)随着电槽设计的改进,泄漏电流减少,此值会降低,NBZ-2.7型电槽150对电极,此值一般取经验值0.43。
7 阳极出口淡盐水流量的计算
(1)阳极淡盐水流量的计算有多种,笔者接触有两种计算方法,一种为钠平衡进行推导,另一种用精盐水中和淡盐水中含量不变计算。因钠离子平衡计算较为复杂,本文采用精盐水中和淡盐水中总量不变计算。
(2)通过计算,通常QO(出口淡盐水流量)=0.75~0.80 QI(入口精盐水流量),电流效率越高,以上系数越低。
8 根据以上推导和探讨结果,代入得出电流效率的公式
(1)通过以上推导代入
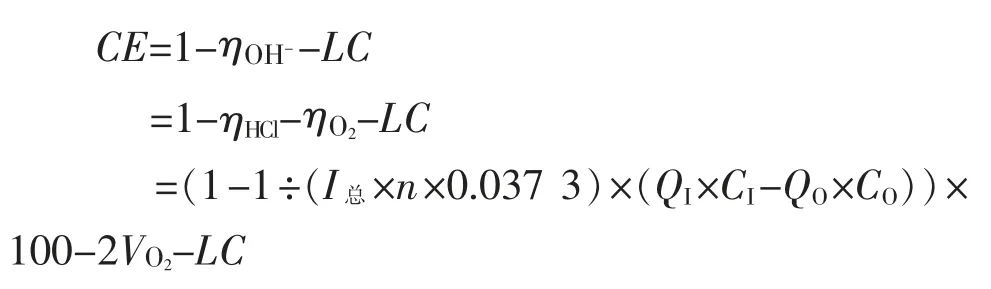
(2)从以上推导和探讨过程中可以得出,此估算公式在应用时要得到较为精确的电流效率,阳极液出口酸度控制在(0.003±0.002)N(最佳0.003 N)时添加盐酸才足量,才能完全抑制ClO-、ClO3-的生成。部分厂家计算的结果偏高,通过反馈信息分析,主要是加酸量不够。
9 公式应用
(1)某厂NBZ-2.7型电槽数据:系统只有1台电槽,n=150片单元槽,运行电流I=14 850(A),根据碱产量测出的阴极电流效率95.75%,阳极进口流量QI=33 500(L/h),C进口=3.12(g/L),C出口)=4.10(g/L),阳极气体中氧气VO2=0.60%,阳极气体中二氧化碳VCO2=0.28%,进口酸度CI=0.065 N,出口酸度CO=0.003 1 N。
(2)阳极出口淡盐水流量计算

(3)根据阳极气相产物及消耗的酸,对电流效率计算
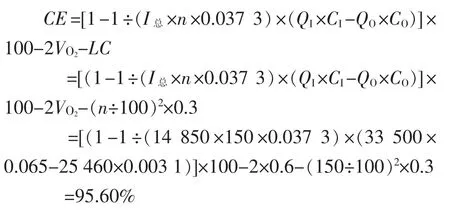
(4)若泄漏电流LC取0.43,电流效率估算值为95.84%。
(5)以上根据阳极气相产物和消耗的酸计算的电流效率和测量的阴极碱电流效率95.75%误差极小,不影响对电槽性能判断。
10 结语
电槽的电流效率是衡量电槽整体性能的重要指标,是判断离子膜性能的关键指标,多台电槽系统中共用一个成品碱流量计,不能根据成品碱产量直接测量单台电槽电流效率,NBZ-2.7型电槽提供的单台电槽的电流效率估算公式需要的分析项目少、计算简单、实用,为持续跟踪电流效率提供了有利条件,为及时了解单台电槽整体性能提供了快捷、准确、连续的数据,能及时发现膜性能出现异常,及时查找原因并处理,为判断单台电槽离子膜性能提供了可靠的依据。
估算公式适用于阳极出口酸度足够的情况,需要阳极出口的酸度分析值在(0.003±0.002)N才有足够的酸度去中和反迁移的OH-,阻止(4)(5)(6)反应发生,才不影响计算结果,应用此公式估算的电流效率才精确。与通过阴极成品碱测量的电流效率误差极小,通过对公式的推导和探讨过程,可深入理解此公式的适用条件和依据,从而更好地运用到生产实践中。
