流式细胞仪分选小鼠Kupffer细胞方法的建立与评价
2021-12-07户乃丽徐晓雪邹林樾赵君朋
户乃丽 徐晓雪 邹林樾 田 蜜 赵君朋
(首都医科大学中心实验室,北京100069)
肝脏含有丰富的免疫细胞一枯否细胞(Kupffer Cells,KCs)细胞,KCs是组成机体单核一巨噬细胞系统最大的群体。KCs具有吞噬、免疫调节及监视等功能,2在肝脏的炎性反应、缺血再灌注损伤、移植免疫等方面发挥着重要作用[1-3]。小鼠KCs以其表面表达 F4/80、CD11b、CD68 和 C 型凝集素结构域家族4成员F为特征表[4,5]。KCs具有异质性、极化性,尽管各型巨噬细胞均表达F4/80,但根据其来源和环境的不同KCs存在多种表型和亚群,各型之间也可相互转化,相对于选择性贴壁法和磁珠分选法,流式细胞分选在多参数细胞亚群识别上有着更好的应用。目前,流式细胞分选广泛应用于血液或脾脏,肺脏等组织器官上目的细胞的筛选[6-8],本实验拟利用密度梯度离心结合流式细胞4色标记分选纯化KCs,探索适宜KCs分选的实验条件并对分选后的KCs进行活性、表型及功能的检测。
1 材料与方法
1.1 实验动物
BALB/c小鼠(10只雄性),SPF级,体质量28~30g,5~6 周龄,购于大学实验动物部。
1.2 试剂与仪器
胶原酶IV、台盼蓝试剂外购;RPMI-1640培养基、胎牛血清外购;OptiprepTM 密度梯液、7-AAD染料、CD45-BV421、CD11b-APC、F4/80-PE、CD86-FITC、CD206AF700抗体外购;FITC荧光微珠外购;小鼠TNF-α、IL-1βELISA试剂盒外购;流式细胞胞仪质控CST微球、Accudrop beads外购;实验所用仪器为BDAriaIII型流式细胞分选仪,配有488nm、561nm、633nm、405nm 4只激光器。
1.3 实验方法
1.3.1肝细胞悬液的制备
胶原酶灌注:小鼠给予100g/mL水合氯醛0.3mL腹腔注射,麻醉后消毒皮毛剪开腹腔,暴露肝脏门静脉,门静脉穿刺并缝合固定,于常温缓慢注入D-Hanks液(无Ca2+,Mg2+,Ph=7.4)至肝脏膨大为原来的2倍大,剪断下腔静脉,肝脏血液被冲出回缩后,继续灌注D-Hanks溶液20mL至肝脏变为白色。将肝脏取出置于平皿中,用含37℃0.05%IV型胶原酶D-Hanks溶液灌注5mL/min 灌注10min,肝组织逐渐松散塌陷,用滴管吹打,使细胞脱落呈悬液状态,200目尼龙滤网过滤收集肝细胞悬液。
1.3.2密度梯度离心分离肝脏非实质细胞
灌注分离出的单细胞悬液,4℃50g离心2~3次,弃沉淀,将上清液500g 离心10min,弃上清,细胞沉淀RPMI-1640 培养基悬浮,清洗一遍并重悬,样品即可用于梯度离心。15mL离心管,依次加入17.6%的OptiprepTM 液5mL,11.2% 的OptiprepTM 液5mL,顶层加PBS悬浮细胞悬液3mL,常温 1400g离心15 min。收集介于17.6% 与11.2% OptiprepTM液之间的非实质细胞[9],加入RPMI-1640 培养基10ml重悬细胞,4℃,1000g 离心10min,弃上清,然后重悬细胞,得到肝脏非实质细胞悬液。
1.3.3流式细胞染色及分选
取分离的细胞5×105细胞,用100mlPBS定容悬浮,Fc-R 阻断剂封闭后依次加入BV421标记的CD45、PE标记的F4/80、APC标记的CD11b抗体各1μl,冰上避光孵育1h,加入PBS离心洗涤2次后弃上清,将细胞悬液加PBS定容至400μl,加入1μl 7-AAD混匀待上机检测分选。流式细胞仪鞘液桶和水桶用75%酒精浸泡消毒4h以上,用纯水冲洗干净,鞘液桶中加入无菌PBS,开机打开FACSDiva软件并运行开机程序,安装85μm喷嘴,分选电压4500V,Freq设定为47.4,调节液滴振幅Ampl值使液流处于稳定状态,第一滴液流断点位置Drop1为345,Gap为9,选中主液流框的sweet spot键,维持液流稳态。上样Accudrop beads微球调节Drop delay数值为30.31,微球在initial或fine tune分选模式下侧液流偏转都达到99%以上。上样后通过空白和阴性对照管圈定目的细胞群,采用purity模式分选7AAD-CD45+CD11b+F4/80+的KCs,接收管中预置0.5mL培养基接收分选所得细胞。
1.3.4分选后纯度及细胞存活率检测
吸取100μL分选后的细胞上流式细胞仪,在原分选方案中检测分选后细胞的纯度。另吸取新提取的细胞悬液按9∶1比例加入0.4% 台盼蓝溶液充分混匀后。加入改良的牛鲍计数板,显微镜下观察细胞见未被染色细胞为活细胞。
1.3.5分选后KC表面标志物的检测
分选后的细胞离心去除上清液PBS,调整体积至100μL,FcR阻断剂封闭后孵育抗体CD206AF700、CD86FITC,根据同型抗体染色情况确定CD206,CD86阳性细胞比例。由于分选后的细胞为CD45BV421、F4/80PE、CD11bAPC阳性的细胞,所以检测时应注意各检测光路荧光补偿的调节。
1.3.6分选后细胞吞噬功能的检测
分选后的细胞离心沉淀去上清,沉淀的细胞用含青链霉素的PRMI1640培养基重悬,调整细胞数量为1×106/mL,取0.5mL细胞接种于12孔板中,置于5%CO2,37℃培养箱中培养12h后,每孔加入2μL FITC标记的荧光微球,继续在培养箱中孵育2h,然后细胞用0.25%的胰酶消化,PBS洗3次,流式细胞仪检测细胞吞噬荧光微球情况。
1.3.7KCs的促炎性反应
分选后的细胞按照5×105接种入12孔板,培养24h后培养基中加入LPS,作用浓度为1μg/mL,分别于0h,8h收集上清液,ELISA法检测TNF-α、IL-1β水平变化。
1.4 统计学处理方法
采用SPSS20.0 软件进行统计分析。计量资料以 ±s 表示,进行单因素方差分析。P <0.05为差异有统计学意义。
2 结果
2.1 流式细胞仪检测分选KCs纯度
密度梯度分离后的细胞经7-AAD染色排除死细胞后,CD45+CD11b+F4/80+占CD45+细胞比例为58.4±3.6%,FACS分选后比例提升为96.1±1.8%,两者比较差异存在统计学意义(P<0.05),见图1。图1A、图1B为分选前后CD45+CD11b+F4/80+各检测门的单次检测结果。
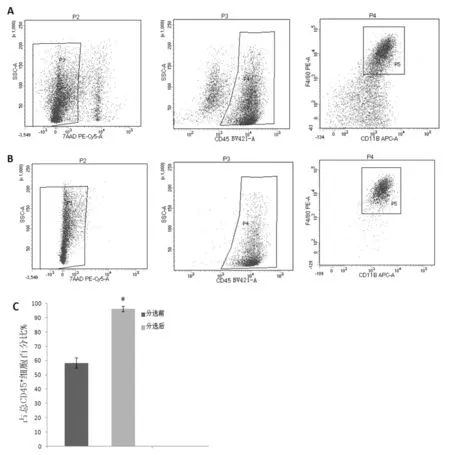
图1 分选前后7-AAD-CD45+CD11b+F4/80+细胞纯度对比A,B.分选前后流式结果图; C.分选前后KCs纯度百分比﹡P<0.05
2.2 分选后KC数量和存活率
平均每只小鼠分选获得KCs细胞数为1.86±0.29×106/小鼠,台盼蓝染色显示分选后细胞存活率为96.5±2.1%,细胞形态良好。
2.3 分选后KC吞噬功能
与FITC荧光微球共孵育2h后,流式细胞仪检测84.7±3.6%的KCs呈现出了吞噬荧光微球的情况,如图2所示。
2.4 KCs表面标志物的检测
流式细胞术检测正常小鼠肝脏KCs结果显示,分选后的CD11b+F4/80+细胞中,CD86的表达为92.3±1.6%,CD206为2.1±0.8%,说明分选后所得为CD86+CD206-细胞群,图3所示。

图2 分选后KCs吞噬荧光微球情况A.正常KCs;B.与荧光微球共培养2 h后的KCs
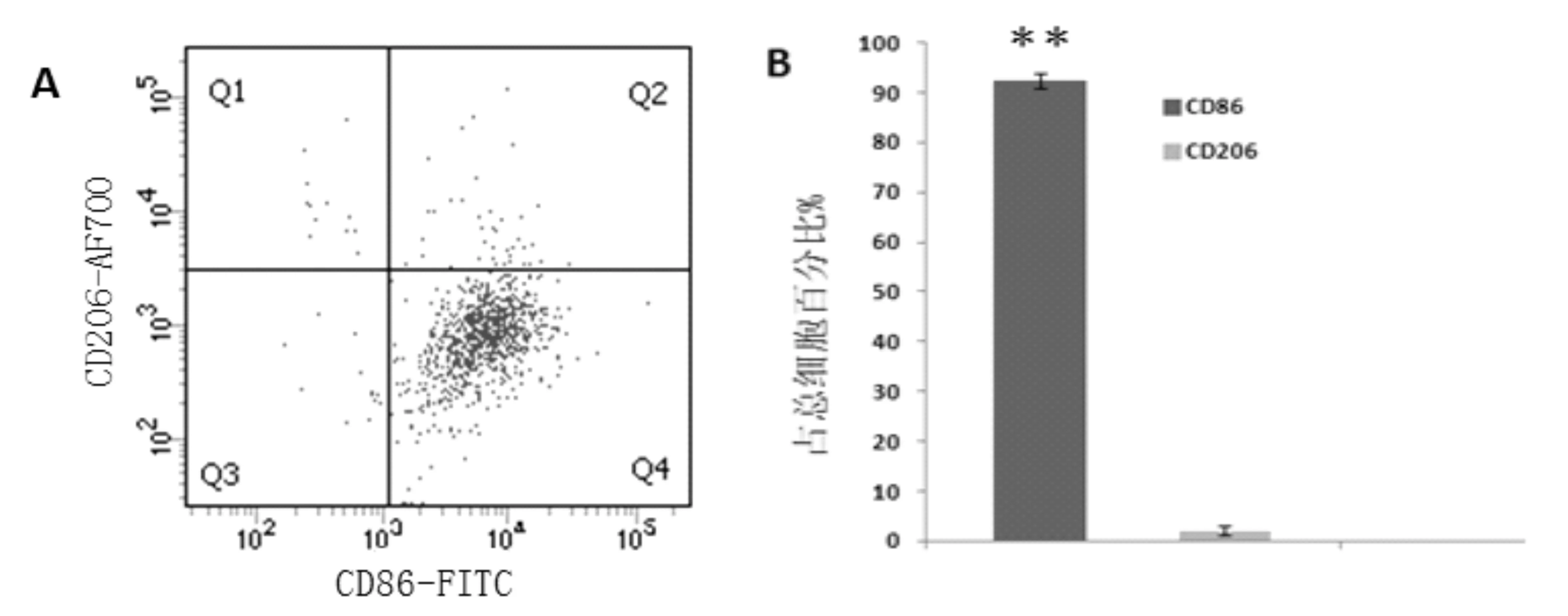
图3 A,B显示KCs分选后 CD86,CD206表达情况﹡﹡P<0.01
2.5 KCs TNF-α,IL-1β表达情况
LPS刺激8h后,KCs被激活,释放炎性因子,细胞上清液中TNF-α、IL-1β均高于刺激前(P <0.001),见表1。

表1 LPS刺激后KCs炎性因子表达水平(x±s,pg/mL,n=3)
3 结论
目前对于KCs的分离纯化除流式细胞分选外,密度梯度离心结合贴壁法或免疫磁珠分选法也是分离KCs分离纯化法,可纯化单一成分的KCs[10]或同时分离肝脏纯化星状细胞、肝实质细胞和KCs[11,12]。相对于流式分选,贴壁法或磁珠分选法的优势在于细胞不受液流压力和电荷刺激的影响,有利于维持细胞活性和状态,缺点在于无法精确定位到某一特定亚群细胞的分选。流式细胞仪配有多激光多检测通路,能够多参数识别目的细胞,也可基于标记物的表达水平进行分选,分选过程中需要根据细胞的大小及对液流压力的耐受能力选择合适的喷嘴。对于FACSAriaⅢ型流式细胞仪分选KCs,选择85μm喷嘴,控制上样速度为8000~10000evts/s,是较适宜的分选条件,得到的KCs细胞数量和活力俱佳。上样速度过高会使得分选回收率下降,造成部分阳性细胞被丢弃,分选速度过低会延长分选时间,不利于维持细胞活性。在流式细胞仪分选设置上,首先要注意调节稳定的液流参数,液流的稳定是保证分选准确进行的基础,分选过程中开启液流“sweet spot”模式,一旦液流不稳定时分选能够自动中止,防止液滴飞溅影响收集管中细胞的纯度。此外,液滴延迟的调节是十分重要,可自动结合手动重复调节确定正确的Drop delay数值,一旦液流参数发生变化,需要重新校准Drop delay。
在制备肝脏单细胞悬液过程需要胶原酶的消化,灌注温度、胶原酶溶液浓度和肝脏灌注胶原酶总剂量对KCs F4/80抗原表达存在影响[13]。消化后的细胞经过密度梯度离心,可以去除大部分的碎片和肝脏实质细胞,但是处理过程中不可避免会产生死细胞,因此在流式染色方案中需要加入识别细胞死活的染料,本实验中采取的是核酸染料7-AAD,利用561nm激光激发可良好地排除死细胞染色,有利于分选后细胞的纯度。
KCs在不同的环境下具有不同的表型,其中M1 和M2b 型巨噬细胞特异性表达CD86,而M2a 和M2c 型巨噬细胞表达CD206 /CD163[14],CD86是T淋巴细胞活化抗原,通过结合CD28或CTLA-4参与共同刺激信号传递,对T淋巴细胞增殖必不可少,CD206是一种甘露糖受体,介导巨噬细胞吞噬抗原,启动免疫反应,实验所用动物为正常小鼠,肝内KCs分选后显示为CD86+CD206-细胞。
KCs是机体防御的主要效应细胞,主要功能是内吞,抗原提呈及分泌生物活性物质,为从功能学角度鉴定KCs,采取了吞噬实验和LPS刺激实验。结果表明,(84.7±3.6)%的细胞吞噬了荧光微球,并且经LPS刺激后TNF-α、IL-1β分泌显著提高,提示KCs分选后细胞功能良好。
本实验所得的细胞为高纯度的KCs细胞,由于抗体特异性,分选后细胞几乎不存在内皮细胞和星型细胞混杂的情况,因此分选后接种培养,1 h后细胞基本贴壁,呈圆形,培养12h后细胞呈多边形,呈现出良好的生长状态,为后续与KCs相关的多种实验研究奠定了细胞学基础。
