谷氨酰胺对重症颅脑损伤患者营养状态 炎症介质释放和肠道屏障功能的影响
2021-12-06刘飞皎杨文涛
罗 凯 曲 军 刘飞皎 杨文涛
1)南阳市第一人民医院,河南 南阳 473000 2)开封市中心医院,河南 开封 475000
重型颅脑损伤(severe head injury,SHI)是外力直接或间接作用于头部造成的颅脑组织结构和功能损伤,常见有颅骨骨折、脑挫裂伤及颅内血肿等,具有病情危急、进展迅速且预后较差等特点[1-3]。SHI 患者高应激和高代谢状态可造成机体神经内分泌功能紊乱和炎症介质大量释放,既往研究表明其基础代谢率(basal metabolic rate,BMR)可达正常人群的2.5 倍,导致能量消耗增加,蛋白质分解增多而处于负氮平衡,从而造成营养失衡和机体免疫功能下降,导致感染风险增加和病情迁延难愈[4-6]。研究认为早期肠内营养(early enteral nutrition,ENN)对促进SHI 患者康复具有重要意义,不仅可有效预防和纠正机体营养不良状态,还可激活患者胃肠道神经内分泌免疫轴,添加益生菌等免疫调节剂,还可刺激细胞免疫功能并调节炎症因子释放,保护肠道黏膜屏障,为营养物质吸收和代谢状况改善创造良好条件,进而有利于提升治疗效果,改善患者临床结局[7-9]。YI 等[10]开展的一项Meta 分析显示,SHI 患者应用补充益生菌的EEN 进行干预可有效降低感染、死亡和胃肠道并发症发生风险,并缩短患者在重症监护室的住院时间。
近年来关于在ENN 中添加谷氨酰胺(glutamine,Gln)的报道逐渐增多,可能对促进胃肠道营养物质吸收和改善机体炎症状态具有积极作用。JIANG 等[11]报道7 项临床随机对照试验共433 例重症急性胰腺炎患者,结果显示采用添加谷氨酰胺的EEN 进行干预有利于增加血清白蛋白水平,降低血清超敏C 反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平和患者死亡风险,同时缩短住院时间。ABE 等[12]以食管癌术后患者为样本进行研究发现,围手术期肠内补充谷氨酰胺可能有助于降低食管切除术后早期手术压力,对根治性食管切除术后免疫抑制状态早日恢复具有积极作用。SHI 患者因BMR升高,容易导致营养失衡,从而对康复造成不利影响,同时由于炎症、应激和消化道菌落失衡等因素影响,采用ENN 干预时营养吸收效果相对较差。本研究观察添加谷氨酰胺的ENN 对SHI 患者炎症介质释放和肠道屏障功能的影响,为改善SHI 患者营养方案和预后提供参考依据。
1 资料与方法
1.1 病例资料选取2017-06—2020-06 南阳市第一人民医院收治的SHI 患者94 例,Gln组47 例和常规组47 例。Gln 组男26 例,女21例;年龄28~57(46.02±8.73)岁,体重指数(body mass index,BMI)19.4~28.6(23.19±2.86)kg/m2,入院时格拉斯哥昏迷量表(Glasgow coma score,GCS)评分4~8(6.04±0.98)分。常规组男30 例,女17 例;年龄32~58(45.76±8.36)岁,BMI 19.8~28.3(23.51±2.49)kg/m2,入院时GCS评分4~8(5.78±1.06)分。纳入标准:(1)根据病史、临床表现及CT等影像检查结果确诊为闭合性SHI;(2)年龄18~60 岁;(3)受伤至入院时间<24 h;(4)GCS 评分4~8 分且持续时间>12 h;(5)患者与家属知情同意;(6)预计生存时间>1个月。排除标准:(1)伴胸腹部严重创伤者;(2)伴严重的系统性疾病者;(3)伴消化道疾病或手术史者;(4)长期营养不良或肥胖患者;(5)伴糖尿病、癌症等严重消耗性或内分泌功能紊乱性疾病者;(6)妊娠期或哺乳期女性患者;(7)伴免疫功能障碍或严重感染者。本次研究经医院伦理委员批准实施。
1.2 治疗方法2组患者均给予脱水、抗感染及维持水电解质平衡等对症支持治疗,入院后24~48 h 内检测胃潴留量<100 mL 时,开始经鼻胃管进行肠内营养支持,所用营养制剂为立适康高蛋白全营养粉(西安力邦临床营养有限公司),按摄入热量25~35 kcal/(kg·d)以匀速和恒温持续泵入,第1 天泵入速度为20~25 mL/h,总量为最大需求量25%,约500 mL,根据胃肠道反应逐渐增量,每4~24 h 增加10~25 mL,3~5 d 增加至80~100 mL/h,总量1 500~2 000 mL,肠内营养持续时间>14 d,期间中断时间需≤24 h,能量不足部分由肠外营养补充。Gln 组在肠内营养基础上采用谷氨酰胺颗粒加入营养制剂一同泵入,剂量0.5 g/(kg·d)。
1.3 观察指标(1)营养指标:采集2 组患者治疗前1 d 和治疗14 d 外周静脉血3 mL,离心后取上清备用。选择罗氏Elecsys-2010 电化学发光免疫分析仪及相应试剂盒测量转铁蛋白(TRF)、白蛋白(ALB)、血清总蛋白(TP)水平;采用软尺测量并计算上臂肌围(AMC)、三头肌皮褶厚度(TSF)。(2)免疫功能:选择免疫比浊法测量血清免疫球蛋白A(immunoglobulin A,IgA)、IgM 和IgG 水平,选择流式细胞仪测量CD8+、CD4+淋巴细胞比例并计算CD4+/CD8+。(3)炎症因子:取上述血清,采用ELISA 法测量白介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)及可溶性髓样细胞触发受体-1(soluble triggering receptor expressed on myeloid cell-1,sTREM-1)表达水平。(4)肠道屏障功能:采用改良酶学分光光度法测量血清D-乳酸水平,定量免疫发光法测量血清降钙素原(procalcitonin,PCT)水平,ELISA 法测量血清二胺氧化酶(diamine oxidase,DAO)水平。(5)并发症:治疗期间监测肝肾功能变化,观察并记录肺部感染、胃肠道不适等并发症发生情况。
1.4 统计学处理数据分析采用SPSS 19.0软件,计数资料以率(%)表示,组间对比行χ2检验,等级资料分析采用Wilcoxon 秩和检验,计量资料以均数±标准差(±s)表示,符合正态分布2 组间比较采用独立样本t 检验,组内不同时间比较采用配对样本t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 2组治疗前后营养水平及GCS评分对比治疗14 d时,2组ALB、TP、GCS、TRF均明显上升(P<0.05),常规组AMC及TSF明显降低(P<0.05),且Gln组ALB、TP、TSF、TRF、GCS、AMC均高于常规组,差异有统计学意义(P<0.05)。见表1、图1。
表1 2组治疗前后营养水平及GCS评分比较 (±s)Table 1 Comparison of nutritional levels and GCS scores between the two groups before and after treatment (±s)

表1 2组治疗前后营养水平及GCS评分比较 (±s)Table 1 Comparison of nutritional levels and GCS scores between the two groups before and after treatment (±s)
注:同组治疗前对比,*P<0.05;与对常规组对比,#P<0.05
组别Gln组常规组GCS(分)6.04±0.98 10.92±1.75*#5.78±1.06 10.14±1.62*时间治疗前治疗14 d治疗前治疗14 d TP(g/L)47.68±5.29 61.32±7.14*#48.06±5.47 56.24±5.93*ALB(g/L)25.36±4.07 34.25±5.82*#25.71±4.13 30.48±4.76*TRF(g/L)1.29±0.31 2.64±0.57*#1.32±0.28 2.17±0.53*TSF(mm)11.42±2.06 11.07±1.94#11.35±3.12 10.23±1.83*AMC(cm)26.87±2.41 26.39±2.08#27.06±2.35 25.41±1.97*

图1 2组治疗前后营养水平及GCS评分比较Figure 1 Comparison of nutritional levels and GCS scores between the two groups before and after treatment
2.2 2 组治疗前后免疫功能指标对比治疗14 d 时,2 组IgG、IgA、CD4+、CD4+/CD8+均明显上升(P<0.05),CD8+均明显降低(P<0.05),且Gln 组IgG、IgA、CD4+、CD4+/CD8+高于常规组,CD8+低于常规组,差异有统计学意义(P<0.05)。见表2、图2。
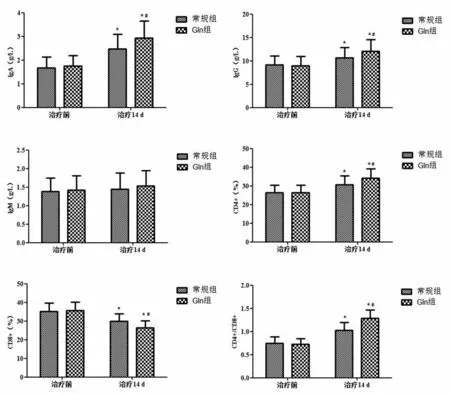
图2 2组治疗前后免疫功能指标比较Figure 2 Comparison of immune function indexes before and after treatment in the two groups
表2 2组治疗前后免疫功能指标比较 (±s)Table 2 Comparison of immune function indexes before and after treatment in the two groups (±s)
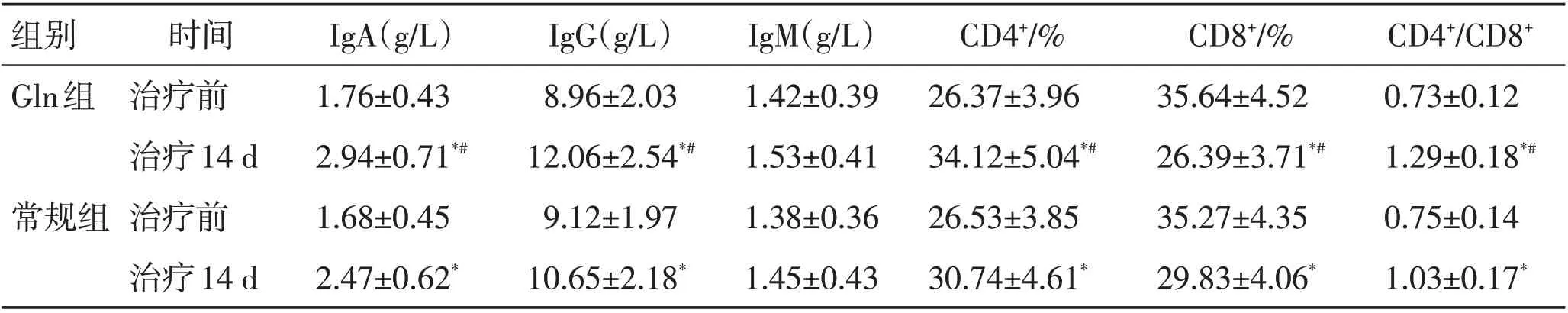
表2 2组治疗前后免疫功能指标比较 (±s)Table 2 Comparison of immune function indexes before and after treatment in the two groups (±s)
注:同组治疗前对比,*P<0.05;与对常规组对比,#P<0.05
组别Gln组常规组时间治疗前治疗14 d治疗前治疗14 d IgA(g/L)1.76±0.43 2.94±0.71*#1.68±0.45 2.47±0.62*IgG(g/L)8.96±2.03 12.06±2.54*#9.12±1.97 10.65±2.18*IgM(g/L)1.42±0.39 1.53±0.41 1.38±0.36 1.45±0.43 CD4+/%26.37±3.96 34.12±5.04*#26.53±3.85 30.74±4.61*CD8+/%35.64±4.52 26.39±3.71*#35.27±4.35 29.83±4.06*CD4+/CD8+0.73±0.12 1.29±0.18*#0.75±0.14 1.03±0.17*
2.3 2 组治疗前后炎症因子水平对比治疗14 d 时,2 组sTREM-1、IL-6、TNF-α均明显下降(P<0.05),且Gln 组sTREM-1、IL-6、TNF-α均低于常规组,差异有统计学意义(P<0.05)。见表3、图3。

图3 2组治疗前后炎症因子水平比较Figure 3 Comparison of the levels of inflammatory factors before and after treatment
表3 2组治疗前后炎症因子水平比较 (±s)Table 3 Comparison of the levels of inflammatory factors before and after treatment in the two groups(±s)

表3 2组治疗前后炎症因子水平比较 (±s)Table 3 Comparison of the levels of inflammatory factors before and after treatment in the two groups(±s)
注:与同组治疗前对比,*P<0.05
组别n Gln组常规组t值P值47 47 TNF-α(pg/mL)治疗前13.84±2.95 14.03±3.16 0.301>0.05治疗14 d 8.27±1.79*9.45±2.04*2.981<0.05治疗前136.28±25.43 134.76±24.82 0.293>0.05 IL-6(pg/mL)治疗14 d 92.17±18.29*104.36±21.54*2.957<0.05治疗前0.64±0.09 0.67±0.08 1.708>0.05 sTREM-1(ng/mL)治疗14 d 0.35±0.06*0.42±0.07*5.205<0.05
2.4 2 组治疗前后肠道屏障功能指标对比治疗14 d时,2组DAO、PCT、D-乳酸均明显下降(P<0.05),且Gln组DAO、PCT、D-乳酸均低于常规组,差异有统计学意义(P<0.05)。见表4、图4。

图4 2组治疗前后肠道屏障功能指标比较Figure 4 Comparison of intestinal barrier function indexes before and after treatment in the two groups
表4 2组治疗前后肠道屏障功能指标比较 (±s)Table 4 Comparison of intestinal barrier function indexes before and after treatment in the two groups (±s)
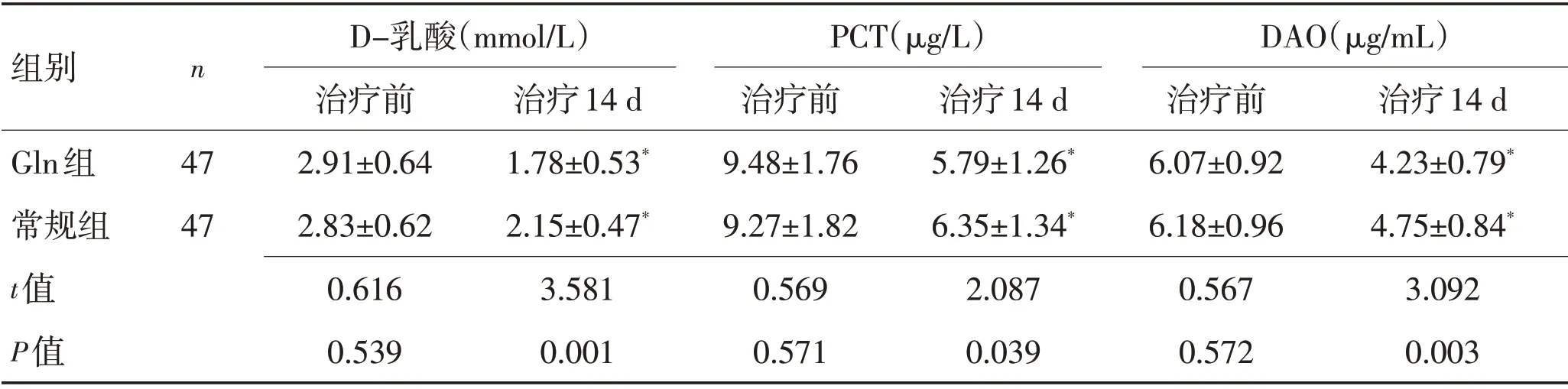
表4 2组治疗前后肠道屏障功能指标比较 (±s)Table 4 Comparison of intestinal barrier function indexes before and after treatment in the two groups (±s)
注:与同组治疗前对比,*P<0.05
组别n Gln组常规组t值P值DAO(μg/mL)治疗14 d 4.23±0.79*4.75±0.84*3.092 0.003 47 47 D-乳酸(mmol/L)治疗前2.91±0.64 2.83±0.62 0.616 0.539治疗14 d 1.78±0.53*2.15±0.47*3.581 0.001治疗前9.48±1.76 9.27±1.82 0.569 0.571 PCT(μg/L)治疗14 d 5.79±1.26*6.35±1.34*2.087 0.039治疗前6.07±0.92 6.18±0.96 0.567 0.572
2.5 2组并发症发生率比较Gln组胃肠道不适及肺部感染发生率均低于常规组,差异有统计学意义(P<0.05)。见表5、图5。
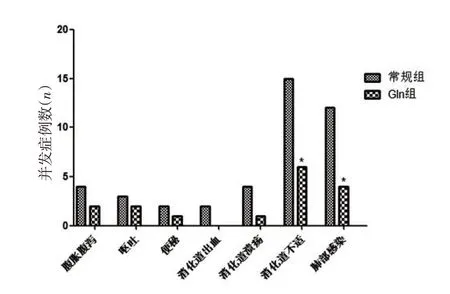
图5 2组并发症发生率比较Figure 5 Comparison of the incidence of complications in the two groups

表5 2组并发症发生率比较 [n(%)]Table 5 Comparison of the incidence of complications in the two groups [n(%)]
3 讨论
颅脑损伤临床常见且致残率和致死率均较高,文献报道其在脑外伤中占比为13.0%~21.0%,发达国家发病率(150~200)/10 万人,中国发病率约为100/10万人,且近年来随着社会城镇化和现代化发展,交通、建筑意外事故发生率上升,颅脑损伤的流行病学特征逐年升高[13-15]。因应激反应和神经内分泌自主调节功能紊乱,SHI 患者机体代谢水平常明显升高,其静息能量消耗较健康人群明显增加,且以蛋白质大量消耗为主,对患者身体康复极为不利[16-18]。早期肠内营养是保护SHI 患者胃肠道结构和功能的重要措施,根据患者病情和机体需求调整营养液配方,为患者提供科学合理的营养支持对改善患者预后具有重要意义。
近年来早期肠内营养在SHI 治疗中逐渐获得重视和提倡,该方案可较好地解决患者意识障碍或不能主动进食的问题,同时还有利于增强胃肠蠕动,改善肠黏膜血液循环,保护肠黏膜屏障结构和功能完整,但胃肠功能障碍等并发症可导致胃肠道消化吸收和免疫功能严重受损,因此在进行肠内营养支持治疗同时应注重保护胃肠道黏膜结构和功能[19-20]。谷氨酰胺是人体非必需氨基酸,但在维持机体代谢、蛋白质合成及免疫调节等各项基本生理活动中均占有重要地位,同时也是维持胃肠道屏障结构和功能的必需物质,SHI患者高代谢水平可导致谷氨酰胺大量消耗,自身合成难以满足机体需求,因此需要通过外源性补充以维持患者代谢和生理功能正常[21-23]。SANTOS等[24]研究认为谷氨酰胺可改善机体负氮平衡,维持胃黏膜屏障功能,减少胃肠道不适和肺部感染等并发症发生。本研究显示,Gln 组患者治疗14 d 时营养水平明显高于常规肠内营养支持的患者,且GCS 评分明显降低,表明在营养液中添加谷氨酰胺更有利于营养吸收并促进患者康复,其原因与谷氨酰胺改善胃肠道功能和机体代谢状态紧密相关。
胃肠动力障碍是SHI常见并发症,因肠道黏膜萎缩和屏障功能减退导致消化吸收功能障碍和机体营养不良,同时引起肠道菌群移位,甚至内毒素释放入血,造成免疫功能紊乱,加重全身炎症反应和脏器功能损害[25-27]。YAN等[28]以硫酸钠盐诱导的结肠炎小鼠为样本进行研究,服用谷氨酰胺可明显减少氧化应激诱导的肠黏膜损伤,且其机制与谷氨酰胺抑制PI3K/Akt 信号通路活性存在密切联系。本研究显示,Gln组治疗14 d时CD4+、IgG、IgA及CD4+/CD8+水平明显高于常规组,CD8+水平明显低于常规组,表明对SHI患者进行肠内营养时添加谷氨酰胺可减轻免疫抑制,明显增强机体免疫功能,对减轻机体炎症反应和防止感染发生具有积极作用。同时检测2 组血清炎症因子水平显示,治疗14 d 时Gln 组sTREM-1、IL-6 和TNF-α均明显低于常规组,提示谷氨酰胺还有利于调节炎症因子合成和释放,可减轻机体炎症反应和脏器损伤,有效防止肠道黏膜萎缩,恢复肠道细胞活性,改善肠道免疫功能和菌落紊乱一致,从而改善患者预后[29-31]。
谷氨酰胺是人体内储备最为丰富的条件性必需氨基酸,可为维持肠黏膜细胞和淋巴细胞正常生理活动和功能提供能量。SHI 患者由于创伤和应激等病理反应常导致体内谷氨酰胺大量消耗,肠黏膜因缺乏能量物质而逐渐萎缩,不仅容易引起营养物质吸收障碍,其屏障和免疫功能也遭受破坏,因此合理补充外源性谷氨酰胺极为必要,有利于维持肠黏膜屏障功能和免疫功能完整,防止肠道菌群移位导致感染和炎症反应加重[32-34]。本研究采用血清DAO、PCT、D-乳酸水平对SHI 患者治疗前后肠黏膜屏障功能进行评估,其中乳酸是肠道细菌发酵的代谢产物,正常情况下极少被吸收,SHI可导致肠道灌注水平降低,造成肠黏膜损伤和通透性增加,使D-乳酸大量进入血液循环,因此监测血中D-乳酸含量可用来评估肠黏膜损伤程度。PCT 不仅是全身炎症反应常用指标,还与肠道渗透性增加和内毒素入血关系紧密。DAO是分布于小肠黏膜上层绒毛中的细胞内酶,当肠黏膜屏障功能损伤时可释放入血,因而也是评价肠道机械屏障完整性和损伤程度的有效指标[35-37]。本研究显示,Gln组治疗14 d 时血清DAO、PCT 和D-乳酸水平明显低于常规组,其原因为谷氨酰胺为肠黏膜细胞代谢必需营养物质,在营养支持基础上补充谷氨酰胺有利于维持肠道黏膜上皮结构完整,有利于维持肠黏膜正常结构和功能正常,降低肠黏膜通透性并增强机体免疫功能,从而减少肠道菌群移位,不仅对提升营养支持水平具有重要意义,还有利于减少感染等并发症,因此可有效改善患者预后[38]。另外,本研究显示Gln组胃肠道不适及肺部感染发生率均低于常规组,其原因与谷氨酰胺有利于保护肠黏膜功能和增强免疫力关系密切,表明谷氨酰胺辅助肠内营养治疗SHI有利于减少并发症,从而提升营养支持水平并促进患者康复。
在SHI 患者肠内营养中添加谷氨酰胺可有效保护肠黏膜屏障结构和功能,改善机体免疫功能,抑制炎症介质释放,减少感染率,对维持机体营养和促进患者康复具有重要临床价值。
