热量限制对急性脑梗死患者神经功能的影响
2021-12-06黄亚男刘恒方郭亚培
黄亚男 张 敏 刘恒方 郭亚培 张 炎
1)武警上海市总队医院,上海 200000 2)郑州大学第五附属医院,河南 郑州 450052
急性脑梗死(acute cerebral infarction,ACI)已成为中老年人致死致残的主要原因之一,近年来脑梗死一跃成为除恶性肿瘤外病死率最高的疾病。在ACI的临床治疗上,以恢复脑组织灌注为主,现有的途径包括通过药物溶栓以及血管内介入治疗,然而只有少数ACI患者有机会使用到急性治疗,除患者本人因素外还可能因ACI 症状是非致残抑或因患者存在溶栓禁忌证,导致只有大概25%的ACI患者符合药物溶栓的条件,另外约10%的患者符合血管介入治疗的指征,然而血管介入治疗只适于大血管闭塞引起的ACI,且操作需要动脉成像确定闭塞的位置,给临床实施造成一定困难。研究发现,脑梗死造成脑损害的病理过程伴随着脑源性神经因子和炎症细胞因子的异常表达[1]。研究发现脑源性神经因子和炎症细胞因子的水平与卒中的预后及神经功能恢复密切相关[2-3]。LUO等[4]发现急性脑梗死患者血清中脑源性神经营养因子(BDNF)水平相对较低,而BDNF可参与神经细胞分化及增殖过程,并降低内外源性因子对神经元损伤,一方面促进神经递质合成,另一方面促进突触再生,从而改善神经功能。转化生长因子-β(TGF-β1)是一类可调节和刺激细胞增殖分化的细胞因子,也是一类重要的抗炎因子,对神经元主要起保护作用[3]。这两类因子在急性脑梗死的进展和预后中都扮演了重要的角色,与患者的预后密切相关。而热量限制(calorie restriction,CR)是指在不造成患者营养不良的情况下,使机体每日热量摄入维持在较低水平的方法[5]。被认可的方法主要有两种,一是减少每日热量摄入;二是间歇性饥饿,又称隔日饥饿疗法。研究发现热量限制可延长寿命,如先前在包括酵母、线虫、果蝇、小鼠和非人类灵长类动物在内的大量物种中所显示的那样[6]。如今,CR已广泛应用于肿瘤、癫痫等疾病患者中,并取得显著疗效[5-9],而在卒中患者后给予热量限制疗法的研究却罕见。本研究拟探讨急性脑梗死后立即给予热量限制对患者神经功能及细胞因子TGF-β1和BDNF的影响。
1 资料与方法
1.1 纳入及排除标准收集2019-01—2020-04 于郑州大学第五附属医院住院确诊为急性脑梗死并资料完整的病人60 例,均按纳入标准及排除标准执行。纳入标准:(1)首次发病;(2)72 h内的颈内动脉系统脑梗死,诊断均按照《中国急性缺血性脑卒中诊治指南2018》公布的标准执行[10];(3)有明确神经定位体征;(4)脑梗死病因为大动脉粥样硬化型;(5)无意识障碍。排除标准:(1)椎基底动脉系统脑梗死;(2)脑栓塞或疑似伴心房纤颤、心脏瓣膜疾病或感染性疾病;(3)短暂性脑缺血发作(TIA);(4)同时存在精神疾病史或恶性肿瘤患者;(5)存在严重其他系统疾病,如肝、肾功能异常;(6)出血性疾病或消化道溃疡患者;(7)妊娠期及哺乳期妇女;(8)不能配合完成临床评估的患者。按随机数字表法分为热量限制干预组及对照组,最终完成57 例,干预组3例依从性较差退出研究。
本研究符合医学伦理学标准,经郑州大学第五附属医院伦理委员会审查通过,伦理审查编号:KY2020001。
1.2 一般资料干预组男13 例,女14 例;年龄(60.56±6.92)岁;BMI(23.01±1.70)kg/m2;吸烟9例,饮酒12例;基线血糖(7.98±2.75)mmol/L,基线收缩压(165.83±6.45)mmHg,基线舒张压(95.67±9.61)mmHg;TC(4.46±1.25)mmol/L,HDL-C(1.18 ± 0.25)mmol/L,LDL-C(2.60 ±0.91)mmol/L;基线NIHSS 评分(10.53±3.22)分;基线梗死体积(43.15±20.03)cm3。对照组男14 例,女16 例;年龄(62.12±8.61)岁;BMI(22.03±1.56)kg/m2;吸烟14例,饮酒15例;基线血糖(8.98±2.35)mmol/L,基线收缩压(156.38±5.45)mmHg,基线舒张压(90.17±8.76)mmHg;TC(4.86±1.53)mmol/L,HDL-C(1.08±0.19)mmol/L,LDL-C(2.89 ± 0.98)mmol/L;基 线NIHSS 评分(9.90±2.88)分;基线梗死体积(45.45±19.23)cm3。2 组患者基线资料比较差异均无统计学意义(P>0.05)。
1.3 方法
1.3.1 干预方法:干预组在对照组治疗的基础上加用热量限制饮食干预,拟定专门的热量控制方案,保证热量限制饮食干预组患者每日摄入所需标准热量的70%[11]。经由患者及家属配合,并确保患者饮食的营养平衡情况下,降低热量的摄入量。
干预组摄入热量的计算采用如下公式:成人每日所需总能量=基础代谢消耗量与体力活动水平(physical activity level,PAL)的乘积[12],基础代谢消耗量的使用Harris-Benedict公式计算[13]。受试者均维持轻度体力劳动水平,据中国营养学会的成年人体力活动水平分级,女性PAL=1.56,男性PAL=1.55。限制饮食的措施:由营养科结合中国居民膳食平衡宝塔统一进行配方膳食,按照每日能量需求的70%干预患者饮食习惯,保证营养比例均衡,按照碳水化合物55%、脂肪30%、蛋白质15%的比例[14]进行配餐。每日监测生命体征情况,以确保受试者安全,进行为期3个月的观察期。
1.3.2 检测血清学指标:采集患者入院第2天及3 个月后清晨空腹状态下肘静脉血约5 mL于EDTA 抗凝管中,以2 500 r/min 速度离心后取上清夜,置于EP管中并做好标记,于—80 ℃的冰箱冻存待检。使用ELISA 法检测干预前后血清中TGF-β1、BDNF浓度,试剂购于上海雅吉生物有限公司,所有操作均严格按照试剂盒说明进行。
1.4 统计学方法所有数据均采用SPSS 21.0分析软件处理,符合正态分布的资料用均数±标准差(±s)表示,组间样本均数比较采用独立样本t检验,检验水准α=0.05。
2 结果
2.1 2组干预前后血清神经损伤指标比较干预前2组血清TGF-β1、BDNF水平差异无统计学意义(P>0.05),干预后上述指标比较均有显著变化,其中干预组血清TGF-β1、BDNF水平显著高于对照组(P<0.05);组内比较发现,干预前后2组血清TGF-β1、BDNF水平比较差异均有统计学意义(P<0.05)。见表1、图1~2。

图1 干预前后2组血清TGF-β1水平比较Figure 1 Comparison of serum TGF-β1 levels in the two groups before and after intervention
表1 2组患者干预前后血清神经损伤相关指标比较 (±s)Table 1 Comparison of related indexes of nerve injury before and after intervention in the two groups (±s)
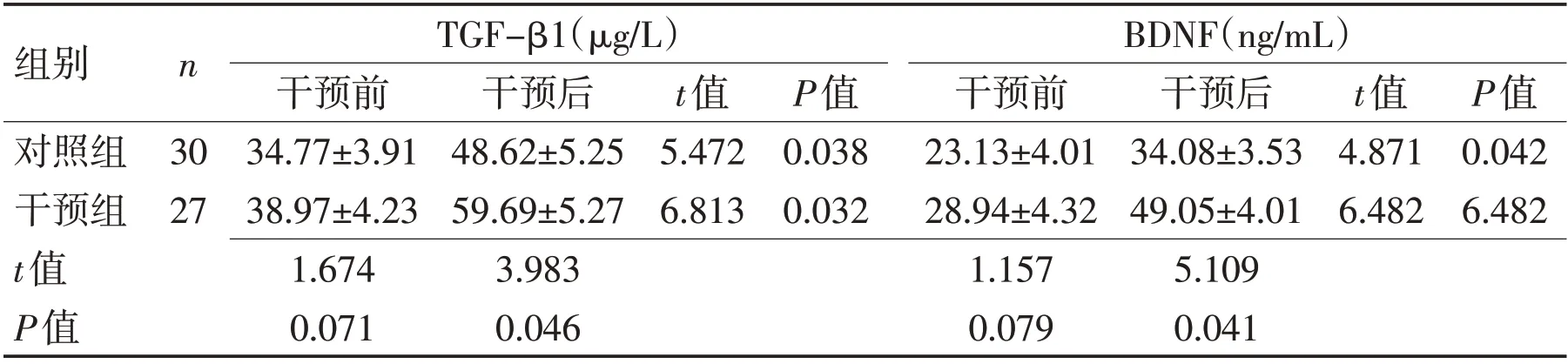
表1 2组患者干预前后血清神经损伤相关指标比较 (±s)Table 1 Comparison of related indexes of nerve injury before and after intervention in the two groups (±s)
组别对照组干预组t值P值n BDNF(ng/mL)30 27 TGF-β1(μg/L)干预前34.77±3.91 38.97±4.23 1.674 0.071干预后48.62±5.25 59.69±5.27 3.983 0.046 t值5.472 6.813 P值0.038 0.032干预前23.13±4.01 28.94±4.32 1.157 0.079干预后34.08±3.53 49.05±4.01 5.109 0.041 t值4.871 6.482 P值0.042 6.482
2.2 2 组干预前后NIHSS 评分比较组内比较,2 组干预后NIHSS评分均较干预前显著下降(P<0.05);干预3 个月后,干预组NIHSS 评分明显低于同期对照组,差异有统计学意义(P<0.05)。见表2、图3。

图2 干预前后2组血清BDNF水平比较Figure 2 Comparison of serum BDNF levels in the two groups before and after intervention
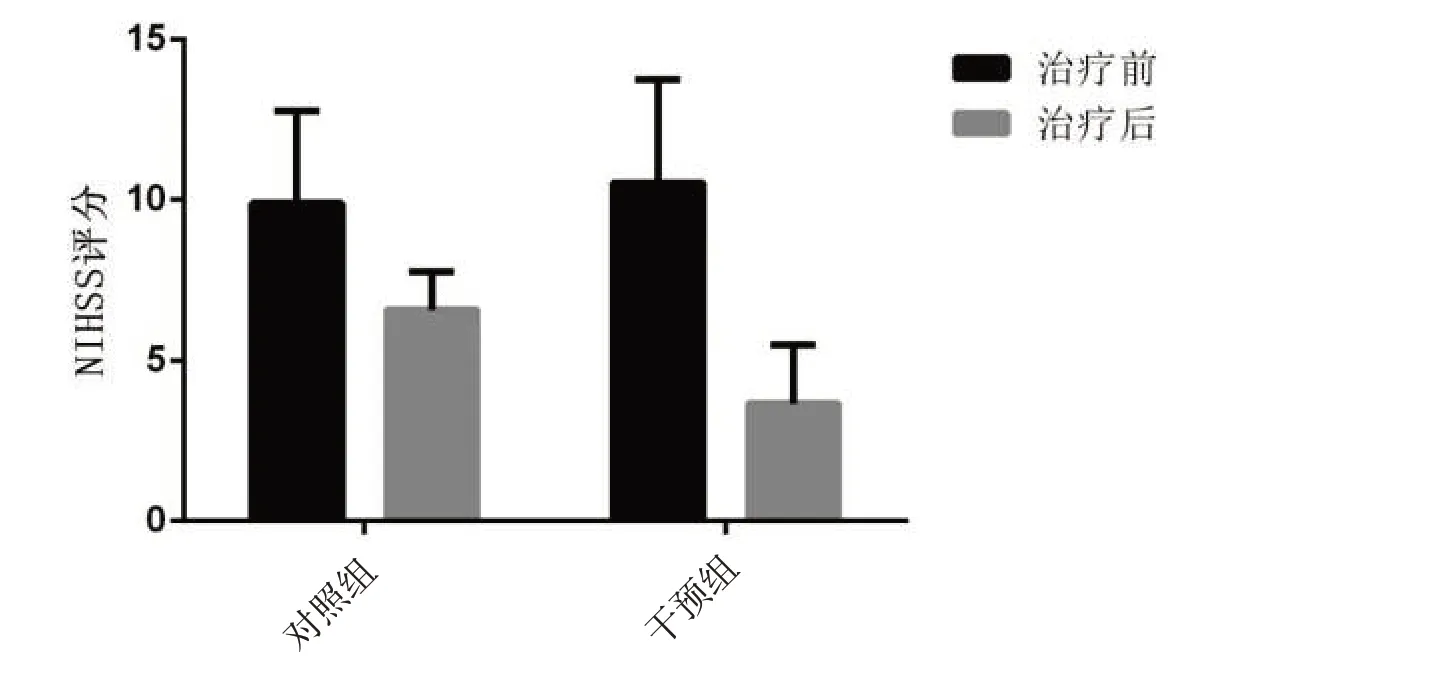
图3 干预前后2组NIHSS变化比较Figure 3 Comparison of NIHSS changes in the two groups before and after intervention
表2 2组患者干预前后NIHSS变化比较 (±s)Table 2 Comparison of NIHSS changes before and after intervention in the two groups (±s)

表2 2组患者干预前后NIHSS变化比较 (±s)Table 2 Comparison of NIHSS changes before and after intervention in the two groups (±s)
组别干预组对照组t值P值n 27 30治疗前10.53±3.22 9.90±2.88 1.967 0.060治疗后3.67±1.83 6.60±1.15 5.917 0.039 t值7.649 6.143 P值0.028 0.036
3 讨论
人口老龄化是脑血管疾病的潜在危险因素,在老年人中,卒中的发生率随着年龄的增长显著增加,卒中是导致永久性残疾的常见原因,也造成个人、家庭、社会的成本增加。同一患者随着其脑梗死发病次数的增多,其神经功能受损程度就会越严重,将会直接影响患者的生活能力、劳动能力,导致社会能力显著下降,生活质量也随之变差。尽管脑血管病的临床诊治技术有所进步,但大多数患者仍表现出不同程度的神经功能缺损。这些功能缺陷可能会影响未来的工作甚至生活能力,降低生活质量。随着人们生活及饮食方式的改变,在世界范围内,卒中发生率呈现出急剧增加的趋势。尽管一些药物对ACI患者有治疗效果,但致残率及致死率仍在升高。CR对疾病的影响是一大热点,而CR 对机体的有利作用也正在得到越来越多学者证实[15-17]。学者们发现,对急性局灶性脑缺血的小鼠给予CR干预后能明显改善其机体神经功能损伤程度[18],机制可能涉及抗氧化应激、神经及血管再生及循环应激激素调节等多个方面[19]。
本研究前瞻性纳入30 例未饮食干预的ACI患者和27例热量饮食干预的ACI患者,从营养角度来看,这可能不是卒中患者的理想策略。为了规避营养缺乏带来的弊端,将热量限制组患者低卡路里饮食进行均衡计划,使得该饮食与正常卡路里饮食具有相同的脂质、蛋白质、微量营养素和维生素含量,并通过对其神经损伤指标检测发现,抑炎因子TGF-β1及脑源性神经营养因子BDNF 均较治疗前升高(P<0.05),发现热量限制干预后TGF-β1 及BDNF不同程度的激活,且抗炎细胞因子及神经营养因子较对照组升高更明显。本研究发现,适度热量限制饮食可能提供了神经保护作用。在一项基础研究中同样发现低热量饮食的动物大脑和肝脏中显示出促进生存、代谢相关以及抗氧化反应的一些特征,考虑这可能是有助于ACI好转的潜在原因,并在梗死病灶周围的脑组织中发现多效性生长因子BDNF 和NAD依赖性脱乙酰酶以及长寿蛋白Sirt1的表达,这些因子在稳定线粒体功能和调节代谢中有不可或缺的作用[20]。另一项基础研究发现,在56天的低热量饮食后,Gpx3(一种降解过氧化氢的过氧化物酶)和谷氨酰胺合成酶水平升高,在蛋白水解条件下将其他有毒的铵转移到谷氨酸中,从而催化氨基酸谷氨酰胺的形成,减轻了自由基的神经毒性作用,热量限制的有利作用进一步显现[21]。一项在大脑中动脉闭塞前7~30 d小鼠进行低热量饮食对其神经功能影响的研究发现,这种卡路里含量减少60%的饮食使小鼠在饮食暴露期间体质量30 d 内下降约20%;在更低热量饮食中,小鼠的营养状况表现为显著受损。部分小鼠表现出肠道吸收不良紊乱综合征,粪便苍白,有血垫物、增粗等现象,说明热量限制的程度在一定范围内能使收益最大化,在人类的热量限制研究中也可能存在类似的效应,具体限制程度有待进一步验证。14 d 的低热量饮食暴露可显著减少急性大脑中动脉闭塞后小鼠24 h 后神经功能缺损评分、梗死体积、神经元损伤和血-脑屏障破坏的程度[22]。在人类早期关于热量限制的研究中,将肥胖人群分为正常热量和低热量饮食组的随机对照试验中发现,热量限制减少能量损耗并有效降低脂质的过氧化,数据显示,人类对低热量饮食有持续代谢适应性,此作用与人类氧化应激的减少及炎症指标的降低密切相关,且不会对人体造成危害[23]。在另一项研究中发现,14 d的低热量饮食干预可减少大脑中动脉急性梗死后24 h 的神经功能缺损、梗死体积、神经元损伤和血-脑屏障破坏,发病开始后的低热量饮食也可减少急性脑卒中的缺血性损伤,组织化学研究发现低热量饮食显著减少了梗死体积,这与本研究发现的神经保护作用类似[24]。研究证明全脑缺血后开始的热量限制不影响神经功能恢复和神经元存活,并有有益作用。DIRK等[25]研究发现,给予8%的CR 能显著改善机体各种生化指标和炎症标志物,这与本研究中发现的热量限制改善炎症指标的结果相似。而对卒中患者神经功能的改善可能因ACI的发生发展与激活机体炎症反应和氧自由基的产生密切相关[26-27]。TGF-β主要调节因子,可驱动多种细胞死亡和促炎信号通路,使其成为治疗缺血性脑卒中有希望的治疗靶点[28]。TGF-β1 是一种多功能的多效细胞因子,是脑缺血病理生理过程中重要的免疫抑制因子。作为一种抗炎细胞因子,TGF-β1 可以在中枢神经系统中将小胶质细胞从激活状态转变为静息状态[29],在小胶质细胞/巨噬细胞中的表达以旁分泌方式调节星形胶质细胞纤溶酶原激活物抑制剂1(PAI-1)的表达,从而促进内源性组织型纤溶酶原激活物的活性并诱导神经元恢复过程,被认为是一些神经营养因子[30]。本研究选取的TGF-β1 不仅可反映脑梗死患者的预后,同时发现其有促进血管新生、抗炎、减轻脑水肿等作用,脑损伤后其血清水平升高密切影响侧支循环的形成[31-32],热量限制组明显改善了TGF-β1 的表达。另一指标脑源性神经营养因子与神经元的存活密切相关,是神经系统中重要的调节蛋白之一。目前BDNF 是神经内科应用较多的血清学指标之一,也是脑发育过程中最丰富的神经营养因子,其功能体现在能增强突触之间的传递性、介导神经元的存活以及改善神经可塑性等方面[33]。BDNF 不仅能使神经胞体重新发出突起,促进轴突以及树突的出芽,还能将神经递质由胞体顺行运输至轴突末端进行释放并被次级神经元摄取利用,增强了突触间递质的信息释放和信号转导,参与了突触可塑性的过程。因此,BDNF也被称为神经元受损伤到发生病变时促使其存活和再生的必需因子[34]。研究发现BDNF 通过影响神经纤维再生,从而促进神经功能恢复。临床一些药物治疗机制即通过增加BDNF 水平进而有效控制疾病的发生进展[35-36],改善神经功能。BDNF 目前被广泛作为潜在药物分子[37]用来治疗包括脑梗死等多种神经系统疾病。研究发现敲除BDNF 基因或抑制其表达梗死面积表现为较正常表达组扩大的结果,应用BDNF治疗脑梗死,可促进神经功能恢复,进而改善卒中预后[38]。BDNF 的作用方式为先与其受体结合而后激活特定信号传导途径,同时对转录因子结合的去氧核糖核酸的活性造成直接影响[39],使机体的中枢神经系统避免受到代谢性和兴奋性氨基酸毒性的损伤,且血清BDNF可减少体内氧自由基聚集,调节突触传递和突触可塑,减轻对神经元的损害[40-41],从而发挥作用。本研究发现CR能明显提升ACI患者体内的释放水平。据此推测联合适度热量限制可能通过抑制炎症反应及增加机体的神经营养因子水平改善患者的神经功能。本研究发现,合理CR 饮食不易出现不良反应。相对于CR,过度营养给予造成大量医疗资源浪费,同时也增加患者及其家庭经济负担。本研究的优势在于控制良好的营养评估和广泛的行为测试和免疫组织化学的分析使用,最大程度控制对研究影响较大的变量因素,如血管危险因素(高脂血症或肥胖)或合并疾病(如糖尿病)。本次研究也存在不足,如还应考虑不同类型饮食改变(包括减少蛋白质的饮食)的后果、剂量反应关系、时间和潜在机制的研究,这些可能为饮食改变如何影响不同脑卒中环境中的缺血性脑损伤和缺血后脑重塑提供具有临床意义的见解。除本研究设计的CR 饮食外,还应考虑不同类型的饮食改变(包括减少蛋白质的饮食)的作用是否会通过代谢产物的不同而产生不同的作用以及保护作用与限制热量程度的关系和潜在机制的研究等。临床上ACI 患者的治疗需结合患者的个体病情特征,进行个体化、针对性的有效治疗,而针对ACI 患者的多方式的结合治疗可能会是未来的发展方向。CR的有利作用亟待进一步的临床验证,设计方案更需因人而异。这些研究可能为饮食改变如何影响卒中环境中的缺血性脑损伤和缺血后神经功能重塑提供具有意义的见解。
