头颈部动脉粥样硬化狭窄与急性缺血性脑卒中患者7 d 神经功能恶化的相关性
2021-12-06徐宇浩
何 悦 徐宇浩 杨 溢 于 明
江苏大学附属医院,江苏 镇江 212001
神经功能恶化(neurologic deterioration,ND)可见于13%~41%急性缺血性脑卒中(acute ischemic stroke,AIS)患者[1-2]。ND严重损害AIS患者的日常生活能力,且与其卒中后心脑血管事件复发及死亡密切相关[1],给家庭和社会带来沉重负担。因此,尽可能识别导致ND 的病因,对合并这些危险因素的AIS 患者给予相应处理,以减少其出现ND 的概率,成为当前的一个研究热点。目前证实,AIS患者的年龄、性别、血糖水平、血压[1]、卒中严重程度、症状性出血转化、梗死灶体积[3]、恶性脑水肿[4]、炎症[5]、血脂代谢[6]等均为ND 的危险因素。同时,梗死后脑血管血流动力学和灌注异常也是导致ND 的关键原因。由于存在显著动脉粥样硬化狭窄(atherosclerotic stenosis,AS),而这些病灶可能严重影响AIS 患者的脑灌注,因此大动脉粥样硬化型(large-artery atherosclerosis,LAA)卒中也被证实是ND的一个独立相关因素[1,7]。LEE等[8]首次分析了ND患者AS 病灶的分布,发现基底动脉或大脑后动脉AS与ND独立相关,但该研究仅关注了颅内AS 病灶,而严重狭窄或堵塞的头颈部血管可促进侧支循环的建立[9],故颅外AS 也会对AIS患者的脑灌注产生影响[10]。因此,颅外AS可能是ND的一个潜在危险因素。目前,国内外尚缺乏关于颅内外总AS特征与ND关系的研究。另外,目前对于ND时间窗的定义仍不明确。既往研究认为,起病后3 d、5 d 或1 周内出现的神经功能缺损症状加重均可定义为ND[11-12]。2020年进行的一项大型临床研究纳入29 446 例急性脑缺血患者发现,这些患者在起病7 d后几乎不再出现ND[1]。因此,近年来的研究更倾向于将ND定义为卒中后7 d内出现的症状加重[13-14],以尽可能将卒中后出现ND的所有患者纳入分析,从而更加详尽地发现导致ND风险增加的因素。
本研究选取241例急性缺血性脑梗死患者为研究对象,旨在分析头颈部AS特征与7 d ND的相关性,以期在临床工作中能通过常规开展的头颈部血管检查早期识别可能出现ND的患者。
1 对象与方法
1.1 研究对象选取2019-07—2019-12 连续收住在江苏大学附属医院卒中单元的AIS患者为研究对象。纳入标准:(1)年龄18~80 周岁;(2)根据神经影像学检查符合AIS诊断[15];(3)发病24 h 内;(4)根据TOAST 分型分为LAA或小动脉闭塞型。排除标准:(1)心源性栓塞;(2)动脉夹层、血管炎、烟雾病等其他病因导致的卒中;(3)恶性肿瘤或血液疾病导致的高凝状态;(4)其他脏器功能不全。本研究经江苏大学附属医院临床试验伦理委员会批准,并且所有受试者均签署知情同意书。
1.2 方法
1.2.1 收集一般资料:患者入院后获得人口统计学信息和危险因素(高血压、糖尿病、高脂血症、吸烟、饮酒、肥胖、既往脑血管疾病)。若患者吸烟≥1 支/d 至少6 个月视为吸烟[16];男性饮酒>2 标准杯/d 或女性>1 标准杯/d视为饮酒[17]。入院时体重指数≥30 kg/m2视为肥胖[18]。
1.2.2 评估头颈部AS:颅内血管经头颅MRA,根据华法林-阿司匹林症状性颅内疾病研究试验方法(Warfarin-Aspirin Symptomatic Intracranial Disease Study Trial method,WASID)评估[19];颅外血管经彩色多普勒超声,根据北美症状性颈动脉内膜切除术试验方 法(North American Symptomatic Carotid Endarterectomy Trial method,NASCET)评估。纳入评估的颅内血管包括:双侧颈内动脉颅内(intracranial segment of the internal carotid artery,I-ICA)段、大 脑 前 动 脉(anterior cerebral artery,ACA)A1/A2 段、大脑中动脉(middle cerebral artery,MCA)M1/M2 段、大脑后动脉(posterior cerebral artery,PCA)P1/P2段、椎动脉颅内段(intracranial vertebral artery,I-VA)和基底动脉(basilar artery,BA);颅外血管包括:双侧颈内动脉颅外段(extracranial internal carotid artery,E-ICA)、椎动脉颅外段(extracranial vertebral artery,E-VA)和颈总动脉(common carotid artery,CC)。AS≥50%定义为狭窄或闭塞[20]。
1.2.3 通过NIHSS 评估卒中严重程度:患者入院后第1 d、3 d、7 天分别进行NIHSS 评分。根据住院后7 d 症状与入院初的变化将患者分为稳定组(NIHSS 评分较基线下降<2 分)、缓解组(NIHSS 评分较基线下降≥2 分)和ND组(NIHSS评分较基线增加≥1分)。
1.3 统计学分析采用SPSS 25.0 软件进行统计学分析。通过χ2检验或费舍尔精确检验(Fisher’s exact test)比较分类变量。连续变量以均值±标准差(±s)表示,非正态分布连续变量则以中位数(四分位间距)表示。单因素ANOVA 检验比较多组间连续变量。单因素分析中P<0.05 的临床特征纳入多因素Logistic 分析模型,分析与7 d 预后相关的AS特征。所有检验均为双侧,以P<0.05为差异有统计学意义。
2 结果
2.1 受试者一般情况共241 例AIS 患者连续纳入横断面研究。年龄(59.1±12.0)岁,其中71.4%为男性。183 例(75.9%)为LAA 型卒中,入院NIHSS 评分为(3.8±3.9)分。40 例(16.6%)接受静脉溶栓治疗。7 d 内153 例症状稳定,67例症状缓解,21例出现ND。3组比较,ND 组年龄、饮酒率和肥胖率最高(P<0.01),起病时间最短(P<0.001);缓解组入院NIHSS评分最高(P<0.001)。见表1。
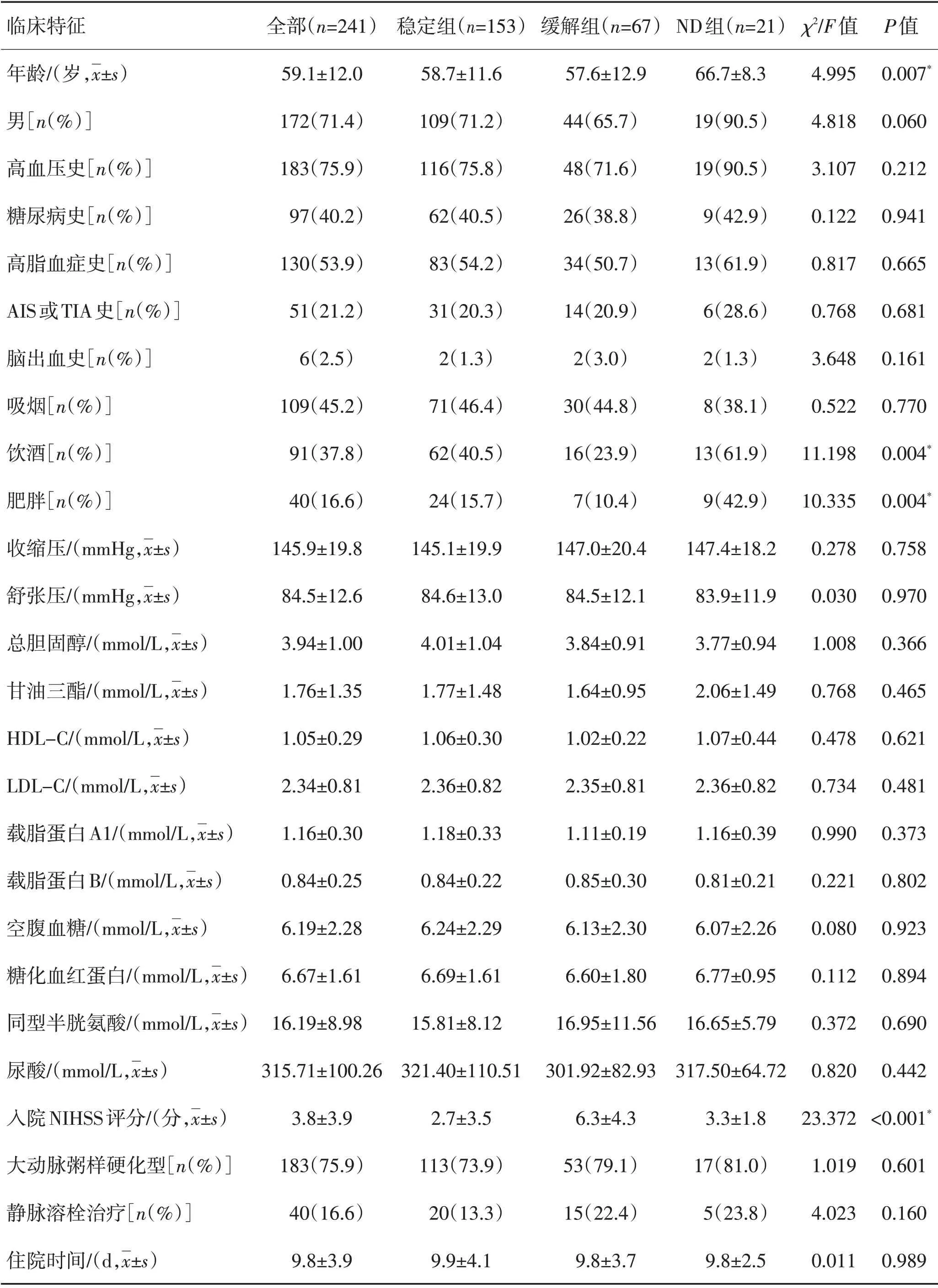
表1 各组患者的危险因素比较Table 1 Comparisons of risk factors in different groups
2.2 受试者AS 特征AS 数目:3 组中ND 组颅内AS 数、头颈双侧均有AS 的比率、前后循环均有AS 的比率、头颈部总AS 数均最高(P<0.05)。见表2。
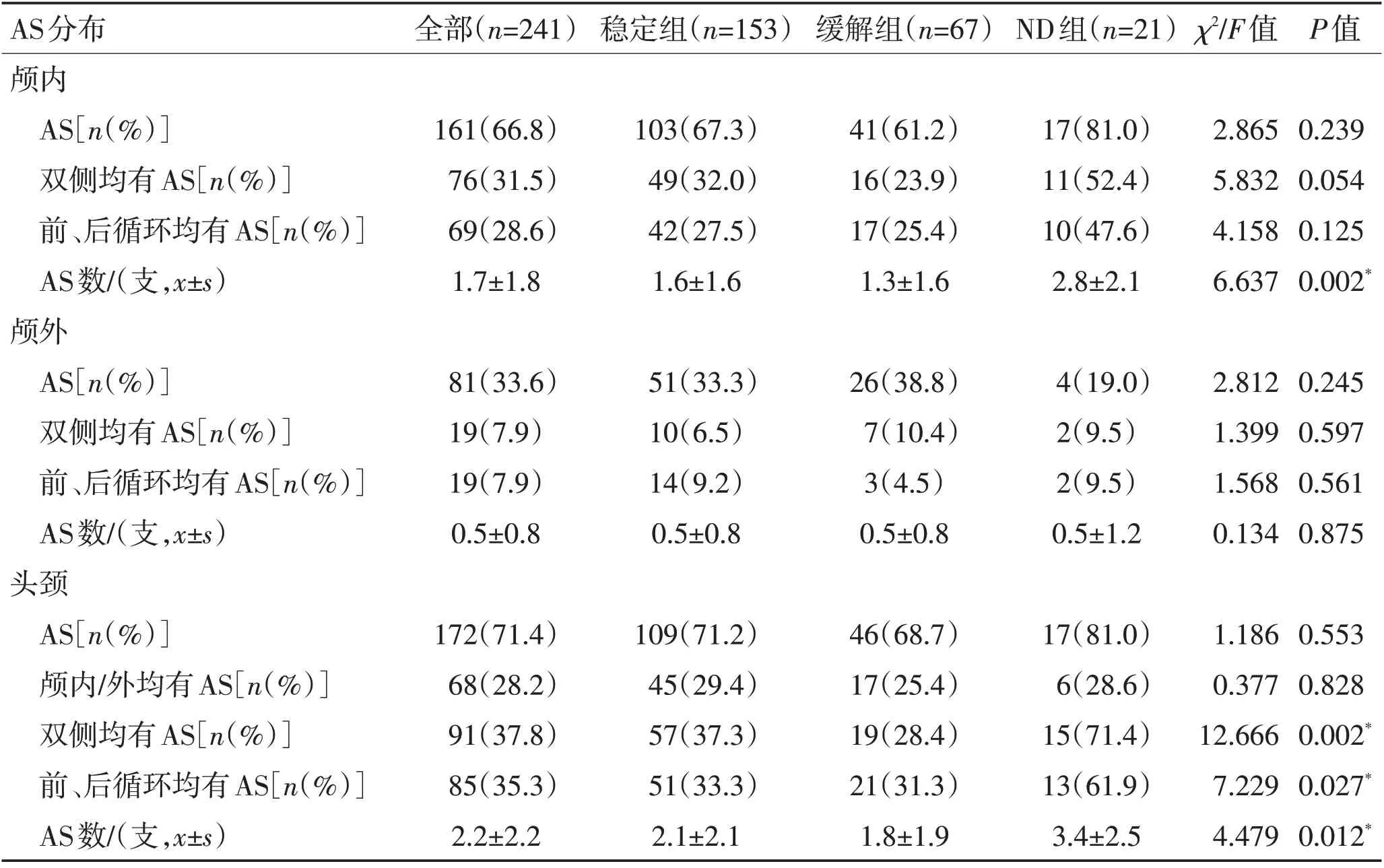
表2 各组患者的AS分布Table 2 Distribution of AS in different groups
受累动脉:所有受试者AS出现在MCA的频率最高,其次是PCA、I-ICA、I-VA、E-ICA、E-VA。ND 组AS 出现 在PCA、I-VA、双侧I-VA、BA频率最高(P<0.05)。见表3。
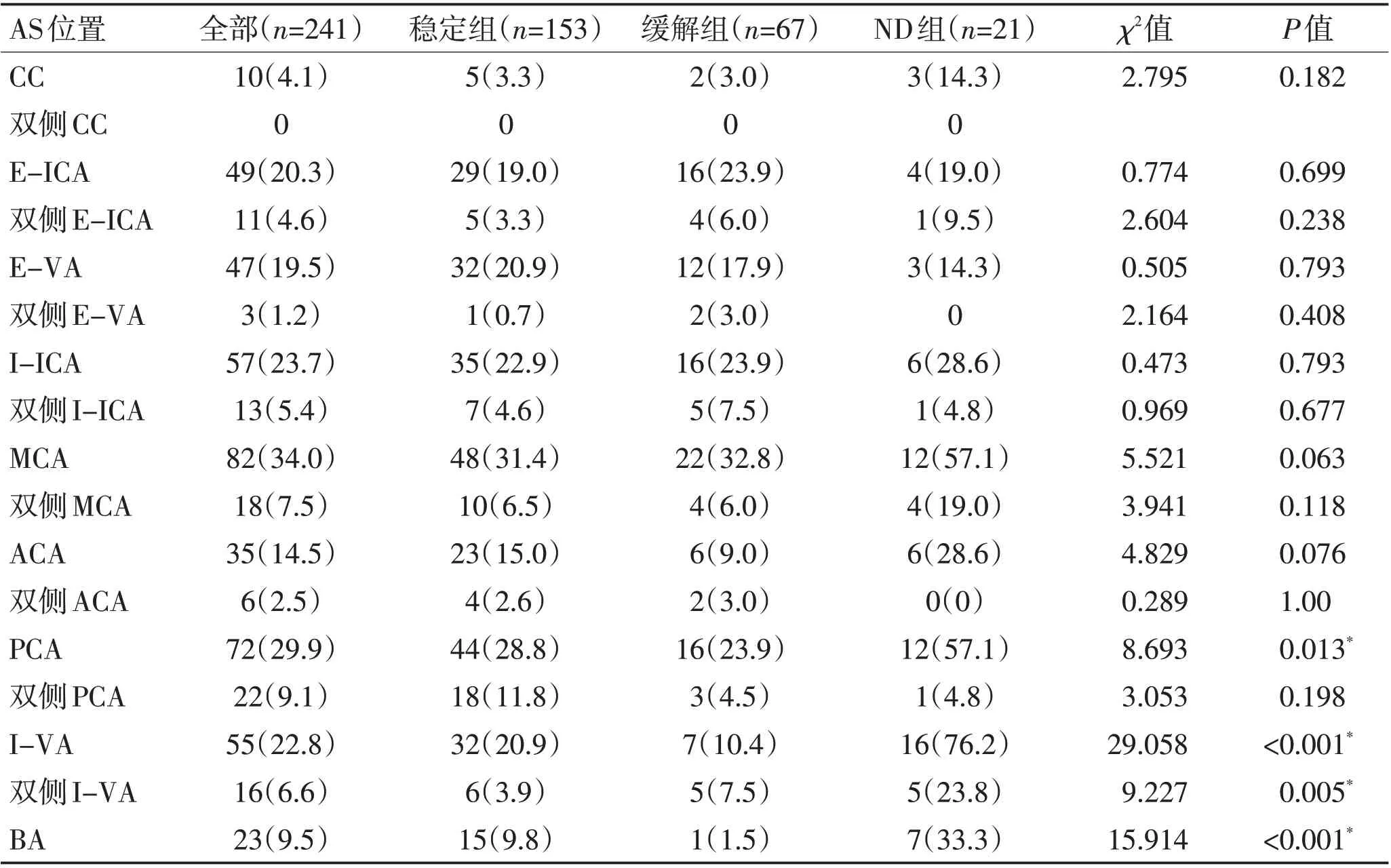
表3 各组患者AS位置 [n(%)]Table 3 Sites of AS in different groups [n(%)]
2.3 AS特征(AS数目与AS分布)与ND之间的关联将AS 特征以及单因素分析中P<0.05 的因素(年龄、饮酒、肥胖、入院NIHSS 评分、发病时间)纳入多因素Logistic 回归模型。以稳定组作为参照,头颈AS 总数、AS 位于PCA 和I-VA 均可负性独立预测7 d ND(P<0.05),而AS 位于BA 正性独立预测7 d ND(P<0.01)(图1);AS 位于双侧I-VA 负性独立预测7 d 症状缓解(P<0.01),而AS 位于I-VA 正性独立预测7 d 症状缓解(P<0.05)。见表4。

图1 头颅MRA示基底动脉中度狭窄(A)、重度狭窄(B)、闭塞(C)Figure 1 Cranial MRA indicates the moderate stenosis(A),severe stenosis(B)and occlusion(C)of basilar artery
2.4 与7 d 预后相关的其他危险因素以稳定组作为参照,饮酒、入院NIHSS 评分与7 d症状缓解相关(P<0.05),年龄、肥胖与7 d ND有关(P<0.01)。见表4。
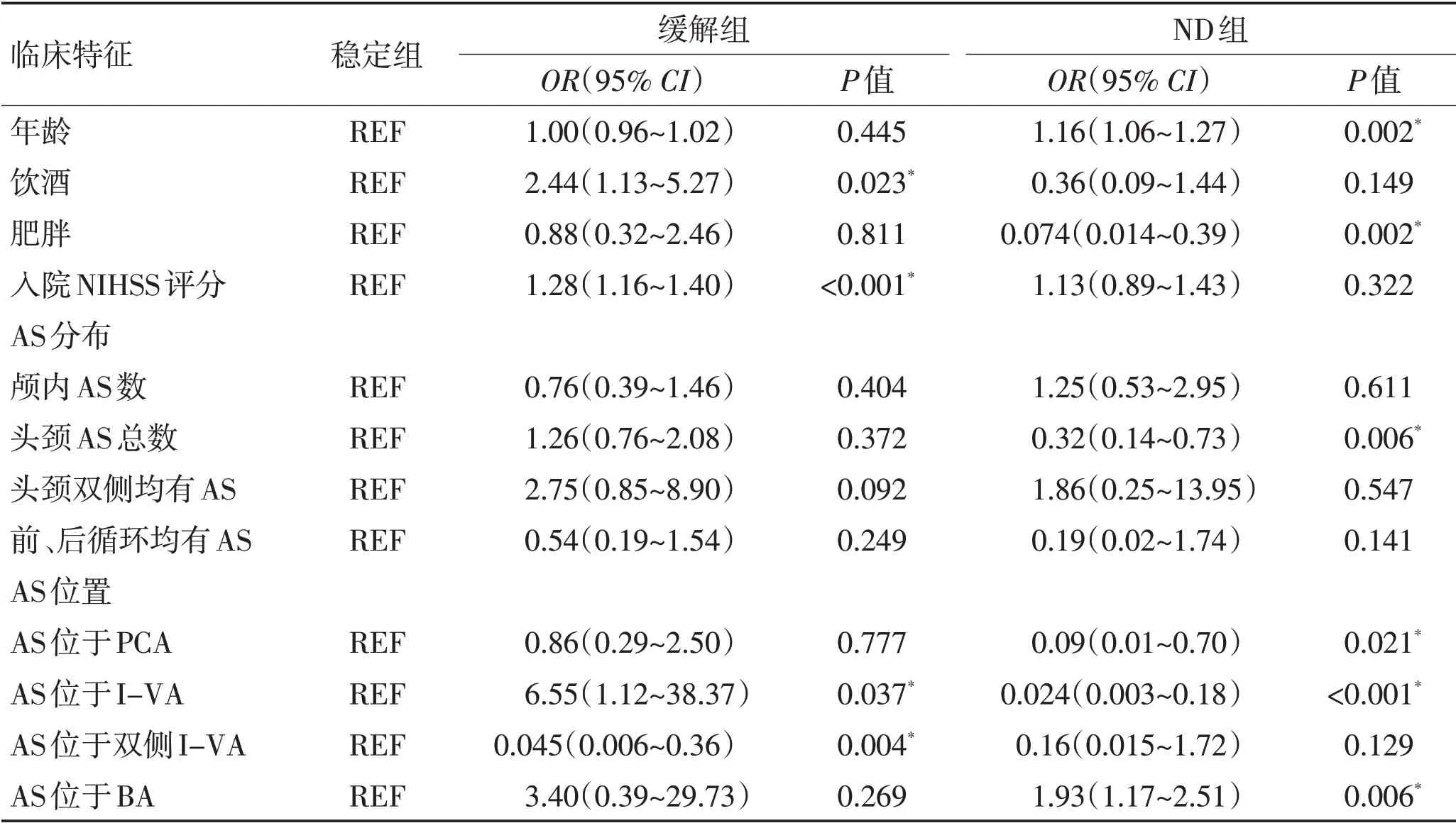
表4 多因素Logistic回归分析与7 d预后相关的临床特征Table 4 Relationships of clinical characteristics with 7-day ND in multivariate Logistic regression
3 讨论
既往研究证实,ND 与后循环血管动脉粥样硬化病变密切相关[8,12]。本研究中,较其他2 组患者相比,ND 患者所有颅内后循环大动脉均有更多的AS 病灶,而且AS 位于BA 和双侧I-VA 是预测ND 的独立危险因素,与上述两项研究结果相符。GOKCAL 等[12]研究发现,脑桥梗死主要由BA 穿支病变导致,认为BA病变导致的ND可能由邻近的动脉粥样硬化斑块迁移、堵塞穿支开口引起,而与大动脉狭窄所致的血流动力学异常、低灌注关系不大。但另一项研究发现较其他部位梗死,后循环梗死患者有更多的脑萎缩,推测其可能与椎基底动脉粥样硬化导致的长期低灌注有关,使得后循环梗死患者出现更多的ND[21]。另外,由于椎基底动脉是脑干区域的主要供应血管,而脑干结构较紧密,AS导致的低灌注可能影响相对更多的缺血区域,因此较严重的颅内PCAS 更易导致ND。本研究还发现,单侧I-VA AS 与7 d 症状缓解独立相关,这可能是由于脑干区域的血流相对丰富,当PCAS数量较少、病变程度相对较轻时,较为充裕的灌注可通过侧支循环代偿其他脑区,故仅存在后循环单侧AS的AIS患者7 d内症状可能缓解。
本研究发现,ND患者头颈部AS总数目较稳定组和缓解组显著增多。病理研究证实,尽管颅内动脉和颅外动脉在中膜厚度、弹力纤维含量方面存在差异,但颅内外动脉均与AS密切相关[22-23];同时,由于颅内外侧支循环的存在,颅外AS 对脑灌注产生一定的影响,故颅内与颅外AS相结合,即从头颈部总AS状况的角度来阐明AS 与ND 的相关性更适宜。本研究中ND 组头颈部AS 数最多,与既往研究[24]结果相符,这可能是由于较多的颅内和颅外AS 产生协同作用而导致更严重的颅内低灌注,引起AIS患者症状恶化。然而本研究发现,颅外AS病灶与ND并非独立相关,可能原因:首先,与颅外AS相比,颅内AS与卒中危险因素,如年龄、血脂异常更相关[25],而这些因素更能导致ND;其次,颅内AS 可能会干扰侧支循环开放(如前、后交通动脉),代偿血流只能通过软脑膜或脑膜-软脑膜侧支供应梗死区域,而对于颅外AS患者,可通过Willis环代偿梗死灶,所以其梗死灶的代偿血流更多,不易出现ND[8]。
虽然本研究中颅外AS 并不与ND 直接相关,但颅外存在动脉压力感受器载体血管——颈动脉窦,该部位的动脉粥样硬化与AIS患者血压节律密切相关[26-27],而血压节律异常也是ND的一个独立危险因素[28]。KONG等[26]证实,血压节律异常与颈动脉AS 狭窄程度并无关联,而是与动脉粥样硬化累及血管壁的周长百分比有关。本研究评估颅外AS病灶时仅关注了其狭窄程度,因此未发现颅外AS 与ND 的相关性。后续研究将专门针对颈动脉窦动脉粥样硬化进行评估,以分析其与ND的关系。
本研究还发现,与其他2组相比,ND组患者入院NIHSS 评分并未显著增高,与既往研究结果不符。这可能是因既往研究大多关注起病24~72 h内出现的早期ND,患者可能在ND出现之后才进行基线NIHSS评分,所以ND患者的基线NIHSS 较高。而本研究将ND 出现的时间放宽至7 d,ND 组还包括起病数天后出现ND 的患者,所以ND 组平均基线NIHSS评分较低。
在临床治疗方面,研究证实抗血小板治疗并不能减少AIS患者发生ND的概率[29]。因此,对于伴头颈部AS 且有ND 倾向的高危卒中患者,血管内治疗(endovascular treatment,EVT)成为潜在的首选手段。目前,EVT 对前循环动脉粥样硬化狭窄(anterior circulation atherosclerotic stenosis,ACAS)患者的疗效已被证实[30-32],而无任何随机对照试验证实椎基底动脉EVT 治疗有效。临床中由于PCAS 所致卒中迟发进展、症状多样化,故EVT治疗仍面对诸多困难[9]。本研究证实PCAS尤其是位于BA 和双侧I-VA 的AS 病灶与7 d 内ND 独立相关,期望能为这类患者治疗方案的选择提供理论基础。
不同于以往研究主要关注颅内动脉粥样硬化,本研究从总体角度分析颅内及颅外AS与ND的关系;本研究还排除了心源性栓塞及其他原因导致的AIS患者,从而排除心源性及其他源性栓子导致的ND,相对准确地分析动脉粥样硬化与AD 的相关性。本研究也有一些不足:所有受试者均来自单一卒中单元且样本量不够大;部分ND患者症状加重后无法配合完成头颅MR 检查,所以未纳入研究;本研究并未对ND的机制进一步分析。
