主动脉瓣膜钙化中胰高血糖素样肽-1对Notch1-Sox9信号通路的调控作用
2021-12-06查晴肖凡张倩茹叶佳雯张煜杨玲杨克刘艳
查晴 肖凡 张倩茹 叶佳雯 张煜 杨玲 杨克 刘艳
钙化性瓣膜疾病是导致主动脉瓣膜功能失调的常见原因,其主要临床表现有运动后呼吸困难、心律失常、昏厥、心绞痛等[1-5]。在钙化性瓣膜疾病进展过程中,间质细胞作为主动脉瓣膜中主要细胞,参与胞外基质合成和钙化[6]。研究表明,主动脉瓣膜间质细胞过表达Sox9可减缓钙化进程,而Notch通路对Sox9激活起调控作用。当敲除Notch1与Sox9相结合的结构域后,Notch胞内结构域(NICD)对Sox9转录活性的调控作用大幅削减。因此,抑制Notch信号通路可下调Sox9表达,促使主动脉瓣膜间质细胞钙化[7-9]。本课题组前期研究发现,Sox9作为转录激活因子,通过直接或间接作用与其他信号通路协同参与软骨分化形成过程。
胰高血糖素样肽-1(GLP-1)是胰高血糖素降解产物[10]。GLP-1通过结合其特异性GLP-1受体(GLP-1R)抑制胰高血糖素分泌,刺激胰岛素和促生长素抑制素分泌,从而缓解胰岛素抵抗[11-12]。而GLP-1R激动剂如艾塞那肽、利拉鲁肽、利西拉来等除具有降糖作用,还可减轻体质量,降低血压,改善血脂,减少心血管事件,提高生存率[13-16]。GLP-1R活化还可通过激活多种激酶降低心肌缺血性损伤,抑制局部缺血后重构。本研究探讨在主动脉瓣膜钙化过程中,GLP-1及其受体对于Notch1-Sox9信号通路的调控作用。
1 材料与方法
1.1 材料与试剂
DMEM∶F12培养基 ( 1∶1,低糖含20%胎牛血清)、低糖培养基 (含10%胎牛血清)、成骨诱导分化培养基均购自GIBCO公司。免疫组织化学染色试剂盒、BCA试剂盒均购自迈新公司;Sox9、GLP-1R、NICD和β-actin一抗均购自Abcam公司,免疫荧光检测二抗购自CST公司;水性封片剂(含DAPI)购自Invitrogen公司;SYBR Green Real-time PCR试剂盒购自Takara公司。C57BL/6小鼠购自上海斯莱克公司。
1.2 主动脉瓣钙化组织收集
纳入2016年6月至2017年5月于上海瑞金医院心外科和上海市第九人民医院心外科就诊的36例患者,其中16例为主动脉瓣病变患者,排除风湿性心脏病、先天性心脏病及炎症性疾病,行外科主动脉瓣置换手术,设为瓣膜钙化组;20例为因病情进行心脏移植,但瓣膜组织无退行性病变的患者,设为对照组。于病案室收集患者基本信息,外科手术时收集患者主动脉瓣膜组织。本研究经伦理委员会审批同意,所有患者均签署书面知情同意书。
1.3 主动脉瓣膜组织苏木精-伊红染色、茜素红染色及免疫组织化学染色
外科手术时获得瓣膜钙化组和对照组主动脉瓣膜组织,即刻使用4%福尔马林液固定24 h,石蜡包埋,以5 μm厚度连续切片。
苏木精-伊红染色(HE染色):切片放入苏木精水溶液中染色5~10 min;置于醋酸及氨水中各5 s;冲洗脱水后放入伊红染色液中染色2~3 min;脱水固定后树脂封片,显微镜下观察。
茜素红染色:切片放入茜素红染色液中10 min,冲洗脱水固定后,树脂封片,显微镜下观察。
GLP-1R免疫组织化学检测:切片进行抗原修复,5%马血清封闭30 min,滴加1∶100稀释的抗GLP-1R抗体,4 ℃过夜,加入1∶250稀释的二抗孵育30 min,冲洗二抗。DAB法显色,复染苏木精,脱水固定后,树脂封片,显微镜下观察。
1.4 主动脉瓣膜间质细胞原代培养
取4周龄C57BL/6小鼠,完整分离出主动脉瓣膜,在无菌条件下,将主动脉瓣膜剪为0.5 mm×0.5 mm大小组织块,使用200 μL的胎牛血清重悬组织块,将该组织块悬液均匀涂布于细胞培养皿表面,置于37 ℃、5%CO2培养箱内培养,1 h后取出。加入DMEM∶F12培养基,继续放置于37 ℃、5%CO2饱和湿度的培养箱内培养,细胞生长至融合状态后进行传代。
1.5 主动脉瓣膜间质细胞钙化诱导培养及GLP-1处理
待原代培养的小鼠主动脉瓣膜间质细胞生长至细胞融合时,将细胞分为3组,正常培养组以含10%胎牛血清的低糖培养基培养7 d,钙化培养组使用钙化诱导培养基培养7 d诱导钙化,钙化培养+GLP-1组在钙化诱导培养同时加入终浓度为100 pmol/L的GLP-1处理7 d。
1.6 主动脉瓣膜间质细胞茜素红染色及免疫荧光检测
培养小鼠原代主动脉瓣膜间质细胞并转移至细胞爬片,4%多聚甲醛37 ℃固定20 min。加入茜素红染色液染色,观察细胞钙化情况。
细胞爬片经4%多聚甲醛固定后,加入0.2%Triton室温放置2 min,5%的马血清4 ℃封闭1 h,加入抗Sox9、NICD抗体(1∶200)4 ℃孵育过夜。加入相应二抗(1∶400),室温孵育1 h。DAPI染色封片,共聚焦显微镜下观察拍照。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)
TRIzol裂解液提取钙化培养组及正常培养组细胞RNA,逆转录合成cDNA,根据试验盒说明书行qRT-PCR。Sox9上游引物5′-AGGTGCTCAAAGGCTACGACTG-3′,下游引物5′-CGCGGCTGGTACTTGTAATCC-3′;β-actin上游引物5′-GGGACCTGACTGACTACCTC-3′,下游引物5′-TCATACTCCTGCTTGCTGAT-3′。以β-actin作为内参,采用2-ΔΔCt法计算Sox9 mRNA的相对表达水平,每次实验重复3次。
1.8 Western blot检测
蛋白裂解液提取正常培养组、钙化培养组及钙化培养+GLP-1组蛋白,BCA蛋白定量试剂盒测定蛋白浓度。蛋白经10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜,5%脱脂奶粉封闭2 h,加入抗GLP-1R、SOX9、NICD、β-actin抗体 (1∶1 000),4 ℃孵育过夜,加入辣根过氧化酶 (HRP)标记的二抗 (1∶5 000),室温孵育2 h后加入ECL工作液显影,ImageJ分析软件对图像的灰度值进行定量,以β-actin作为内参,计算目的蛋白的相对表达水平。每次实验重复3次。
1.9 统计学分析
采用SPSS 21.0软件进行统计学分析。计量资料以平均值±标准差表示,数据呈正态分布且方差齐时,组间采用非配对t检验,如数据不符合正态分布则使用秩和检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 GLP-1R在人主动脉瓣膜钙化组织中的定位及表达
对人主动脉瓣组织进行染色分析,HE染色示瓣膜钙化组瓣膜厚度大于对照组。茜素红染色结果显示对照组无红色钙化染色区域,而瓣膜钙化组组织中心区域呈强阳性红色染色,提示钙化。免疫组织化学染色显示,对照组中GLP-1R表达于瓣膜间质细胞中,并呈阳性表达(棕色染色),瓣膜钙化组中虽有GLP-1R表达但较对照组呈弱表达,见图1。

图1 2组人主动脉瓣膜组织中钙化情况及GLP-1R表达情况
2.2 钙化培养下GLP-1对原代瓣膜间质细胞中GLP-1R表达的影响
分组培养小鼠主动脉瓣膜间质细胞,普通光学显微镜下观察发现,正常培养组呈纤维样细胞生长,表现为细胞形态狭长并呈放射状生长。钙化培养组细胞形态发生变化,表现为细胞变大,细胞核清晰但细胞轮廓边缘不清,钙化培养+GLP-1培养组细胞形态恢复狭长呈放射状生长。
茜素红染色后,钙化培养组瓣膜间质细胞呈红色染色,钙化培养+GLP-1组较钙化培养组红色染色明显减弱。见图2。
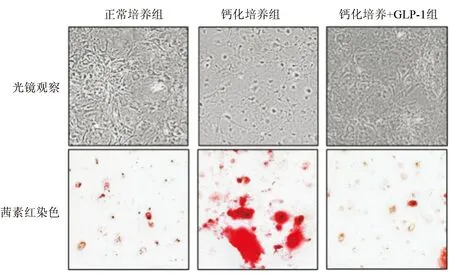
图2 3组小鼠主动脉瓣膜间质细胞形态及钙化情况
Western blot检测示钙化培养组GLP-1R的蛋白表达水平明显低于正常培养组(0.87±0.65对2.54±1.81,P=0.041),但钙化培养+GLP-1组GLP-1R的蛋白表达水平明显高于钙化培养组(2.38±1.36对0.87±0.65,P=0.021),见图3。
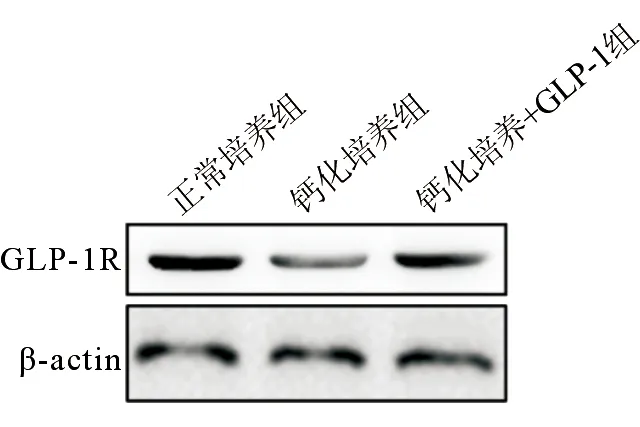
图3 3组小鼠主动脉瓣膜间质细胞GLP-1R的蛋白表达情况
2.3 GLP-1对主动脉瓣膜间质细胞Sox9表达的影响
钙化培养+GLP-1组Sox9的mRNA表达水平(2.14±0.21对1.01±0.01,P<0.01)、蛋白表达水平(3.21±0.93对0.49±0.15,P<0.01)均明显高于钙化培养组,见图4A。免疫荧光染色显示,钙化培养+GLP-1组Sox9的蛋白表达水平明显强于钙化培养组,见图4B。

注:A为Western blot检测主动脉瓣膜间质细胞Sox9的蛋白表达水平;B为免疫荧光染色检测主动脉瓣膜间质细胞Sox9的表达和定位(×200)
2.4 GLP-1对主动脉瓣膜间质细胞NICD入核的影响
钙化培养组NICD入核量低于正常培养组。与正常培养组和钙化培养组相比,钙化培养+GLP-1组NICD入核量增加,见图5。

注:DAPI发蓝色荧光,显示细胞核;NICD为红光荧光
2.5 GLP-1对主动脉瓣膜间质细胞NICD表达的影响
与正常培养组相比,钙化培养组中NICD蛋白表达水平明显下降(0.41±0.15对0.87±0.15,P<0.05)。与钙化培养组相比,钙化培养+GLP-1组NICD蛋白表达水平明显升高(0.94±0.26对0.41±0.15,P<0.05)。见图6。

图6 3组小鼠主动脉瓣膜间质细胞NICD蛋白表达情况
3 讨论
研究表明,GLP-1等胰岛素受体增敏剂干预阿尔兹海默症后,可有效提高患者的认知能力并改善脑内病变程度[17]。GLP-1可直接通过血脑屏障进入中枢神经系统并与脑内分布的GLP-1R结合,参与对胰岛素信号下游通路的调节,发挥神经保护作用,主要为减少凋亡、抑制β样淀粉酶(Aβ)损伤作用,并减少Tau蛋白异常过度磷酸化[18]。而这些生物学效应均涉及细胞的退行性病变过程。在同属于退行性病变范畴的钙化性主动脉瓣膜疾病中,GLP-1的作用尚不可知。本研究发现,钙化的主动脉瓣膜GLP-1R的表达水平低于正常瓣膜组织。GLP-1可抑制主动脉瓣膜间质细胞钙化,这提示在主动脉瓣膜钙化这一退行性病变中,GLP-1可能具有对抗钙化的作用。在体外实验中,用钙化培养基诱导细胞钙化,结果显示钙化处理后的细胞GLP-1R表达水平下降。
钙化的形成是复杂而精密的细胞分子过程,Sox9的功能异常是导致主动脉瓣膜钙化的主要原因[4,19-20]。为进一步分析GLP-1R在钙化过程中的作用,本研究使用GLP-1刺激小鼠原代瓣膜间质细胞,结果显示GLP-1能够上调Sox9的表达,提示GLP-1可能通过Sox9调控细胞钙化。GLP-1调控Sox9的机制目前尚不清楚,有研究表明,组织钙化区域Notch1表达水平下降,可下调下游转录因子Sox9的表达[21-23]。Notch在水解后生成Notch活性片段NICD,NICD进入核内,调控核内相关基因转录[24]。上游分子可通过改变NICD的水平和NICD入核,调控下游Sox9的表达[25]。本研究证明GLP-1可诱导钙化瓣膜间质细胞中的NICD表达,使NICD入核增加,同时增加瓣膜间质细胞中Sox9表达水平。因此,GLP-1可能通过其受体GLP-1R调控Notch-1活性片段NICD及Sox9的升高,从而抑制主动脉瓣膜间质细胞钙化进展。
综上所述,在主动脉瓣膜钙化病变过程中,GLP-1R水平的下降使GLP-1的抗瓣膜钙化作用减弱,而GLP-1则可通过其受体GLP-1R调控下游NICD表达及入核,进而调控抗钙化基因Sox9的表达,发挥抗瓣膜钙化作用。GLP-1有望成为潜在的预防和治疗主动脉瓣膜钙化的药物。
