先天性心脏病术后患儿继发主动脉瓣下狭窄的原因及外科治疗效果分析
2022-06-27许伟滨梁婷婷黄景思孙善权
许伟滨,梁婷婷,李 虹,黄景思,饶 娇,孙善权
(广东省妇幼保健院广东省儿童医院心脏中心,广州 511442)
继发性的主动脉瓣下狭窄(secondary subaortic stenosis,SSS)是指先天性心脏病(congenital heart disease,CHD)手术后出现的主动脉瓣下狭窄,主要表现为局限隔膜型和隧道型[1-2]。如果未经治疗,进行性的SSS 可导致患儿左心室肥大及衰竭、心律失常、主动脉瓣关闭不全和心内膜炎[2]。有研究阐述了导致SSS 的发病原因及影响因素,但暂未形成共识[3-4],现回顾性分析于广东省妇幼保健院行CHD 术后出现瓣下狭窄并手术治疗的患儿的临床资料,尝试探索其发病原因及并了解疗效。
1 资料和方法
1.1 一般资料
回顾性分析2011 年1 月至2021 年12 月广东省妇幼保健院CHD 矫治术后SSS 共14 例患儿。纳入标准:需行手术矫治的SSS 患儿。排除标准:(1)第一次施行CHD手术时已经合并有主动脉瓣下狭窄或诊断为肥厚型心肌病者。(2)在行CHD 畸形矫治时,由于手术操作造成左心室流出道狭窄,即CHD 矫治术后就已存在左心室流出道狭窄。共有14 例主动脉瓣下狭窄患儿行手术治疗,其中男10 例,女4 例。本组首次手术CHD 类型,手术年龄、SSS手术年龄见表1。一期矫治所有CHD畸形。矫治CHD 的年龄为1 个月(3 d~10 个月);行左心室流出道狭窄矫治的年龄为32(8~72)个月;体质量为(11.5±5.9)kg。患儿行主动脉瓣下狭窄矫治与前次手术矫治的间隔时间为22(6~71)个月。术前诊断包括右心室双出口(DORV)5 例,占35.7%(5/14);主动脉缩窄(CoA)7 例,占50%(7/14);部分型房室间隔缺损(PAPVC)1 例,占7.1%(1/14);主动脉弓中断(IAA)1 例,占7.1%(1/14)。14 例患儿需手术治疗,其中4 例患儿在行手术前主要症状为心悸、运动耐力下降、头晕等,超声心动图检查提示存在主动脉瓣下狭窄;其余10 例无明显症状,常规超声心动图复查时发现主动脉瓣下狭窄。
1.2 方 法
主动脉瓣下狭窄的手术指征是CHD 术后,超声心动图检查提示主动脉瓣跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa)[5-6]。手术方法:14 例患儿均行主动脉瓣下狭窄矫治手术。患儿在气管插管全身麻醉、中度低温体外循环、心脏停搏下行心内直视手术,取原胸骨正中切口,切开皮肤及皮下组织,游离出主动脉及上、下腔静脉,分别行主动脉及上、下腔静脉插管,建立体外循环,主动脉阻断后,顺行性灌注HTK 心脏停搏心肌保护液,进行横向主动脉切开术,拉开主动脉瓣,暴露瓣下纤维嵴,从右冠状动脉瓣的最低点下方开始,圆周切除纤维肌嵴。本组患儿有4 例同时合并有主动脉瓣轻度反流,术中切除隔膜后复搏,术中食道超声心动图显示瓣膜反流明显减轻,因此主动脉瓣未行处理。
1.3 随访方法
通过门诊及电话获得所有患儿的随访数据,儿科心脏病专家完成检查。详细记录患儿的症状、体征,复查超声心动图并记录。
1.4 统计学分析
采用SPSS 21.0 统计软件处理。正态分布计量资料以()表示,采用t检验;非正态分布计量资料以[M(P25~P75)]表示,采用秩和检验。计数资料以[n(%)]表示,采用卡方(χ2)检验。以P<0.05为差异有统计学意义。
2 结果
2.1 手术结果
本组SSS 患儿均为局限隔膜型主动脉瓣下狭窄。体外循环时间为83(57~163)min;主动脉阻断时间39(27~104)min;住院时间为(11.5±6.0)d。矫治术前主动脉跨瓣压差60(40~115)mmHg,矫治术后主动脉瓣跨瓣压差(9.6±4.2)mmHg,无严重手术并发症。术前有症状的患儿术后症状消失,所有患儿心功能正常,无住院死亡患儿。
2.2 随访结果
SSS患儿行主动脉瓣下狭窄矫治术后随访14例,随访时间3个月至8年6个月(中位数:3年1个月)。SSS 患儿术后随访无症状,心功能Ⅰ级,随访中无死亡患儿。2 例患儿术后左心室流出道压差增高。患儿1(表1 患儿序号2)术后左心室流出道压差23 mmHg,且随访过程中主动脉瓣下狭窄加重,主动脉瓣狭窄于术后7 年6 个月时主动脉瓣下压差达96 mm Hg,再次行左心室流出道狭窄矫治术;患儿2(表1 患儿序号4)最后一次随访于术后5 年,主动脉瓣下压差45 mmHg,最后一次随访无主动脉瓣反流,但有隧道样主动脉瓣下狭窄的发展趋势,目前仍在随访中。
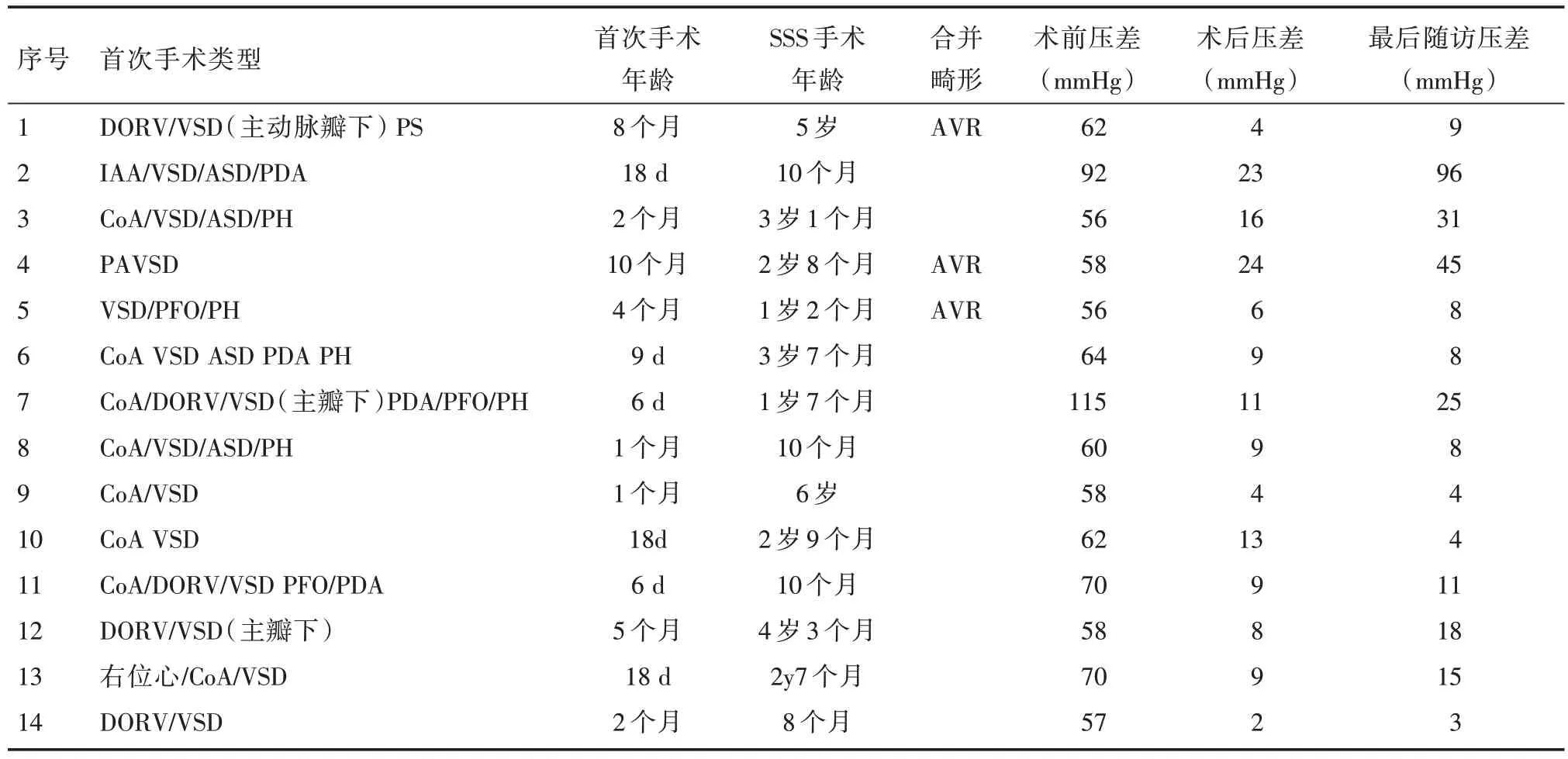
表1 14 例CHD 手术后继发主动脉瓣下狭窄患儿的心脏畸形、手术年龄及并发病变
3 讨论
SSS 是一种主动脉瓣下方短的、局部的、纤维或纤维肌嵴阻塞的病变。单纯切除瓣下隔膜处理方式安全,手术疗效满意,部分患儿远期发生再狭窄需要再手术,要积极进行终身随访。由于部分患儿并未在本院随访,因此无法统计所有SSS 的发生率,只能统计行再次瓣下狭窄矫治的患儿,国内、外中心也暂未报道总的SSS 发病率[7-8]。
从发生SSS 的病种来看,本组14 例SSS 患儿中,7 例为主动脉缩窄矫治术后,占50%,高于主动脉缩窄在CHD中的占比5%~8%;5例为右心室双出口矫治术后,占35.7%,高于右心室双出口在CHD 中的占比1.5%。罗丹东等[7]报道的主要有右心室双出口、部分型房室间隔缺损、室间隔缺损,右心室双出口占36.8%,而Gao 等[9]报道的病种主要有房室间隔缺损(atrioventricular septal defect,AVSD)、右心室双出口、主动脉缩窄,主动脉缩窄占40%。Dodge-khatami 等[10]报道继发性主动脉瓣狭窄的危险因素为CHD(AVSD、主动脉缩窄等)、CHD 手术年龄偏小等。
SSS 发生的原因主要是由于外科治疗CHD 后左心室流出道的形态出现变化,左心室流出道与室间隔形成夹角等[11-12],这些因素导致了左心室流出道血流动力学紊乱,刺激左心室流出道局部肌肉及纤维增生。Cape 等[13]认为流出道受到血流的冲击,从而产生剪切力,激活了易感基因,导致主动脉瓣下组织增生狭窄。
本组患儿主动脉缩窄术后出现主动脉瓣下狭窄7例,占50%,其中有4例为主动脉瓣二叶瓣,2例为永存左上腔静脉。Szaflik 等[14]认为一期修复前存在二叶主动脉瓣和主动脉瓣Z值为-3.0 或更低是左心室流出道梗阻的危险因素。Alsoufi 等[15]认为圆锥室间隔后移,导致了左心室流出道出现“湍流”,产生剪切力,激活了易感基因,随后发生瓣下肌肉增生与纤维增生,从而形成SSS。也有人认为主动脉缩窄术后形成主动脉瓣下狭窄的机制不明确,可能是与左心室后负荷增加有关[16]。除了以上原因,我们认为亦不能排除患儿发病时已存在主动脉瓣下纤维隔膜。
本组患儿中有5 例是右心室双出口或室间隔缺损(主动脉瓣下),均行双心室矫治。Zhang 等[16]的患儿组中亦10 例为右心室双出口,研究表明矫治时行内隧道修复形成左心室流出道,补片褶皱或者角度的改变。血流通过重建的左心室流出道时,无法保持层流状态,产生剪切力,对左心室流出道冲击,导致左心室流出道纤维肌肉增生。Rocchini 等[17]认为,右心室双出口术后的主动脉瓣下狭窄的可能原因是室间隔缺损有效面积的减小,可能与补片的褶皱或扭曲有关,或者是补片上增生的纤维组织在内隧道修复时,如果室间隔缺损不够大,要适当扩大室间隔缺损,补片要偏大,补片缝合后形成一个凹面,增加左心室流出道容积所致。
本组患儿中有1 例为部分型房室间隔缺损,二尖瓣和三尖瓣结合平面向心尖移动,左心室流出道延长,呈“鹅颈征”。室间隔的腱索使前叶在收缩时前向运动,导致主动脉瓣下血流速度增快及纤维增生,形成左心室流出道狭窄[4]。
左心室流出道“湍流”亦造成主动脉瓣叶的损伤,随后发生增厚并扭曲,会造成瓣叶无法对合或脱垂而导致主动脉瓣关闭不全。在许多情况下,纤维隔膜延伸到主动脉瓣叶的下表面,成为主动脉瓣反流的主要原因。因此,患儿在主动脉瓣下严重狭窄和左心室肥厚之前,会先发生主动脉瓣反流,宜尽早对其行手术矫治[7,18]。
本组患儿采用主动脉瓣下狭窄矫治术可以很好地解除狭窄和缓解临床症状,术中及术后超声心动图测量示左心室流出道压差下降,接近正常。本组患儿手术均成功,无死亡患儿。无主动脉或二尖瓣损伤、完全性心脏传导阻滞等并发症。但随访发现部分患儿术后仍会逐渐加重,有一定的复发率;Cao 等[9]报道的患儿有8.7%复发,罗丹东等[7]报道的患儿组5.5%复发。本组有1 例患儿术后主动脉瓣下跨瓣压差23 mmHg,且随访过程中左心室流出道狭窄逐渐加重,于SSS 矫治术后7 年6 个月时再次行主动脉瓣下狭窄矫治术。另外1 例患儿最后一次随访是术后5 年,其主动脉瓣下跨瓣压差为45 mmHg,最后一次随访未出现主动脉瓣反流,暂不符合手术适应证,未行手术治疗,复发率为7.1%。Kalfa 等[19]报道SSS 患儿需要3 次主动脉瓣下狭窄矫治术。因此,主动脉瓣下狭窄应该长期随访[2,7]。
总之,SSS 的发病原因为左心室流出道出现血流动力学紊乱,形成剪切力,刺激左心室流出道纤维肌肉增生,继而导致左心室流出道狭窄。治疗上尽早行瓣下隔膜切除,手术安全,效果满意,部分患儿远期发生再狭窄需要再手术,要积极进行长期随访。
局限性:本研究是回顾性单中心研究,研究患儿数偏少,随访时间还不够长,还需进一步积累患儿,或联合多中心增大样本量,加强随访资料的管理,让未行手术的SSS 患儿也加入统计,从而能得出SSS 总的发病率,可以更好反映该疾病的病因及预后。
