I 型干扰素诱导表达的三基序蛋白22 引发线粒体交联促进心肌细胞凋亡
2021-12-03宋双孙大康崔明丽王倩倩赵希军徐会圃李洋程艳丽
宋双,孙大康,崔明丽,王倩倩,赵希军,徐会圃,李洋,程艳丽
心肌炎是指心肌存在炎症浸润,并伴有邻近心肌细胞退行性和(或)坏死性改变,而不是典型的心肌梗死相关的缺血性损伤[1]。心肌炎通常由感染引起,最常见于柯萨奇病毒B3 等病毒感染,其临床表现差异大,可出现心力衰竭、心脏骤停等严重并发症[2-3]。柯萨奇病毒B3 感染机体后,会诱导心肌细胞高度表达I 型干扰素(IFN,包括IFN-α、IFN-β 等),通过多种方式增强免疫系统应答,抑制病毒感染。另一方面,过度激活的免疫系统可产生大量的细胞因子,IFN 等细胞因子可促进心脏的炎性浸润,加重心肌损伤[4]。
三基序蛋白(TRIM)家族因高度保守的RBCC 结构得名,该结构包括Ring、B-Box 和Coiled-coil 3个部分。TRIM 家族对细胞凋亡、转录、分化及抗病毒感染等都具有重要的生物学作用。TRIM 家族中TRIM5α、TRIM19 和TRIM22 等均具有抗病毒活性,其中TRIM5α 可限制人类免疫缺陷病毒复制,TRIM19 在抗人类巨细胞病毒感染过程中发挥重要作用[5]。TRIM22 可针对各种病毒蛋白,其中以逆转录病毒多见[6]。目前已证实TRIM22 在人类免疫缺陷病毒、脑心肌炎病毒、乙肝病毒感染中发挥重要作用[7-8]。在神经元细胞模拟缺血/低氧刺激模型中,TRIM22表达上调并促进核因子κB(NF-κB)的激活,使炎性因子如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)释放明显增多,促进神经元细胞凋亡[9]。
研究表明IFN 可诱导TRIM22 在T 淋巴细胞和单核细胞来源的巨噬细胞中表达上调。研究还发现,过表达TRIM22 可显著诱导人巨噬细胞系U937 产生促炎细胞因子,加重细胞免疫造成的组织损伤[7]。有意思的是,Chen 等[10]发现TRIM22 可诱导促凋亡蛋白Bak 的表达增加和寡聚化,并通过天冬氨酸特异性半胱氨酸蛋白酶依赖途径促进单核细胞凋亡。因此推测:在病毒性心肌炎中,IFN 过表达会诱导心肌细胞高表达TRIM22,进而影响心肌细胞的凋亡进程。
1 材料与方法
1.1 材料
MZ-0972 人心肌细胞(HCM)细胞株购自中国宁波明舟生物科技有限公司;DMEM 高糖培养基、磷酸盐缓冲液(PBS)购自美国Hyclone 公司;胎牛血清购自中国四季青公司;胰蛋白酶溶液购自中国索莱宝公司;重组人IFN-α2b 注射剂(以下简称IFN-α,中国北京凯因科技股份有限公司,批号:S20030030);RNAiso Plus、PrimeScript™Ⅳ1st strand cDNA Synthesis Mix、TB Green®Premix Ex Ta q™Ⅱ(试剂)购自日本TaKaRa 公司;5' Flag-pcDNA3.1-TRIM22质粒、5' Flag-pcDNA3.1 空质粒为滨州医学院附属医院临床医学实验中心保存;Opti-MEM 无血清培养基、LipofectamineTM3000、P3000TM(试剂)购自美国Invitrogen 公司;Annexin V-PE/7-AAD 细胞凋亡检测试剂购自美国BD Pharmingen 公司;MitoTracker-Deep Red(试剂)购自美国Life technologies 公司;FLAG鼠源性单抗(F3165,试剂)购自美国Sigma 公司;Rabbit anti-TRIM22 polyclonal antibody(HPA003307,试剂)购自美国Sigma 公司;抗人actin 兔源多抗(试剂)购自美国Cell Signaling Technology 公司;辣根过氧化物酶(HRP)标记anti-mouse IgG(6170-05,试剂)、HRP 标记anti-rabbit IgG(4030-05,试剂)购自美国SouthernBiotech 公司;ECL Plus Western Blotting Substrate(试剂)购自美国Thermo 公司。
1.2 方法
细胞培养、IFN-α 刺激及实验分组:HCM 以含有10 %胎牛血清的DMEM 高糖培养基培养,置于37 ℃、5%二氧化碳、饱和湿度的温箱中培养,待细胞生长融合至80 %进行传代实验(多选取第3-6代)。
(1)观察IFN-α 对HCM 凋亡的影响(流式细胞术):将传代细胞按5×105/孔密度接种至12 孔板,培养12 h 后用不同浓度(0、500、2 000、8 000 U/ml)的IFN-α 刺激HCM,即分为IFN-α 0 U/ml组、IFN-α 500 U/ml 组、IFN-α 2 000 U/ml 组、IFN-α 8 000 U/ml 组(其中IFN-α 0 U/ml 组为空白对照组,不添加干扰素),继续培养48 h,收集细胞备用(n=3)。(2)检测IFN-α 与TRIM22 表达的时间依赖性[实时荧光定量PCR(realtime PCR)]:将传代细胞按3×106/孔密度接种于5 个6 cm 培养皿中,按时间点(0、6、12、18、24 h),依次加入2 000 U/ml IFN-α,即分为IFN-α 0 h 组、IFN-α 6 h 组、IFN-α 12 h 组、IFN-α 18 h 组、IFN-α 24 h 组(其中IFN-α 0 h 组为空白对照组),收集细胞备用(n=9)。③检测 IFN-α 与TRIM22 表达的剂量依赖性[realtimePCR、蛋白免疫印迹(Western blot)检测]:将传代细胞按3×106/孔密度接种于4 个6 cm 培养皿中,用不同浓度的 IFN-α 刺激HCM,分组同前所述,继续培养12 h,收集细胞备用(PCR 实验组n=9;Western blot 实验组n=3)。
realtime PCR 检测:取1 ml Trizol 提取细胞总RNA,逆转录成互补DNA 作为模板,再通过PCR仪检测TRIM22 mRNA 的相对表达量,以未刺激组作为对照。具体步骤严格按照试剂盒说明书进行。TRIM22 上游引物5'-CAAACATTCCGCATAAAC-3',下游引物 5'-CACATTCACCTCGCCTTC-3';管家基因上游引物5'-AACGGATTTGGTCGTATTG3',下游引物 5'-GCTCCTGGAAGATGGTGAT-3',预 期TRIM22扩增片段大小为240 bp。将模板95 ℃变性30 s,再按以下参数反应40 个循环:95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s。以甘油醛-3-磷酸脱氢酶为内参,采用2-∆∆Ct方法分析TRIM22 mRNA 的表达水平。
转染:在转染12 h 前,将HCM 接种至12 孔板中。在细胞汇合度约60 %~80 %时用Opti-MEM(100 μl/孔)稀释Lipofectamine 3000TM;然后以Opti-MEM(100 μl/孔)稀释对应质粒,并加入P3000TM充分混匀;将稀释后的两者混匀,室温孵育15 min。将上述混合物加入细胞中,轻轻晃动混匀,37 ℃继续培养24 h(激光共聚焦)或48 h(流式细胞术)。
细胞裂解和Western blot 分析:将细胞用冷PBS漂洗一次,向每孔中(12 孔板)加入150 μl Laemmli上样缓冲液,裂解后的蛋白样品收集入1.5 ml Ep 管,沸水浴5 min。每个蛋白样品上样10 μl 于10 % SDS-聚丙烯酰胺凝胶,经电泳、转膜、封闭后,分别加入对应的一抗,在室温条件下摇床孵育1 h。用TBST漂洗硝酸纤维素膜3 次,每次5 min。加入HRP 标记的对应二抗,室温摇床孵育1 h。洗膜。将适量等体积的增强化学发光显色液A 液和B 液混合,覆盖硝酸纤维素膜1~2 min,在暗室中进行曝光成像。
流式细胞术:转染质粒后48 h 收集细胞,预冷的PBS 漂洗,100 μl 1×结合缓冲液重悬细胞,转移至Falcon 流式管(BD)中,分别加入5 μl 膜联蛋白V-藻红蛋白(Annexin V-PE)和5 μl 7-氨基放线菌素D(7-AAD)溶液,混匀后室温下避光孵育15 min。最后加入400 μl 结合缓冲液混匀。用FACS Calibur 流式细胞仪检测HCM 凋亡情况。
激光共聚焦:pEGFP-N3-TRIM22 载体转染HCM 24 h 后,加入37 ℃预热的MitoTracker-Deep Red 染色工作液,终浓度为100 nmol/L,37 ℃继续培养30 min。再加入1 ml PBS,以备观察。部分细胞 以pEGFP-N3-TRIM22 载体转染HCM 24 h 后,PBS 漂洗1 次,4%多聚甲醛固定15 min。用PBS漂洗2 次,加入含0.2 % Triton X-100 的PBS 通透10 min。PBS 漂洗2 次,加入4',6-二脒基-2-苯基吲哚(DAPI)染液1 ml(1 μg/ml),室温避光染色10 min。PBS 漂洗2 次,再加入1 ml PBS,以备观察。激光共聚焦显微镜(Leica TCS SP5,德国)选用63 倍物镜(油镜,数值孔径1.4),MitoTracker-Deep Red 激发波长为644 nm,绿色荧光蛋白(GFP)激发波长为488 nm。通过ImageJ 1.50i 软件JACoP 插件分析。
统计学分析方法:采用SPSS 26.0 软件进行统计学分析,定量资料用均数±标准差()表示,多组间比较采用单因素方差分析,组间差异采用独立样本t检验分析。每组实验均重复3 次,每次采用3 复孔。P<0.05 为差异有统计学意义。
2 结果
2.1 IFN-α 诱导HCM 凋亡(图1)
流式细胞术检测不同剂量IFN-α 刺激HCM后细胞凋亡情况。结果显示,IFN-α 0 U/ml 组、IFN-α 500 U/ml 组、IFN-α 2 000 U/ml 组、IFN-α 8 000 U/ml 组的细胞凋亡率(AnnexinV-PE+细胞所占比率)分别为6.10 %、20.90 %、25.69 %、30.37%(图1A)。经统计学分析显示,与IFN-α 0 U/ml 组相比,IFN-α 刺激各组细胞凋亡率显著升高(P<0.05),且IFN-α 诱发的HCM 凋亡率呈剂量依赖性(P均<0.05,图1B)。
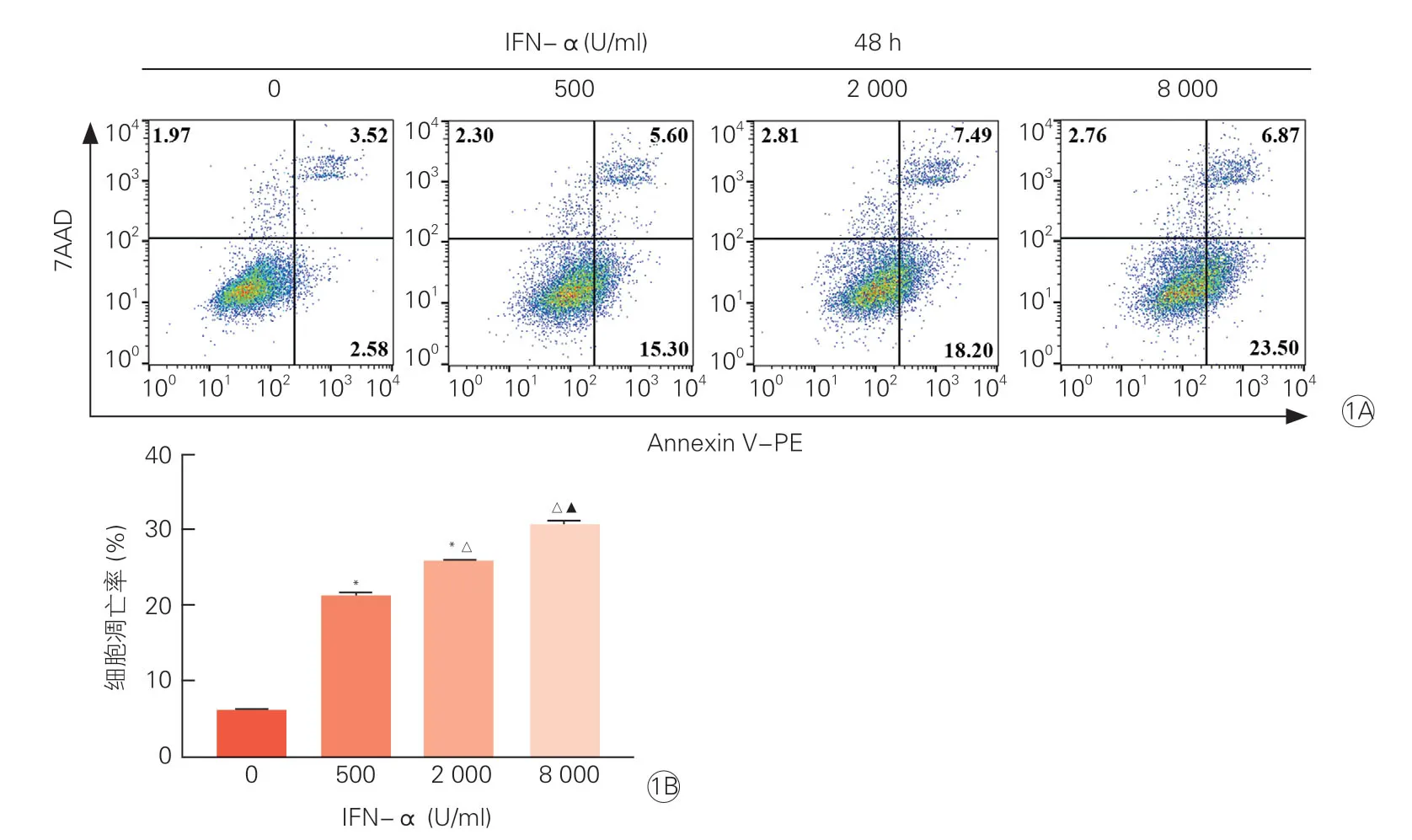
图1 IFN-α 呈剂量依赖性诱导人心肌细胞凋亡
2.2 IFN-α 促进HCM 中TRIM22 的表达(图2)
IFN-α 刺 激HCM,经realtime PCR 法检测TRIM22 mRNA 表达水平。时间梯度组realtime PCR结果:IFN-α 0 h 组为1.02±0.18,IFN-α 6 h 组为537.74±66.94,IFN-α 12 h 组 为863.30±19.68,IFN-α 18 h 组为194.34±61.07,IFN-α 24 h 组为138.56±26.31;经统计学分析显示,以2 000 U/ml IFN-α 刺激HCM 6 h 后TRIM22 mRNA 表达显著上调,12 h 达最高,随后逐渐下降(P<0.05,图2A)。浓度梯度组realtime PCR 结果:IFN-α 0 U/ml 组为1.04±0.28,IFN-α 500 U/ml 组 为257.72±23.55,IFN-α 2 000 U/ml 组为368.09±10.37,IFN-α 8 000 U/ml 组为1 451.36±214.39;经统计学分析显示,刺激时间一定(12 h),与IFN-α 0 U/ml组之间相比,IFN-α 500 U/ml 组、IFN-α 2 000 U/ml 组、IFN-α 8 000 U/ml 组TRIM22 mRNA 表达水平呈逐渐升高的趋势(P<0.05,图2B),存在剂量依赖性。Western blot 检测结果:IFN-α 0 U/ml 组 为0.00,IFN-α 500 U/ml 组 为1.00,IFN-α 2 000 U/ml 组为1.28±0.06,IFN-α 8 000 U/ml 组为2.86±0.12;经统计学分析显示,三种浓度的IFN-α 均可显著促进HCM 中TRIM22 分子蛋白的表达(P<0.05,图2D)。

图2 IFN-α 诱导人心肌细胞中TRIM22 表达上调
2.3 过表达TRIM22 促进HCM 凋亡
2.3.1 过表达TRIM22 上调HCM 凋亡率(图3)
将5' Flag-TRIM22-pcDNA3.1 质粒(TRIM22 组)或5' Flag-pcDNA3.1 空质粒(空载体组)分别转染HCM,流式细胞术检测细胞凋亡情况。结果显示,TRIM22 组细胞凋亡率(AnnexinV-PE+细胞比率)为14.72 %,空载体组细胞凋亡率为6.02 %(图3A);TRIM22 组细胞凋亡率(14.64±0.26)%,空载体组细胞凋亡率(5.89±0.18)%(图3B)。Western Blot结果显示TRIM22 组(1.00±0.22)%。经统计学分析,TRIM22 组细胞凋亡率与空载体组相比(图3B),两组间差异有统计学意义(P<0.05);Western blot 检测发现TRIM22 组TRIM22 蛋白表达显著升高(图3C、3D),提示过表达TRIM22 能促进HCM 凋亡。
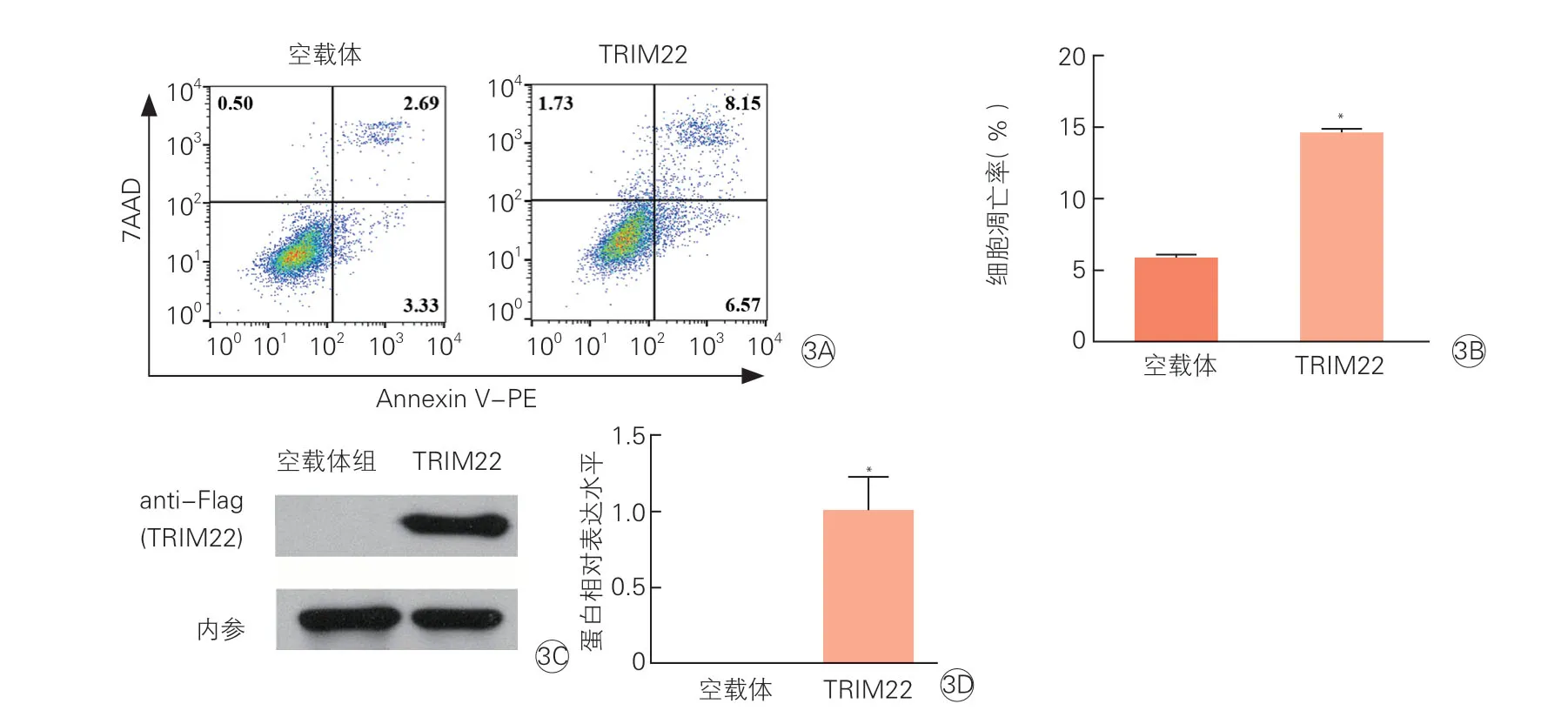
图3 TRIM22 在人心肌细胞中过表达对细胞凋亡的影响
2.3.2 过表达TRIM22诱发HCM凋亡小体的产生(图4)
将HCM 分为TRIM22-增强绿色荧光蛋白(Enhanced Green Fluorescent Protein,EGFP)转染组和空载体组,用MitoTracker-Deep Red 对线粒体染色。激光共聚焦检测发现,空载体组细胞形态舒展,呈现为短柱状或单端为梭形。线粒体多以长管网状结构,散在分布于HCM 中(图4A)。在TRIM22-EGFP 转染组,TRIM22-EGFP 团块散在分布,可诱发HCM 出现凋亡小体(黑色箭头),呈现典型的细胞晚期凋亡特征;同时,凋亡细胞的线粒体多呈现为短棒状、圆球状(图4B)。上述结果说明,与空白对照组相比TRIM22 高表达不仅可以促进凋亡小体的出现,还可引起线粒体出现明显的片段化(线粒体分裂作用增强)。

图4 过表达TRIM22 诱发人心肌细胞中凋亡小体的产生(比例尺:10 μm)
2.4 激光共聚焦观察TRIM22 与线粒体的共定位情况及对线粒体的影响
2.4.1 TRIM22 在HCM 中的亚细胞定位(图5)
真核表达载体pEGFP-N3-TRIM22 转染HCM 24 h 后,激光共聚焦检测发现:在胞浆区(白色箭头)和胞核区(黑色箭头)有大量TRIM22-EGFP 绿色荧光蛋白分布(图5),且多呈聚合体团块状。

图5 三基序蛋白22 在人心肌细胞中的亚细胞定位(比例尺:10μm)
2.4.2 TRIM22 与线粒体的共定位及线粒体交联作用(图6)
将pEGFP-N3-TRIM22 转 染HCM,通 过MitoTracker-Deep Red 染色,激光共聚焦检测发现TRIM22-EGFP 在HCM 中,以大小不等的绿色团块分布,线粒体则为红色点块状或条索状;TRIM22-EGFP 绿色荧光蛋白与两个红色线粒体存在共定位,呈现为黄色团块(图6A 白色箭头所示)。
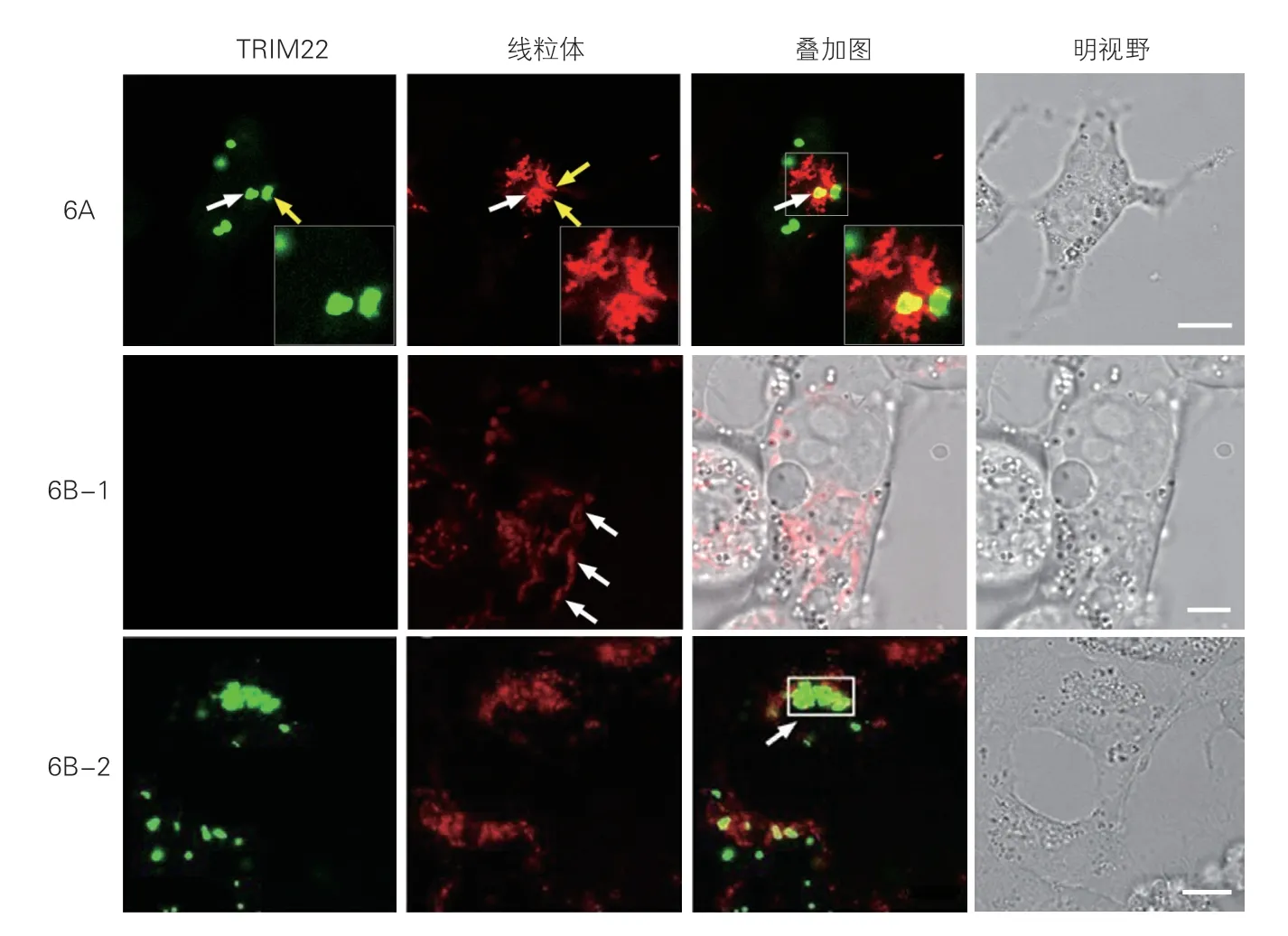
图6 TRIM22 与线粒体的共定位及交联作用
本研究还发现在空载体组中,线粒体多以长管网状结构存在(图6B-1 白色箭头所示);在TRIM22-EGFP 转染组(图6B-2)中,线粒体多以片段化形态存在,呈现为短棒状、圆球状。提示TRIM22 可影响线粒体的融合、分裂过程。由于TRIM22-EGFP 团块的面积大于共定位线粒体(接触部位)的面积,提示TRIM22 蛋白可能仅有少量进入线粒体,大部分滞留于胞浆,发挥线粒体交联作用。经ImageJ 1.50i软件JACoP 插件分析,在图6B-2 白色箭头选定区域中TRIM22-EGFP 与线粒体的Manders 重叠系数为0.71(参考范围:0~1),提示当TRIM22 在HCM中大量表达时,可导致大范围的线粒体交联。上述结果表明在HCM 中TRIM22 与线粒体存在共定位,TRIM22 过表达会影响线粒体融合和分裂过程,造成线粒体动力学失衡。
3 讨论
心肌炎可由感染性病原体、药物和毒素引起,其中病毒感染已被证实为心肌炎最常见的原因[11]。目前认为病毒性心肌炎的发病机制包括病毒介导的直接损伤以及宿主免疫反应引起的间接损伤[12]。Ammirati 等[13]指出,病毒可以触发免疫反应发挥保护机体的作用,但不均衡的免疫反应可能会导致心肌损伤。研究证实心肌炎患者中I 型IFN、IL-6、TNF-α 等细胞因子表达水平显著升高[14]。
大量实验表明I 型IFN 不仅可诱发肿瘤细胞凋亡,亦可引起正常组织细胞凋亡。本实验用IFN-α刺激HCM,流式细胞术检测发现IFN-α 可诱导HCM 凋亡,且存在剂量依赖性。推测,在暴发性心肌炎发生时,过度表达的I 型IFN 可能会诱发心肌细胞凋亡,造成心肌细胞的直接损伤。Qaisar 等[15]发现,过度活化I 型IFN 信号通路可触发针对胰腺细胞抗原的自身免疫性应答,驱动胰岛炎症部位的细胞发生细胞凋亡。Herzer 等[16]研究发现IFN-α可通过早幼粒细胞白血病蛋白(PML)和肿瘤坏死因子相关凋亡诱导配体(TRAIL)蛋白介导诱发肝癌细胞凋亡。应注意的是,I 型IFN 在宿主对病毒感染的防御中起关键作用,但必须在强度和持续时间上受到严格调控,以防止过度免疫反应导致自身炎症,加重心肌损伤[17]。阻断IFN 调节因子3 依赖的信号通路会诱导心肌炎性因子表达减少,减轻心脏炎性细胞浸润及心室扩张,进而改善心功能[18]。上述研究表明,IFN 对病毒感染存在双重影响,既有利于清除有害病菌,又可加重心肌损伤。
TRIM22 在I 型IFN 致心肌细胞凋亡过程中发挥重要作用。I 型IFN 是一种广谱抗病毒分子,在抗病毒固有免疫应答中发挥重要作用[8]。研究发现,I 型IFN 可诱导单核细胞、淋巴细胞等高表达TRIM22[19],同时Chen 等[10]报道过表达TRIM22 可加速单核细胞凋亡。推测,TRIM22 可能诱发心肌细胞凋亡。本实验发现IFN-α 刺激HCM 6 h 后TRIM22 mRNA 表达显著上调,12 h 达最高,随后逐渐下降。同时IFN-α 诱导HCM 中TRIM22 mRNA高表达呈显著的剂量依赖性。流式细胞术检测发现,与空载体组相比,TRIM22 组心肌细胞凋亡率显著增加。
线粒体融合、分裂过程被称为线粒体动力学,是线粒体网络形成的基础,细胞进行有氧代谢有赖于线粒体网络的形成[20]。线粒体经不断融合,便于受损线粒体的修复、线粒体膜电位的维持以及能量的产生。通过线粒体分裂,细胞可以把受损的线粒体清除出细胞,以维持线粒体的正常功能。本实验经激光共聚焦发现TRIM22 与线粒体存在共定位关系,并且TRIM22 可引发线粒体的广泛交联,影响线粒体的融合及分裂过程,导致线粒体动力学失衡。本研究发现TRIM22 过表达引发HCM 出现多个凋亡小体,呈现典型的细胞晚期凋亡特征;同时凋亡细胞的线粒体出现明显的片段化,提示凋亡细胞的线粒体动力学失衡。线粒体受损后,释放促凋亡因子P53、细胞色素C 等,破坏线粒体电子传递链,导致ATP 生成减少,细胞无法获得充足的能量;同时线粒体膜电位下降,Ca2+内流增加致细胞内钙超载,最终可导致细胞死亡[21]。
综上所述,本研究发现IFN-α 可诱导HCM 高表达TRIM22,TRIM22 可引发线粒体交联,影响线粒体的正常功能,诱导HCM 凋亡。
利益冲突:所有作者均声明不存在利益冲突参考文献
[1]Caforio ALP,Malipiero G,Marcolongo R,et al.Myocarditis:a clinical overview [J].Curr Cardiol Rep,2017,199(7):63.DOI:10.1007/s11886-017-0870-x.
[2]赵妍,王文尧,田间,等.成人急性病毒性心肌炎的临床表现与相关因素分析[J].中国循环杂志,2019,34(6):592-596.DOI:10.3969/ j.issn.1673-4130.2016.06.013.
[3]王小芳,杨露露,肖莉丽,等.体外膜肺氧合治疗成人暴发性心肌炎的疗效分析[J].中国循环杂志,2019,34(12):1186-1190.DOI:10.3969/j.issn.1000-3614.2019.12.008.
[4]Kimura T,Flynn CT,Alirezaei M,et al.Biphasic and cardiomyocytespecific IFIT activity protects cardiomyocytes from enteroviral infection [J].PLoS Pathog,2019,15(4):e1007674.DOI:10.1371/journal.ppat.1007674.
[5]Esposito D,Koliopoulos MG,Rittinger K.Structural determinants of TRIM protein function [J].Biochem Soc Trans,2017,45(1):183-191.DOI:10.1042/BST20160325.
[6]Nisole S,Stoye JP,Saib A.TRIM family proteins:retroviral restriction and antiviral defence [J].Nat Rev Microbiol,2005,3(10):799-808.DOI:10.1038/nrmicro1248.
[7]Vicenzi E,Poli G.The interferon-stimulated gene TRIM22:a double-edged sword in HIV-1 infection [J].Cytokine Growth Factor Rev,2018,40:40-47.DOI:10.1016/j.cytogfr.2018.02.001.
[8]Yang C,Zhao X,Sun D,et al.Interferon alpha (IFN alpha)-induced TRIM22 interrupts HCV replication by ubiquitinating NS5A [J].Cell Mol Immunol,2016,13(1):94-102.DOI:10.1038/cmi.2014.131.
[9]Kang C,Lu Z,Zhu G,et al.Knockdown of TRIM22 relieves oxygen-glucose deprivation/reoxygenation-induced apoptosis and
inflammation through inhibition of NF-κB/NLRP3 axis [J].Cell Mol
Neurobiol,2020,4(25):855.DOI:10.1007/s10571-020-00855-w.
[10]Chen C,Zhao D,Fang S,et al.TRIM22-mediated apoptosis is associated with Bak oligomerization in monocytes [J].Sci Rep,2017,7(1):39961.DOI:10.1038/srep39961.
[11]Buggey J,ElAmm CA.Myocarditis and cardiomyopathy [J].Curr Opin Cardiol,2018,33(3):341-346.DOI:10.1097/HCO.0000000000000514.
[12]Fung G,Luo H,Qiu Y,et al.Myocarditis [J].Circ Res,2016,118(3):496-514.DOI:10.1161/CIRCRESAHA.115.306573.
[13]Ammirati E,Veronese G,Cipriani M,et al.Acute and fulminant myocarditis:a pragmatic clinical approach to diagnosis and treatment[J].Curr Cardiol Rep,2018,20(11):114.DOI:10.1007/s11886-018-1054-z.
[14]Sinagra G,Anzini M,Pereira NL,et al.Myocarditis in clinical practice [J].Mayo Clin Proc,2016,91(9):1256-1266.DOI:10.1016/j.mayocp.2016.05.013.
[15] Qaisar N,Jurczyk A,Wang JP.Potential role of type I interferon in the pathogenic process leading to type I diabetes[J].Curr Opin Endocrinol Diabetes Obes,2018,25(2):94-100.DOI:10.1097/MED.0000000000000399.
[16]Herzer K,Hofmann TG,Teufel A,et al.IFN-alpha-induced apoptosis in hepatocellular carcinoma involves promyelocytic leukemia protein and TRAIL independently of p53 [J].Cancer Res,2009,69(3):855-862.DOI:10.1158/0008-5472.CAN-08-2831.
[17]Oteiza A,Mechti N.Control of FoxO4 activity and cell survival by TRIM22 directs TLR3-stimulated cells toward IFN type I gene induction or apoptosis [J].J Interferon Cytokine Res,2015,35(11):859-874.DOI:10.1089/jir.2015.0020.
[18]King KR,Aguirre AD,Ye YX,et al.IRF3 and type I interferons fuel a fatal response to myocardial infarction [J].Nat Med,2017,23(12):1481-1487.DOI:10.1038/nm.4428.
[19]Rajsbaum R,Stoye JP,O'Garra A.Type I interferon-dependent and -independent expression of tripartite motif proteins in immune cells [J].Eur J Immunol,2008,38(3):619-630.DOI:10.1002/eji.200737916.
[20]谢克亮,王瑶琪,于泳浩,等.脓毒症线粒体动态变化与功能障碍的研究进展 [J].国际麻醉学与复苏杂志,2020,41(5):519-522.DOI:10.3760/cma.j.cn321761-20200216-00042.
[21]李炳龙,刘鹏程,刘翠云.线粒体功能障碍与心力衰竭的关系研究进展 [J].转化医学杂志,2020,9(2):126-129.DOI:10.3969/j.issn.2095-3097.2020.02.016.
