一株新型溶藻弧菌噬菌体φV039C的生物学特性和全基因组分析
2021-12-03陈躬浩付汉清童桂香韦信贤王乃萱
陈躬浩,付汉清,童桂香,韦信贤,王乃萱,林 茂
(1.集美大学水产学院,福建 厦门 361021;2.厦门市渔用药物工程技术研究中心,福建 厦门 361021;3.广西水产科学研究院,广西 南宁 530021;4.广西水产遗传育种与健康养殖重点实验室,广西 南宁 530021)
0 引言
溶藻弧菌(Vibrioalginolyticus)属于弧菌科(Vibrionaceae)弧菌属(Vibrio),为革兰氏阴性短杆菌,无荚膜和芽孢,是广泛存在于海水中的一种条件致病菌。它不仅对于鱼[1]、虾[2]、贝[3]有致病性,同时对于人类也有一定的致病性,能够引起腹泻和食物中毒[4]。而对于溶藻弧菌的防治,养殖户通常使用传统的抗生素或者消毒剂,但抗生素的滥用会导致养殖过程中溶藻弧菌产生耐药性,不仅影响用药效果,同时耐药菌还会随着食物链的传播感染人类,危害人类生命安全[5]。另一方面,随着人们生活水平的不断提高,大众在食品的选择上对绿色理念越发的重视。因此,亟需寻找一种新的既环保、友好又能有效控制水产养殖动物溶藻弧菌病的方法。
噬菌体作为一种微生物病毒,能够侵染并裂解细菌、螺旋体、放线菌等。早在20世纪初期,噬菌体就被认为有替代抗生素的巨大潜力[6-7]。相比于抗生素的高效,有关噬菌体疗法的研究始终落后于抗生素的研究[8]。但随着近年来细菌耐药性问题趋向严峻,研究者重新将目光投向噬菌体,期望能够开发出高效的噬菌体制剂。2009年,Wright等[9]首次在感染多重耐药铜绿假单胞菌的慢性耳炎患者身上使用噬菌体治疗方案,经过治疗后,患者的症状均得到改善,并且没有产生毒副作用。Cao等[10]从临床患者体内分离得到一株多重耐药性肺炎克雷伯菌,并用其感染小鼠,随后使用噬菌体进行治疗,结果发现未使用噬菌体治疗的小鼠在24 h内全部死亡,而使用噬菌体治疗的小鼠存活率则高出许多。此外,噬菌体在弧菌病防治方面的研究也取得了一些成果。Stalin等[11]研究发现,在斑节对虾幼体感染哈维氏弧菌后,使用噬菌体能够有效提高幼体的存活率。胡蝶等[12]将副溶血弧菌制成噬菌体微胶囊,并拌于饲料中投喂方斑东风螺和南美白对虾,发现实验生物的肠道和水体中的宿主菌都有大幅度的减少。于鸽[13]从自然水体中分离得到一株溶藻弧菌噬菌体,并将其用于南美白对虾的攻毒实验,结果表明108pfu/mL的噬菌体溶液的保护率达88.20%。Sasikala等[14]分离得到的一株溶藻弧菌噬菌体能够有效抑制溶藻弧菌的生物膜形成,并且在数个小时后还对溶藻弧菌有杀灭作用。
本文以溶藻弧菌V039为宿主,分离得到一株新型溶藻弧菌噬菌体φV039C,并对其进行了电镜形态观察、最佳感染复数、一步生长曲线等生物学特性的研究,以及全基因测序、序列分析和功能预测,以期更好地了解其裂解机制,为溶藻弧菌的噬菌体治疗提供依据。
1 材料与方法
1.1 材料
宿主菌:病原菌(溶藻弧菌V039)从福建漳浦的对虾养殖场中分离得到,并由本实验室保藏。
主要试剂和仪器:LB肉汤、营养琼脂(NA)、琼脂粉、SM病毒提取缓冲液均购自青岛海博生物技术有限公司;DL15000、DL2000、DNase I、RNase A 和限制性内切酶(EcoR I、EcoR V、BamH I、Hind Ⅲ)均为日本TaKaRa公司产品;TIANamp病毒基因组 DNA/RNA 提取试剂盒购自天根生化科技有限公司;透射电子显微镜(TEM)为美国FEI公司制造产品;离心机(Eppendorf 5427R)为德国艾本德公司产品。
1.2 方法
1.2.1 噬菌体的分离
将取自福建漳浦各对虾养殖场的水样混合于洁净的水桶中,再把培养至对数期的溶藻弧菌V039菌液倒入水样中,混匀后置于30 ℃恒温培养箱中24 h,以富集潜在噬菌体。之后,取5 mL富集液10 000 r/min 离心3 min,上清液用0.22 μm滤膜过滤备用。吸取100 μL V039菌液均匀涂布在营养琼脂(添加体积分数为2%的NaCl)上,吸取10 μL富集液分数滴点于平板上,晾干后置于30 ℃培养,24 h后观察点接处是否有空斑出现,如有空斑即作为溶藻弧菌V039的噬菌体进行挖斑纯化[15]。
1.2.2 噬菌体的纯化与效价测定
采用双层平板法进行纯化和效价测定。将噬菌体形成的空斑挖到SM缓冲液中,4 ℃过夜。用无菌生理盐水将浸提液稀释到合适梯度,吸取100 μL稀释液和100 μL宿主菌液至6 mL半固体(含质量分数为0.65%的琼脂)LB肉汤(提前置于50 ℃保温)中混合均匀,倾倒在营养琼脂(添加体积分数为2%的NaCl)上,凝固后30 ℃培养16 h。挑取单个噬菌斑至SM缓冲液中4 ℃过夜,重复上述操作对分离得到的噬菌体纯化3~5次。噬菌体效价(TT)指的是每毫升样品中含有的具有侵染性的噬菌体颗粒数,又称噬菌斑形成单位数(plaque-forming unit)[16]。检测样品梯度稀释后做双层平板法培养,每个梯度设3个平行,取噬菌斑颗粒数在30~300 pfu之间为有效数据,以平均数计算噬菌体密度。
1.2.3 噬菌体电镜观察
取噬菌体增殖液 20 μL(>1010pfu/mL)滴到铜网上吸附 30 min,用2%(体积分数)磷钨酸(PTA)负染10 min,室温干燥后,用透射电子显微镜观察并拍摄噬菌体的形态,同时测量头部直径等数据[17]。
1.2.4 噬菌体基因组的提取和酶切分析
取噬菌体增殖液(≥1010pfu/mL)至无菌EP管中,分别加入DNase I与RNase A于37 ℃反应1 h,以去除噬菌体增殖液中游离的宿主菌 DNA/RNA,80 ℃处理15 min使酶失活。之后,利用TIANamp病毒基因组DNA/RNA 试剂盒提取噬菌体基因组。
酶切反应体系为10 μL[18]。分别取噬菌体基因组8 μL 于6个无菌PCR管中,再分别加入1 μL的酶(DNase I、RNase A、EcoR I、EcoR V、BamH I、Hind III)以及1 μL的10×Loading Buffer,于37 ℃反应1 h。将酶切产物置于1%(质量分数)琼脂糖凝胶中电泳(110 V) 24 min,使用凝胶成像系统观察电泳结果。
1.2.5 噬菌体最佳感染复数测定
感染复数(multiplicity of infection,MOI),指的是噬菌体在感染开始时噬菌体与宿主菌的比值。测定方法参考张文惠等[19]的实验方法,培养宿主菌液至生长对数期,按MOI值为1000、100、10、1、0.1、0.01、0.001、0.0001、0.000 01各吸取50 μL的噬菌体液和宿主菌液到900 μL无菌LB肉汤中,30 ℃、160 r/min培养 8 h,10 000 r/min离心2 min,用0.22 μm滤膜过滤,测定噬菌体效价。效价最高的感染复数即为最佳感染复数。
1.2.6 噬菌体一步生长曲线测定
参考王九儒等[20]的研究方法,按照感染复数为0.1的比例,混合噬菌体液和宿主菌液,宿主菌液浓度为1×108cfu/mL,总体积为1 mL,30 ℃孵育10 min,让噬菌体充分吸附在宿主菌上,10 000 r/min离心2 min,弃上清液,用 LB 肉汤洗涤2次去除未吸附的噬菌体,加入1 mL LB肉汤重悬。置于30 ℃的恒温培养箱中振荡培养,并开始计时,分别在0、10、20、30、40、50、60 min时间点取样,测定噬菌体效价并绘制生长曲线。
1.2.7 噬菌体的全基因组测序及生物信息学分析
噬菌体φV039C的基因组利用第三代单分子测序平台(PacBio SMRT)进行全基因组测序分析。利用 GeneMarkS(http://topaz.gatech.edu/GeneMark/)网站进行基因预测。使用在线 blastp 工具(http://www.ncbi.nlm.nih.gov/BLAST) 进一步对预测的基因进行注释。使用软件DNA Plotter绘制全基因组圈图。用MEGA 7.0软件,选择N-乙酰壁氨酰-L-丙氨酸酰胺酶(ORF6)和大亚基终止酶(ORF19)两种蛋白进行系统进化树的构建。
2 实验结果与分析
2.1 噬菌体形态特征
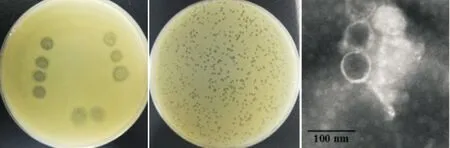
以溶藻弧菌V039为宿主,采用点斑法筛选得到噬菌体φV039C(见图1a),经纯化后得到的噬菌斑清晰,直径在1 mm左右,呈现出透明、无晕圈的形态(见图1b)。通过电镜观察(见图1c),该噬菌体的头部结构是正廿面体结构,头部直径(58.9±2.9)nm,尾长(105.2±5.7)nm。根据国际病毒分类委员会(ICTV)第九次报告的病毒分类系统[21],噬菌体φV039C在分类上可能属于有尾噬菌体目(Caudovirales)长尾噬菌体科(Siphoviridae)。
2.2 噬菌体基因组酶切结果
酶切产物电泳结果(见图2)显示:噬菌体φV039C的基因组能被DNase I降解,但不能被RNase A降解,说明其基因组类型是DNA;电泳结果也表明其基因组上有EcoR V、Hind Ⅲ和EcoR I的酶切位点,但没有BamH I酶切位点。因此,噬菌体φV039C基因组类型属于dsDNA。
2.3 噬菌体的最佳感染复数
按照不同的感染复数(MOI)混合噬菌体和宿主菌液培养8 h之后,用双层板测定各个MOI 的效价。实验结果(见表1)表明,当噬菌体与宿主比值为0.1时,噬菌体效价最高,能够达到3.34×1010pfu/mL,因此噬菌体φV039C的最佳感染复数为0.1。

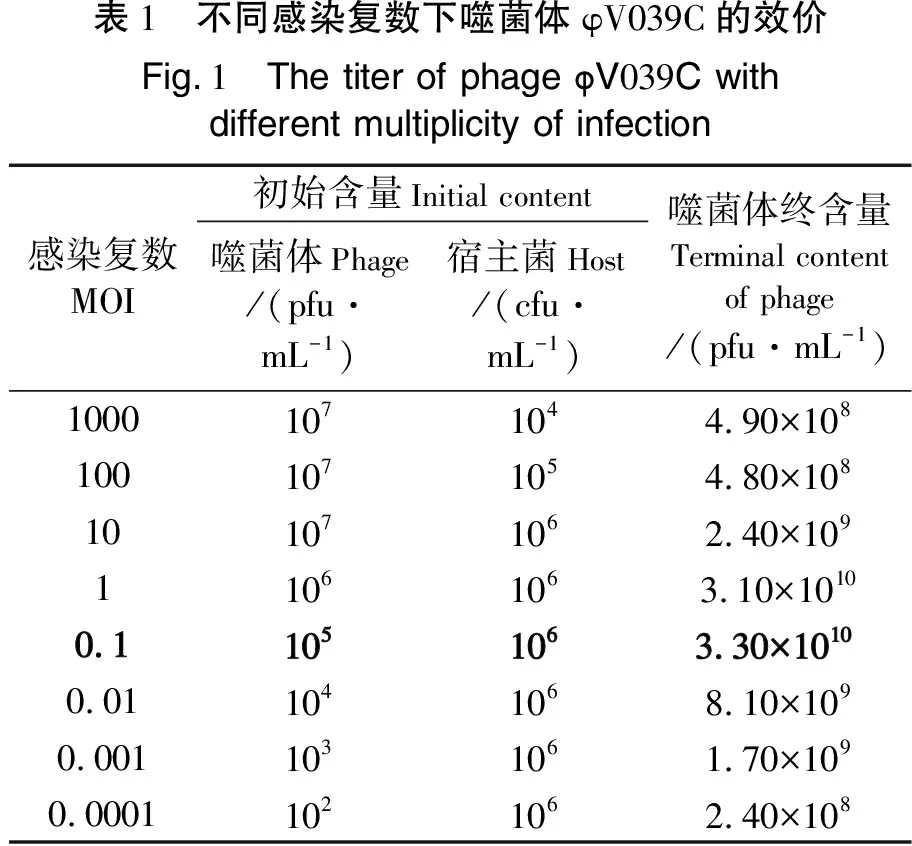
表1 不同感染复数下噬菌体φV039C的效价Fig.1 The titer of phage φV039C withdifferent multiplicity of infection感染复数MOI初始含量Initial content噬菌体Phage/(pfu·mL-1)宿主菌Host/(cfu·mL-1)噬菌体终含量Terminal contentof phage/(pfu·mL-1)10001071044.90×1081001071054.80×108101071062.40×10911061063.10×10100.11051063.30×10100.011041068.10×1090.0011031061.70×1090.00011021062.40×108
2.4 噬菌体的一步生长曲线
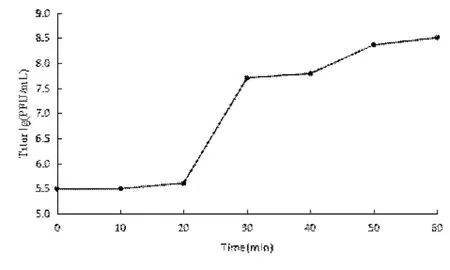
由噬菌体φV039C的一步生长曲线(见图3)可得出,噬菌体与宿主菌混合培养20 min,效价无明显变化,因此噬菌体φV039C的潜伏期为20 min;20—30 min噬菌体效价呈现上升趋势;30 min后噬菌体效价稳定。由此得,噬菌体爆发期为培养后10 min。噬菌体裂解量=爆发期末期噬菌体密度/初始受感染宿主菌密度=(5.06×107)/(3.10×105)=163 pfu/cell。
2.5 噬菌体全基因组分析
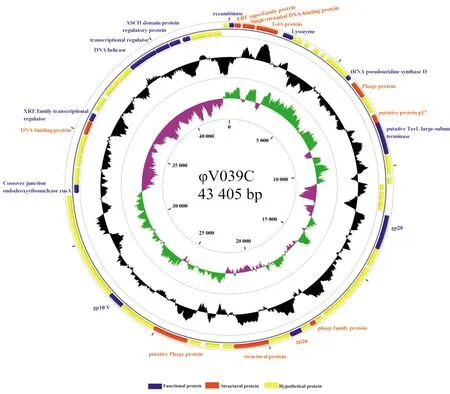
第三代单分子测序平台测序结果表明,噬菌体φV039C的基因组(GenBank登录号MN956515)为环形双链DNA,全长为43 405 bp,G+C含量为42.95%(见图4)。共注释得到77个开放阅读框(open reading frame,ORF)。其中,已知功能阅读框有17个,假想蛋白有20个,未注释出的阅读框有40个。核酸序列长度在213~2436 bp,对应的蛋白质序列长度在71~812。所有ORF共含有40 870 bp的碱基,基因组的基因密度为94.20%。
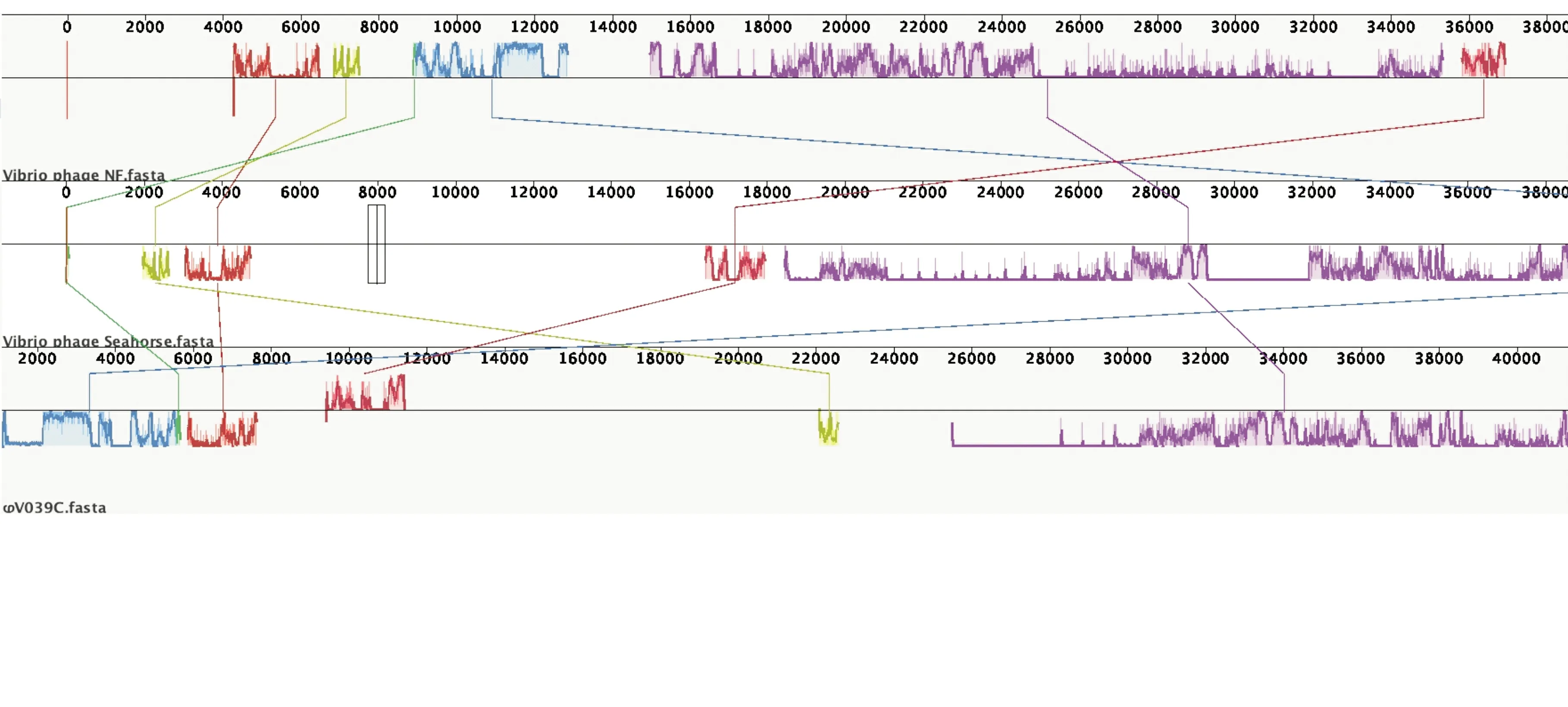
用NCBI网站的blastn(megablast)程序进行噬菌体φV039C的基因序列比对,在得到的同源序列中,噬菌体φV039C与溶藻弧菌噬菌体NF(MN812722)、副溶血弧菌噬菌体Seahorse(MN512538)的比对覆盖率最高,同为11%,一致性分别为92.2%和93.3%,即从基因组来看,噬菌体φV039C与这二者最为接近。二者在分类上均属于有尾噬菌体目长尾噬菌体科。噬菌体φV039C与溶藻弧菌噬菌体PVA1(KJ395778)的覆盖率次之,为2%,其余检索结果覆盖率仅为1%。使用Mauve软件对3个基因组进行共线性比对分析(见图5),发现三者相互之间存在5个同源片段,但位置、顺序不同,相似性也不高。
由全基因组的比对结果可见,噬菌体φV039C与现有NCBI登录的其他噬菌体基因组相似区的比例很低,是一株新型的溶藻弧菌噬菌体。
2.6 噬菌体φV039C功能性ORF的分析
对噬菌体φV039C的基因组进行ORF注释,共注释出74个ORF(见表2)。
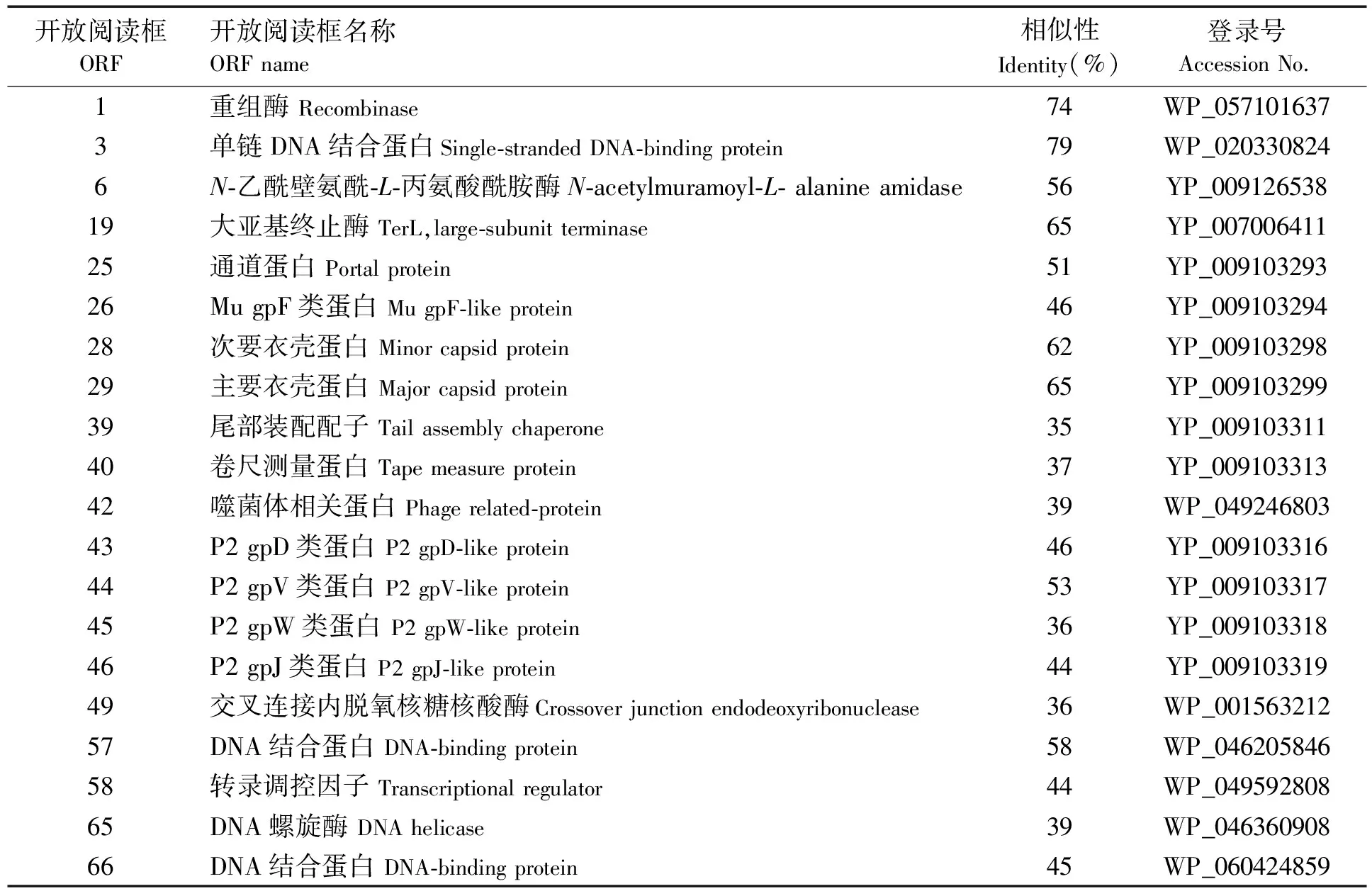
表2 噬菌体φV039C的开放阅读框注释表
表2中的ORF1(重组酶)、ORF3(单链DNA结合蛋白)、ORF49(连接内脱氧核糖核酸酶)、ORF57(DNA结合蛋白)、ORF58(转录调控因子)、ORF65(DNA螺旋酶)、ORF66(DNA结合蛋白)与噬菌体DNA复制有关;ORF6(N-乙酰壁氨酰-L-丙氨酸酰胺酶)为裂解酶,属于噬菌体的裂解系统;ORF25(孔道蛋白)、ORF28(次要衣壳蛋白)、ORF29(主要衣壳蛋白)、ORF39(尾部装配子)等属于噬菌体结构蛋白。
2.7 噬菌体φV039C比较基因组学和系统发育树的构建
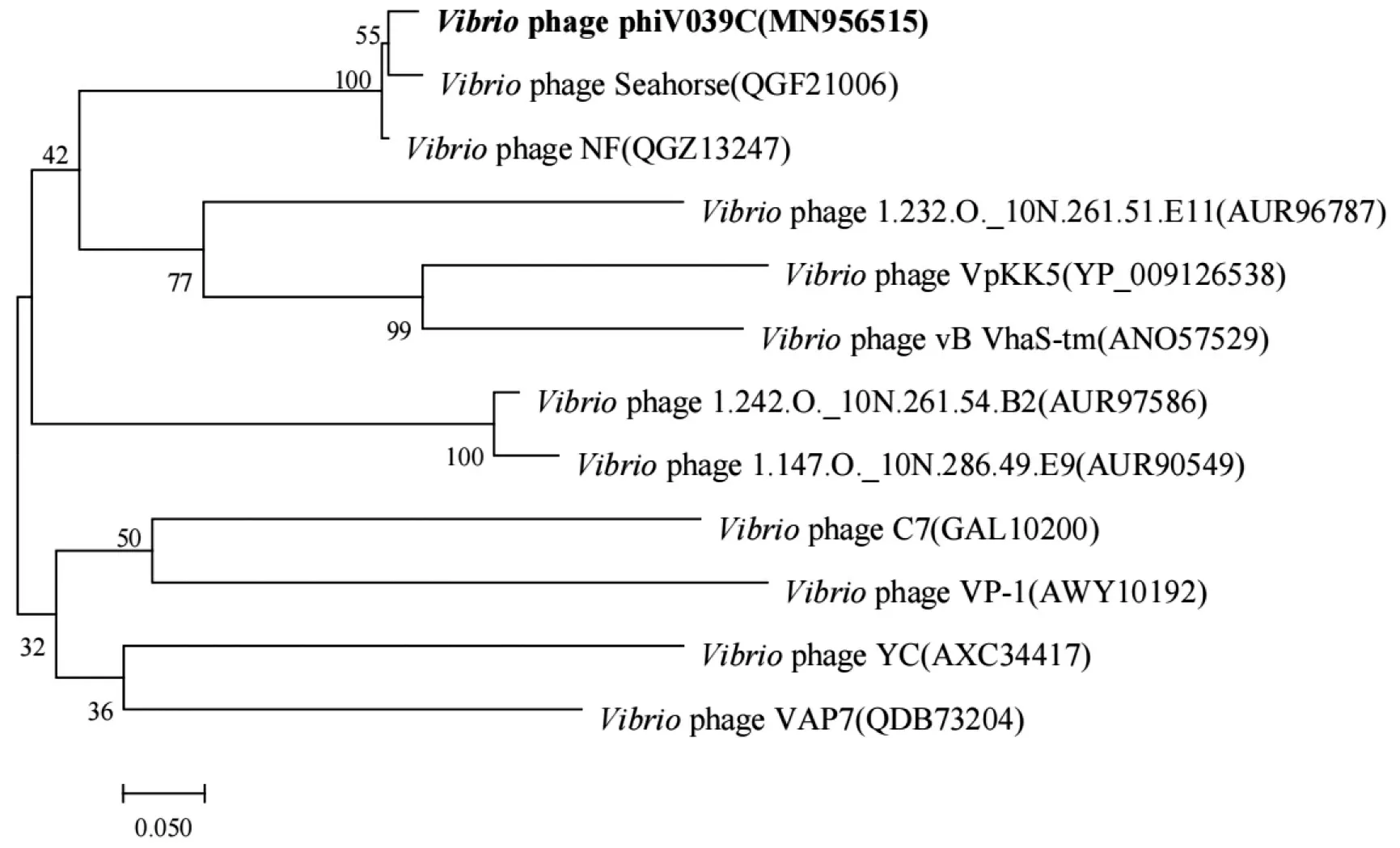
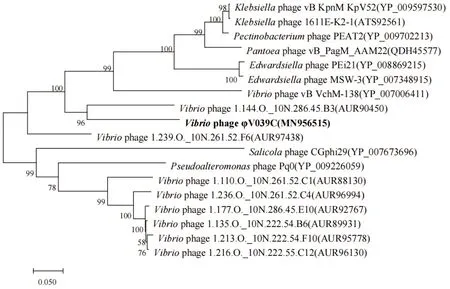
为探究噬菌体φV039C与其他噬菌体的进化关系,选择N-乙酰壁氨酰-L-丙氨酸酰胺酶(ORF6)和大亚基终止酶(ORF19)两种蛋白进行系统进化树的构建。从基于N-乙酰壁氨酰-L-丙氨酸酰胺酶构建的系统进化树可以看出,φV039C与副溶血弧菌噬菌体Seahorse、溶藻弧菌噬菌体NF有着较近的亲缘关系(见图6),这与全基因组的blast结果相近。而从基于大亚基终止酶构建的系统进化树可以看出,噬菌体φV039C与灿烂弧菌噬菌体1.144.0._10N.286.45.B3在同一分支上(见图7),后者在分类上也同样属于长尾噬菌体科。综上所述,噬菌体φV039C在分类上应归属有尾噬菌体目长尾噬菌体科。
3 讨论
在抗生素广泛使用的今天,细菌耐药性已然成为21世纪人类健康最大的威胁之一。而噬菌体在替代抗生素进行细菌性疾病的治疗方面有很大的应用潜力。目前文献报道的噬菌体大部分属于有尾噬菌体目,其最大特点就是有与宿主识别和核酸注射有关的尾部[22]。而有尾噬菌体目包括短尾噬菌体科(Podoviridae)、肌尾噬菌体科(Myohoviridae)和长尾噬菌体科。Lin等[23]和张建城[24]的研究中所分离得到的溶藻弧菌噬菌体属于短尾噬菌体科;付汉清等[25]和欧阳敏等[26]分离得到的溶藻弧菌噬菌体属于肌尾噬菌体科;本研究分离得到的溶藻弧菌噬菌体 φV039C在分类上应属于长尾噬菌体科,其拥有长且灵活的尾部。溶藻弧菌的噬菌体尾部形态多样,对噬菌体的吸附与侵染具有重要作用,同时也是分类上非常重要的判断依据。
噬菌体φV039C的基因组与数据库中已知的基因组相似区覆盖率较低,是一株完全新型的噬菌体。在φV039C的基因组注释出的74个ORF中,有20个是已知功能的ORF(占比27%),其余为未知功能的假想蛋白。而据于浩[27]、沈婵娟[28]、江莉莎等[29]、韦德源等[30]的报道,其研究对象——根瘤菌、嗜水气单胞菌、分歧杆菌、大肠杆菌的噬菌体基因组中已知功能的ORF占比分别为18%、25%、34%、44%,这说明大部分噬菌体还存在许多未知功能的基因。
大多数烈性噬菌体的遗传物质中都有与编码复制相关的酶的区域[31]。同样,噬菌体φV039C已知功能ORF中也有多个与DNA复制调控、核酸代谢有关的ORF(ORF1、ORF49、ORF57、ORF58、ORF65等),这些蛋白帮助其遗传物质进入宿主细胞后利用宿主的酶系统进行自身遗传物质的复制和蛋白的表达。其中,ORF49(交叉连接内脱氧核糖核酸酶)能够水解宿主细胞内的脱氧核糖核酸,以便为噬菌体合成DNA提供脱氧核糖核苷酸[32]。
噬菌体的基因组有多种类型,分别为ssDNA、dsDNA、ssRNA、dsRNA[22]。本研究中噬菌体φV039C基因组类型属于dsDNA,而dsDNA噬菌体组装的重要步骤就是将DNA紧紧包裹在衣壳中[33]。这一过程需要大亚基终止酶、小亚基终止酶和通道蛋白组合成一个“DNA包装机”来协助完成[34]。另外,通道蛋白还能够帮助噬菌体在自身衣壳中形成通道,使其能够更好地将自己的基因组注射到宿主细胞中[35]。噬菌体φV039C的ORF19和ORF25分别编码大亚基终止酶和通道蛋白,但是未发现编码小亚基终止酶的ORF。
噬菌体可用于分类的形态特征太少,同源基因也不多。裂解酶是噬菌体中比较常见的一类基因,在分类上具有重要的价值。裂解酶根据作用方式可以分为三种,分别是溶菌酶、酰胺酶和内肽酶[36]。高明明等[37]分离到的肺炎克雷伯菌噬菌体的裂解系统仅有一个相关基因ORF48(细胞内溶素),属于溶菌酶。溶菌酶是常见的裂解酶,其作用方式是作用于细菌细胞壁上的肽聚糖,增加其溶解性,使细胞由内部破裂,释放子代噬菌体[38]。本研究中噬菌体φV039C的裂解系统也仅有一个相关基因,即ORF6(N-乙酰壁氨酰-L-丙氨酸酰胺酶),属于酰胺酶,其作用方式是水解细胞壁中的N-乙酰胞壁酸和L-丙氨酸之间的酰胺键,从而使宿主细胞破裂,释放子代噬菌体。此外,噬菌体因其宿主特异性较高,在实际应用中有较大的限制,而裂解酶的宿主特异性较小,因此越来越多的学者开始专注于噬菌体裂解酶的研究及裂解酶的克隆表达。
噬菌体φV039C的结构蛋白中,ORF28和ORF29分别编码次要衣壳蛋白和主要衣壳蛋白。衣壳蛋白作为噬菌体的外壳,能够紧紧地包裹住噬菌体的遗传物质。因其编码序列具有高度的保守性,所以也常用于噬菌体的分类[39]。ORF39(尾部装配配子)和ORF40(卷尺测量蛋白)与尾部的装配以及部分功能有关,卷尺测量蛋白能够在噬菌体尾部伸缩时控制尾部的长度[40]。
虽然噬菌体在自然界丰度极高(据估计超过1031个),但是目前NCBI Genome数据库中仅有9000余条噬菌体完整基因组,且没有对应宿主的基因组信息,因此噬菌体在基因组及其功能注释的研究方面还存在很多未知领域。本文对分离得到的一株新型溶藻弧菌噬菌体φV039C进行生物学特性和全基因组的研究,对探索噬菌体未知领域,以及进一步将噬菌体投入到实际应用提供了重要的理论依据。
