牛源性大肠杆菌O26热休克-酸应激响应
2021-12-03宓晓雨王思亓赵王晨禹金龙林思棋王龙凤
宓晓雨,张 苏,王思亓,赵王晨,禹金龙,林思棋,王龙凤,江 芸
(南京师范大学食品与制药工程学院,江苏 南京 210023)
大肠杆菌O157:H7是重要的食源性致病菌,然而近年来非O157大肠杆菌,尤其是“Big six”血清型(O26、O45、O103、O121、O111、O145)所引发的食品安全事件越来越受到国内外广泛关注,其中O26是威胁人类健康的最重要的非O157大肠杆菌,居“Big six”之首[1-3]。反刍动物,尤其是牛,是致病大肠杆菌的主要宿主。本课题组前期从牛粪、牛肉中对非O157大肠杆菌进行了分离鉴定,也发现O26是最主要的血清型[4]。与大肠杆菌O157:H7相似,O26也可导致人体腹泻,以及出血性肠炎、溶血性尿毒综合症等严重并发症[1,5]。
食品加工贮藏过程中各种措施可对腐败菌和致病菌产生应激胁迫,导致有害菌损伤或死亡,有效延长货架期。一般认为多种措施联合应用时,可发挥栅栏效应,增强抑菌效果[6-7]。然而,有研究发现,细菌在多重应激条件下有可能产生交叉保护现象,增强有害菌的抗性,从而提高存活能力,加大食品安全的风险[8-9]。酸化是食品加工中常见措施,其中酸性洗液或发酵食品中存在的乳酸可有效抑制有害菌的生长繁殖。加热也是食品工业中广泛应用的技术之一。早期有研究发现,热休克处理可增强大肠杆菌O157:H7的耐酸能力,提高存活率[10-11]。目前,热休克-酸应激对非O157大肠杆菌的存活,尤其是对应激相关基因表达的影响鲜有报道。因此,本实验以前期分离的牛源性大肠杆菌O26为研究对象[4],首先比较22 株牛源性O26酸耐受能力,再选取代表菌株研究热休克-酸应激对其存活及应激相关基因表达的影响。旨在为非O157大肠杆菌的食品安全风险评估提供理论基础,为实际生产加工中非O157大肠杆菌的有效控制提供科学依据。
1 材料与方法
1.1 材料与试剂
22 株大肠杆菌O26,由本实验室前期分离自牛粪和牛肉,其中携带毒力基因的有3 株,包括G13Z1(stx1+、hly+)、G10Z1(hly+)、133Z(hly+)。
胰蛋白胨大豆肉汤(tryptic soy broth,TSB)、胰蛋白胨大豆琼脂(tryptone soya agar,TSA)、酵母浸粉(yeast extract,YE) 北京陆桥公司;乳酸、盐酸、pH值校正缓冲溶液、磷酸盐缓冲液(phosphate buffer solution,PBS) 南京化学试剂有限公司;细菌RNA提取试剂盒、反转录试剂盒、实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒 大连宝生物工程有限公司;实验用引物由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
IS128C pH计 上海仪迈仪器科技有限公司;HH-S2数显恒温水浴锅 金坛市医疗器械厂;SW-CJ-2F超净工作台 苏州安泰空气技术有限公司;DHP-9052电热恒温培养箱 上海一恒科技公司;SG403A生物安全柜 美国Baker公司;7500 real-time PCR仪美国Applied Biosystems公司;Nanodrop-2000核酸蛋白分析仪 美国Thermo公司;2-16KL高速冷冻离心机美国Sigma公司。
1.3 方法
1.3.1 菌种培养
将22 株O26冻存菌液分别经TSA划线培养,37 ℃培养24 h,挑取单菌落分别接种于3 mL TSB中,220 r/min、37 ℃ 振荡培养18 h,再转接至100 mL TSB中,220 r/min、37 ℃振荡培养18 h,约至9(lg(CFU/mL))。
1.3.2 酸耐受实验
吸取1.3.1节菌液10 mL,8 000×g、4 ℃离心10 min,沉淀用PBS(pH 7.2)洗涤2 次,分别重悬于等体积的盐酸酸化TSB(pH 2.0)、乳酸酸化TSB(pH 3.5)中,37 ℃应激处理2 h,离心,沉淀用PBS洗涤重悬终止应激反应。TSA-YE平板37 ℃培养24 h计数。进一步计算应激后相对于应激前菌数的存活率。
1.3.3 热休克-酸应激实验
根据乳酸耐受情况,选取代表菌株混合菌液进行热休克-酸应激存活实验,进一步根据存活情况,选取代表菌株进行应激基因表达分析。
1.3.3.1 应激处理
热休克处理:将1.3.1节代表菌株的菌液等量混合,吸取10 mL,8 000×g、4 ℃离心10 min,沉淀用PBS(pH 7.2)洗涤2 次,重悬于10 mL TSB中,48 ℃水浴15 min,冰水浴3 min终止[12-14]。
分别取热休克菌液和未热休克菌液0.1 mL接种于乳酸酸化的9.9 mL TSB(pH 3.5),37 ℃应激处理2、4、6、8 h,前者为热休克-酸应激组,后者为酸应激组。同时未热休克菌液0.1 mL接种于9.9 mL正常TSB作为对照组。TSA-YE培养计数。
1.3.3.2 应激基因表达分析
应激处理2、4 h样品,离心、PBS洗涤重悬、再离心,菌体沉淀按试剂盒说明书提取总RNA,进一步检测总RNA的浓度和纯度,当A260nm/A280nm在1.8~2.0时表明纯度较好。
cDNA合成:首先用RNase-free DNase I去除基因组DNA以保证反转录效应。采用反转录试剂盒,反转录体系为20 μL,其中PrimeScrept RT Master Mix 6 μL,total RNA终质量浓度50 ng/μL,RNase Free dH2O补足体积。反转录条件为:37 ℃反转录反应15 min;85 ℃反转录失活反应5 s;4 ℃,∞。cDNA于-20 ℃冻存。
real-time PCR:引物序列如表1所示[15-19],用于扩增大肠杆菌O26的一般应激基因rpoS、酸应激相关基因(asr、ycfR、gadA)及热应激相关基因(rpoH、dnaK、clpB、groEL),内参基因为rrsA[15]。PCR扩增体系(20 μL)为SYBR Premix ExTaq(2×)10 μL,ROX Reference Dye II(50×)0.4 μL,cDNA模板1.0 μL,上下游引物各0.4 μL,RNase Free水补足。PCR程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火和延伸30 s(40 个循环);60~95 ℃,熔点分析。
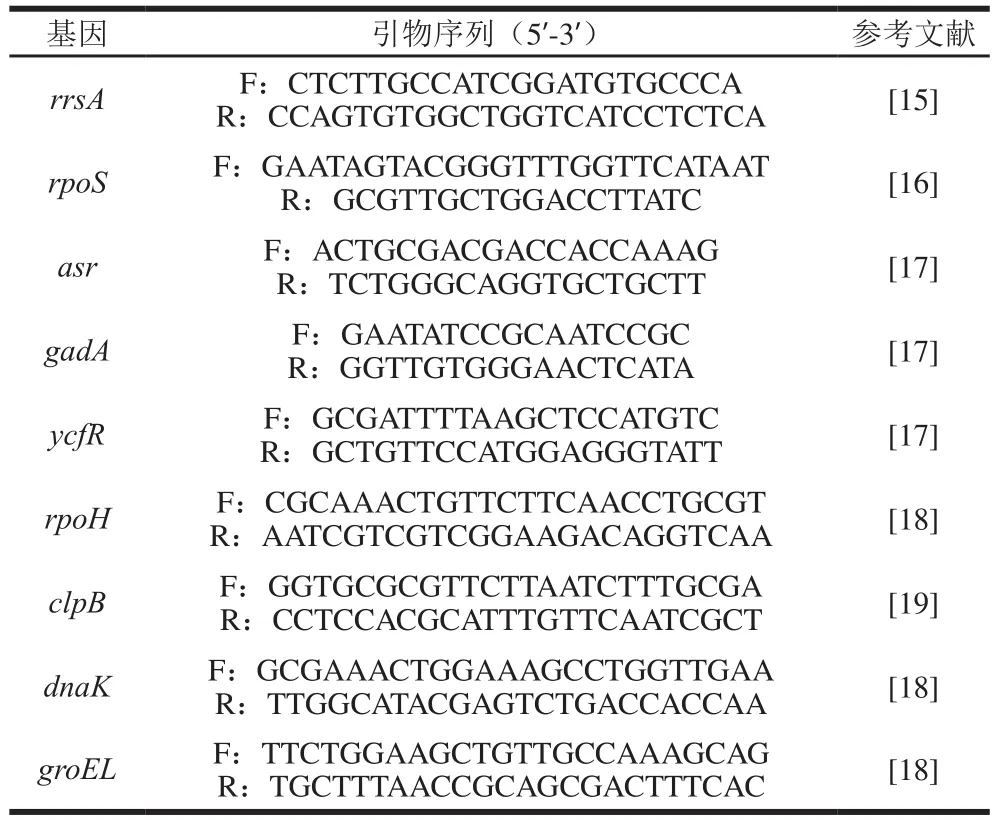
表1 应激相关基因real-time PCR引物Table 1 Real-time PCR primer sequences for stress response genes
1.4 统计分析
2 结果与分析
2.1 大肠杆菌O26菌株酸耐受比较
盐酸耐受实验发现,盐酸处理2 h后22 株菌存活菌数均显著下降(P<0.05),但耐受情况存在菌株差异,其中菌株133Z(hly+)存活率最高(92.92%),而菌株G13Z1(stx1+、hly+)下降最明显,存活率为57.98%(图1A)。乳酸耐受实验发现,乳酸处理2 h后22 株菌存活菌数均显著下降(P<0.05),耐受情况亦存在菌株差异,菌株43SZ、77Z2、1Z2、G13Z1(stx1+、hly+)乳酸耐受较强,存活率达84%以上,其中菌株43SZ存活率最高(91.08%);菌株G10Z1(hly+)(65.46%)、83Z2(63.43%)、83Z3(62.54%)存活率较低(图1B)。
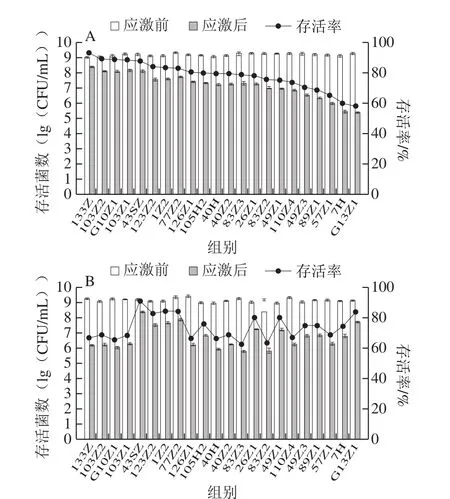
图1 22 株大肠杆菌O26盐酸(A)和乳酸(B)耐受结果Fig.1 Hydrochloric acid (A) and lactic acid (B) tolerance of 22 E.coli O26 isolates
综合两种酸的耐受情况,22 株菌对盐酸和乳酸的耐受存在不同,菌株43SZ、123Z1对盐酸和乳酸均较耐受,G13Z1(stx1+、hly+)不耐盐酸,对乳酸则有较高耐受能力,而G10Z1(hly+)不耐乳酸,对盐酸则有较高耐受能力。另外,实验发现3 株毒力基因阳性的O26菌株G13Z1(stx1+、hly+)、G10Z1(hly+)、133Z(hly+)并没有呈现出很强的耐受能力。
2.2 热休克-酸应激对大肠杆菌O26存活的影响
根据酸耐受情况,选取以下5 株菌进行热休克-乳酸应激:43SZ(盐酸和乳酸耐受力均较强)、G13Z1(盐酸耐受力最弱、乳酸耐受力较强)、49Z3(盐酸耐受力较弱、乳酸耐受力中等)、G10Z1(盐酸耐受力较强、乳酸耐受力较弱)、83Z3(盐酸耐受力中等、乳酸耐受力较弱)。如图2所示,混菌初始菌数约7.0(lg(CFU/mL)),在对照组中菌数逐渐增加,8 h后达到9.0(lg(CFU/mL))以上。酸应激组,应激2 h存活菌数即显著下降(P<0.05),随着应激时间的延长存活菌数继续下降,至8 h时已检测不出。热休克-酸应激组,应激后存活菌数亦逐渐下降,但应激4 h及以后存活菌数均显著高于酸应激组(P<0.05),表明热休克处理提高了酸应激菌体的存活。
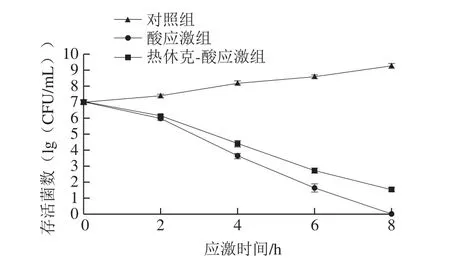
图2 大肠杆菌O26热休克-酸应激存活实验结果Fig.2 Survival of E.coli O26 under heat shock-acid stress
2.3 热休克-酸应激对大肠杆菌O26应激相关基因表达的影响
选取菌株G10Z1(hly+,分离自牛肉)进一步分析热休克-酸应激2、4 h时其应激相关基因表达差异。rpoS基因表达情况与对照组相比,酸应激2、4 h均显著下调(P<0.05)、热休克-酸应激组均显著上调(P<0.05);与酸应激组相比,热休克-酸应激组均显著上调(P<0.05)(图3)。
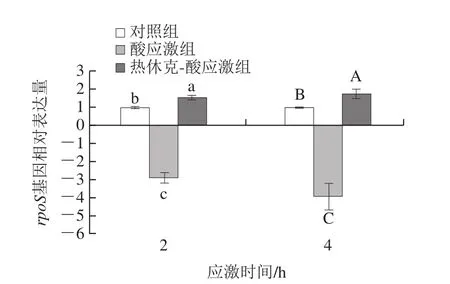
图3 热休克-酸应激时大肠杆菌O26 rpoS基因表达Fig.3 Expression of rpoS in E.coli O26 under heat shock-acid stress
酸应激相关基因asr、ycfR、gadA表达情况见图4。其中asr基因酸应激2、4 h均显著下调,热休克-酸应激组与酸应激组相比显著上调(P<0.05)。ycfR基因酸应激2 h显著下调,4 h显著上调,而热休克-酸应激组2、4 h均显著上调。gadA基因应激后均显著下调(P<0.05),且热休克-酸应激组下调更明显。

图4 热休克-酸应激时大肠杆菌O26酸应激相关基因表达Fig.4 Expression of acid stress response genes in E.coli O26 under heat shock-acid stress
热应激相关基因rpoH、clpB、dnaK、groEL表达见图5。酸应激2、4 h,4 种基因均显著下调;热休克-酸应激组4 种基因除clpB、groEL2 h下调,其他均显著上调(P<0.05)。
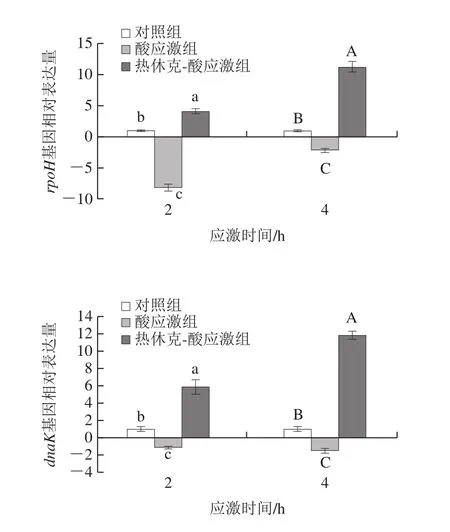
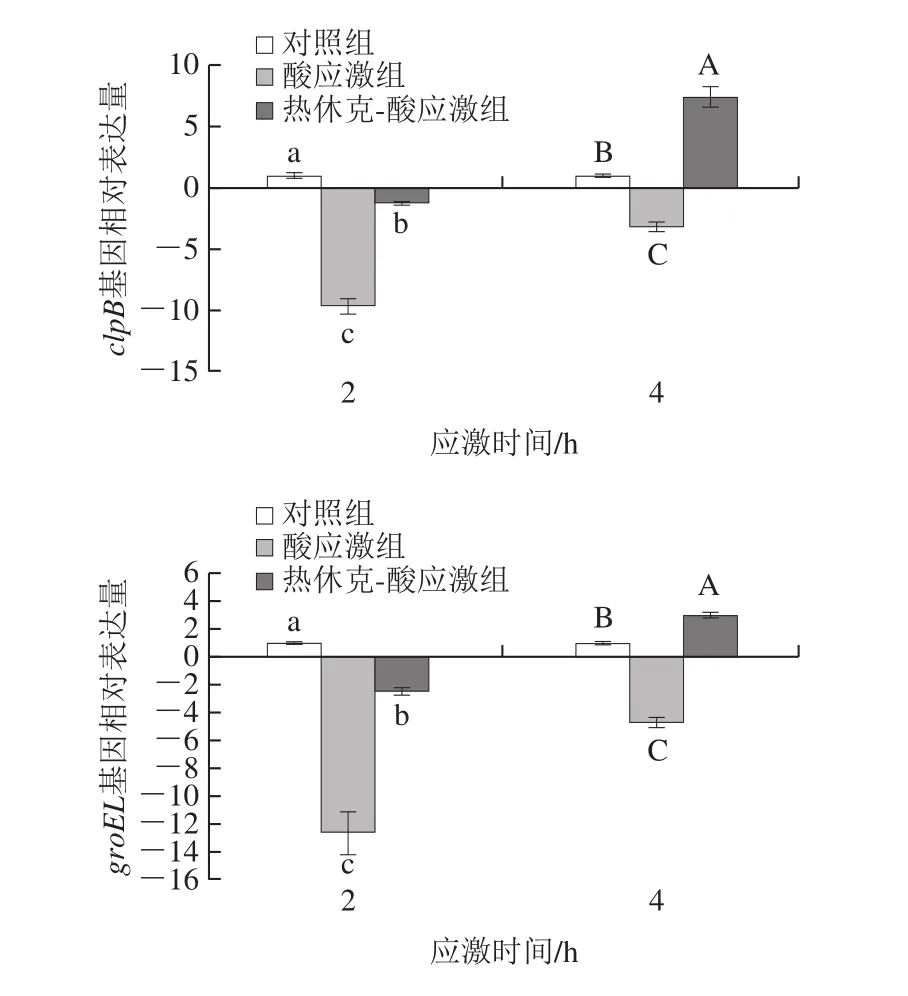
图5 热休克-酸应激时大肠杆菌O26热应激相关基因表达Fig.5 Expression of heat stress response genes in E.coli O26 under heat shock-acid stress
综上,与对照组相比,菌株O26酸应激2、4 h基因表达水平显著下调(除ycfR4 h组);与酸应激组相比,热休克-酸应激2、4 h基因表达水平显著上调(除gadA基因)。
3 讨 论
乳酸在食品生产加工中广泛存在,对食源性致病菌具有良好的抑制和杀灭效应[21]。由于菌株差异,其应激响应机制的不同,导致对乳酸应激呈现不同的应激存活反应。本实验对22 株牛源性大肠杆菌O26进行耐酸性比较,发现大肠杆菌O26对乳酸耐受存在明显菌株差异。实验还发现同一菌株对乳酸、盐酸的耐受性不同,这与细菌对有机酸和无机酸的应激响应机制不同有关[22-23]。
食品生产加工中栅栏技术的使用,不同栅栏因子联合应用可发挥协同杀菌效应,显著增强抑菌效果[6-7];另一方面,交叉保护效应的存在[8-9]也越来越引起研究者的重视。加热是重要的生产加工手段,可有效控制有害菌,而加热不充分、温热处理也有可能提高热休克菌体对致死性应激的耐受能力,产生交叉保护。Wiegand等[10]发现热休克处理(48.3 ℃或49.4 ℃,5 min)提高了碎牛肉中大肠杆菌O157:H7经54.4 ℃处理后的存活菌数。热休克处理(47 ℃,15 min)提高了阪崎克罗诺杆菌(Cronobacter sakazakii)对低温和冷冻、干燥、高渗透、酸、乙醇、抗感染剂等多种应激的耐受[12,24]。Tetteh等[13]发现热休克处理(48 ℃,15 min)增强了福氏志贺菌(Shigella flexneri)对醋酸、乳酸、丙酸的耐受能力。Wang等[11]发现热休克处理(48 ℃,10 min)增强了大肠杆菌O157:H7对盐酸的耐受能力。本实验发现热休克处理(48 ℃,15 min)增强了大肠杆菌O26的乳酸耐受能力,存活菌数显著提高,表明热休克对酸应激菌体产生了交叉保护,这将增加食品安全风险,需引起重视。
应激过程中相关基因参与细菌的应激响应。大肠杆菌于非致死性酸性条件下可诱导多种耐酸系统和相关基因表达[25]。rpoS基因是调节一般应激反应的主要调节因子,可保护细菌免受有害环境条件的伤害[26]。Lee等[27]研究报道酸性条件(pH 4.4)诱导鼠伤寒沙门氏菌rpoS蛋白表达上调。然而,Yang Yishan等[28]研究发现肠炎沙门氏菌长期暴露于乳酸条件并未上调rpoS表达,King等[29]也发现大肠杆菌酸性pH值时rpoS水平较中性pH值低,本实验乳酸(pH 3.0)应激后大肠杆菌O26rpoS基因表达也下调。上述报道不完全一致的原因可能与菌种、菌株、酸浓度、应激时间等有关。本实验中热休克-酸应激O26菌株rpoS基因表达上调,表明热休克产生的交叉保护与rpoS基因的表达有关。
asr基因在酸应激中起关键作用[17]。谷氨酸依赖型耐酸系统是大肠杆菌最有效的耐酸系统,gadA、gadB、gadC是主要的关键基因[25]。本实验乳酸应激后酸应激相关基因的表达基本下调,可能是该酸性条件对菌株G10Z1来说应激程度强烈,达到致死性水平。进一步热休克处理导致上述基因表达上调,表明热休克的交叉保护与这些酸应激基因的表达有关。Carruthers等[30]采用转录组学发现大肠杆菌O157:H7热休克处理(50 ℃,15 min)导致82 个基因上调,包括rpoH、dnaK、groEL等。本实验乳酸应激后O26的rpoH、dnaK、groEL、clpB基因表达均显著下调,但热休克-酸应激处理基本上调,表明热休克的交叉保护与这些热应激基因的表达调控有关。
4 结 论
本实验选取牛源性O26菌株乳酸耐受性能不同的菌株混合进行热休克-酸应激存活实验,发现O26酸耐受程度呈现菌株差异,且同一菌株对乳酸、盐酸的耐受情况有差异。热休克-酸应激存活实验发现,应激导致存活菌数显著下降,而热休克可发挥交叉保护效应,增强了O26抗酸能力。酸应激导致应激相关基因表达基本下调,而热休克-酸应激与酸应激菌体相比上述基因表达基本上调,表明热休克可能通过增加应激相关基因的表达发挥交叉保护作用。本实验结果提示,当非致死性热处理与酸化联合使用时应注意交叉保护可能导致的O26食品风险增加的现象。在食品实际生产加工中,当多种措施联合应用时食源性致病菌的风险评估及如何科学有效控制值得加强重视。
