射频等离子体活性水处理对火腿发色的影响
2021-12-03李季林陈雅淇成军虎
李季林,陈雅淇,成军虎,*
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.华南理工大学 现代食品工程研究中心,广东 广州 510006)
亚硝酸盐是肉制品中广泛应用的食品添加剂,亚硝酸盐主要为亚硝酸钠。由于亚硝酸钠在肉类中的综合作用,包括肉的发色、抑制脂肪氧化、抗菌抑菌、参与肉的风味形成以及增加肉的弹性和黏度,因此至今还没有找到完全能够替代亚硝酸钠的食品添加剂[1-3]。其中亚硝酸钠的发色作用是使腌制肉类形成热稳定的亚硝化肌红蛋白(myoglobin nitrosation,MbNO),使腌肉呈现粉红色的外观[4-6]。亚硝酸钠的发色过程主要经过3 步:首先,亚硝酸钠将脱氧肌红蛋白氧化成高铁肌红蛋白(metmyoglobin,metMb),同时亚硝酸钠被还原为一氧化氮(NO);接着,metMb中的血红素铁与NO结合,形成metMb-NO;最后,metMb-NO中血红素铁被还原剂还原成亚铁态,形成粉红色的MbNO[7-9]。
近年来,等离子体直接或间接处理肉品均可作为亚硝酸盐来源,使红肉有效发色,呈现令人满意的粉红色,能够应用于香肠、火腿等腌制肉品。等离子体直接处理的发色效果与传统亚硝酸盐无异,并能大大减少亚硝酸盐残留,但是对肉品品质的影响较大[10-14]。因此,为了降低等离子体热效应对食品基质的不良影响,等离子体活性水(plasma active water,PAW)作为一种高效的间接处理方法逐渐在肉品护色领域应用[15]。PAW指的是经等离子体处理后的水或盐溶液,其中含有过氧化氢、臭氧、亚硝酸、硝酸、亚硝酸根、硝酸根、氢氧根、过氧亚硝基和超氧阴离子自由基等活性成分,溶液具有杀菌消毒的功能[16-18]。其中,亚硝酸根和硝酸根的存在,使PAW用于腌制火腿成为可能。结合PAW的抗菌性能,PAW有望成为替代传统亚硝酸盐腌制火腿的新途径。同时,PAW中的其他氧化成分的存在不可忽视,它们的强氧化性可能会对肉的肌红蛋白产生不可逆的影响[19],从而影响肉的颜色。消费调查显示,决定消费者是否购买肉类产品的关键因素是肉的颜色[20]。因此,若考虑将PAW用于腌制火腿,研究PAW对肉中肌红蛋白的颜色影响尤为重要。射频放电(radio frequency,RF)和介质阻隔放电(dielectric barrier discharge,DBD)是等离子体发生的2 种方式,目前作为亚硝酸盐来源的冷PAW基本是DBD-PAW[11,14],RF相比DBD具有样品处理量大,载气可换等优点,并且等离子体发生方式不同、载气不同,制得的活性水成分的种类含量也有不同,因此本研究以RF-PAW作为亚硝酸盐来源探究其发色效果。
猪肉最主要的色素是氧合肌红蛋白(oxygenated myoglobin,oxyMb)和metMb。采用射流等离子体处理磷酸盐缓冲液,制得RF-PAW,探讨RF-PAW处理对metMb和oxyMb颜色的影响,并在火腿发色上应用,对比亚硝酸钠溶液、RF-PAW、亚硝酸钠-抗坏血酸、RFPAW-抗坏血酸的发色效果以及这4 种发色形式用于火腿发色后火腿亚硝酸盐的残留量,为肉品等离子体保鲜技术的工程化应用提供理论基础和科学指导。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊肉 广州清河批发市场;磷酸氢二钠(Na2HPO4·12H2O)、连二亚硫酸钠(Na2O4S2)、磷酸二氢钠(NaH2PO4·2H2O)、乙酸锌(Zn(CH3COO)2·2H2O)(均为分析纯) 上海麦克林生物科技有限公司;过氧化氢检测试剂盒 上海碧云天生物技术有限公司;对氨基苯磺酰胺(C6H7NO3S)、盐酸萘乙二胺(C12H14N2·2HCl)、十水合焦磷酸钠(Na4O7P2·10H2O)、氨基磺酸(NH2SO3H)、冰乙酸(CH3COOH)(均为分析纯) 上海阿拉丁生化科技股份有限公司;马源metMb(98%,分析纯) 上海源叶生物科技有限公司;30% H2O2天津市大茂化学试剂厂;亚硝酸钠(NaNO2,分析纯) 西格玛奥德里奇(上海)贸易有限公司;L-抗坏血酸(C6H8O6,分析纯)山东丰泰生物科技有限公司;丙酮(分析纯)、浓盐酸(HCl,ρ=1.19 g/mL) 广州化学试剂厂;亚铁氰化钾(K4Fe(CN)6·3H2O) 阿法埃莎(中国)化学有限公司;硼酸钠(Na2B4O7·10H2O) 北京化工厂。
1.2 仪器与设备
UPL-310B型RF等离子体设备 深圳优普莱等离子体有限公司;AL204型电子天平 梅特勒-托利多仪器(上海)有限公司;Synergy2型多功能酶标仪 美国伯腾仪器有限公司;DHG-9240A型电热鼓风干燥箱 上海一恒科技有限公司;MJ-LZ25Easy235型绞肉机 美的集团;CR-400型色彩色差计 柯尼卡美能达公司;HH-501型恒温水浴锅 常州澳华仪器有限公司。
1.3 方法
1.3.1 RF-PAW对肌红蛋白颜色的影响
1.3.1.1 RF-PAW的制备
配制0.2 mol/L,pH 6.8的磷酸(phosphate buffer,PB)缓冲液:称取NaH2PO4·2H2O,加入去离子水,配制为0.2 mol/L的甲液;称取Na2HPO4·12H2O,加入去离子水,配制为0.2 mol/L的乙液。将甲液和乙液按照51∶49体积比混合,并用浓盐酸将pH值调为6.8。配制的PB缓冲液置于4 ℃冰箱保存待用。
RF-PAW的制备:调节RF等离子体设备的参数,输入电压220 V,功率600 W。用移液枪准确移取25 mL上述PB缓冲液,置于玻璃培养皿中。将装有PB缓冲液的培养皿置于RF等离子体设备的喷口下。开启电源,以空气为气源,激发等离子体,喷口的等离子体火焰恰好与PB缓冲液接触。均匀转动培养皿,使等离子体均匀作用于PB缓冲液。在此条件下,分别处理PB缓冲液0、0.5、1、2、4 min和6 min。处理得到的RF-PAW分别命名为空白对照、RF-PAW-0.5、RF-PAW-1、RF-PAW-2、RF-PAW-4和RF-PAW-6,置于4 ℃冰箱中冷藏待用。
1.3.1.2 RF-PAW的活性物质测定
H2O2浓度的测定:参照Shen Jin等[21]的方法,稍作修改,使用过氧化氢检测试剂盒测定。利用H2O2将Fe2+氧化产生Fe3+,Fe3+则与二甲酚橙相互作用形成紫色的产物,根据紫色产物在波长560 nm测定吸光度的结果,计算H2O2的浓度。H2O2检测试剂需提前从-20 ℃冰箱中取出,冰上融解。准备96 孔酶标板,检测孔内先加入50 μL待测样品,再加入100 μL H2O2检测试剂,小心振荡混匀,室温下放置30 min。然后立即用酶标仪测定A560nm。最后根据标准曲线计算出样品中H2O2的浓度。每个样品至少检测2 次,取平均值为样品的H2O2浓度值。实验重复3 次。
亚硝酸盐质量浓度的测定:取适量PAW或亚硝酸盐标准使用液,用去离子水稀释至5 mL,加入200 μL 10 g/L对氨基苯磺酰胺溶液,孵育2 min,再加入200 μL 1 g/L盐酸萘乙二胺,静置20 min,待测样品用去离子水代替的为空白对照,用紫外分光光度计测A540nm。绘制标准曲线,计算吸光度对应质量浓度。结果以亚硝酸根计。
硝酸盐浓度的测定:取适量PAW或硝酸盐标准使用液,用去离子水稀释至5 mL,加入200 μL 1 mol/L盐酸,再加入50 μL 0.8%氨基磺酸溶液,待测样品用去离子水代替的为空白对照,用紫外分光光度计测A220nm。绘制标准曲线,计算吸光度对应浓度。
1.3.1.3 oxyMb储备液的制备
将metMb溶于0.2 mol/L PB缓冲液中,制成质量浓度为4 mg/mL的metMb储备液。按照100∶1(V/V)混合metMb储备液和1 mol/L连二亚硫酸钠溶液,孵育反应使肌红蛋白被还原充分,制成4 mg/mL的oxyMb储备液。
1.3.1.4 RF-PAW处理metMb和oxyMb
在metMb和oxyMb储备液中加入RF-PAW,使metMb和oxyMb的质量浓度为1.33 mg/mL,孵育20~30 min,使反应充分,得到metMb和oxyMb处理液。处理液置于4 ℃冰箱中,待观察和分析用。
1.3.1.5 肌红蛋白紫外光谱分析
向狭缝比色皿中添加650 μL metMb或oxyMb检测液,记录波长250~750 nm的光谱数据,扫描间距为1.0 nm。肌红蛋白的卟啉环在紫外-可见区域具有特征吸收峰。其中,波长400 nm附近出现的强吸收峰,称为soret带;波长500~750 nm范围内出现的若干个弱吸收峰,称为Q带。
1.3.2 PAW在火腿发色中的应用
1.3.2.1 RF-PAW、亚硝酸盐溶液(nitrite,NI)的配制
RF-PAW的配制:配制0.06 mol/L焦磷酸钠溶液(inorganic pyrophosphate,PPI),取25 mL置于直径为60 mm的培养皿中。把装有PPI的培养皿放在RF设备的枪口下,激发出的等离子体火焰刚好接触液体表面,处理6 min,得到RF-PAW原液。测得RF-PAW原液中的亚硝酸钠含量,用去离子水调节亚硝酸盐质量浓度为(120±2)mg/L,得到RF-PAW腌制液。
NI的配制:将亚硝酸钠加入0.06 mol/L PPI中,配制120 mg/L的亚硝酸钠溶液。
1.3.2.2 PAW、NI腌制火腿的制作
取新鲜猪里脊肉,去除肉眼可见的脂肪和结缔组织,洗净后吸干表面水分,放入绞肉机中搅碎为猪肉糜。按表1配方腌制火腿。每组取适量猪肉糜,A、B组中加入RF-PAW,C、D组中加入NI,其中A、C组中不加入L-抗坏血酸,B、D组中加入L-抗坏血酸。猪肉糜中仅加入焦磷酸钠溶液的为空白组。混合均匀后,将肉糜平均放入培养皿中,封上保鲜膜,放在4 ℃冰箱中,发色48 h。发色完成后,将猪肉放入水浴锅中进行蒸煮,设置温度80 ℃,蒸煮30 min。每组样品设置3 个平行样品,实验重复3 次。

表1 腌制火腿配方Table 1 Formulations of ham curing agents
1.3.2.3 腌制火腿的发色过程和蒸煮后的颜色测定
用色彩色差仪对猪肉样品进行颜色测定。分别在发色后0、6、24 h和48 h测量猪肉样品的颜色。每次测量之前,色彩色差仪先用标准陶瓷白板进行校正。测定颜色时,随机选定样品对角线上5 个点进行测定,得到数值的平均值作为样品的最终颜色,颜色参数用CIE LAB亮度(L*)、红度(a*)、黄度(b*)和色度(C*)表示。
用色彩色差仪对蒸煮火腿样品进行颜色测定。每次测量之前,色彩色差仪先用标准陶瓷白板进行校正。测定颜色时,随机选定样品对角线上5 个点进行测定,得到数值的平均值作为样品的最终颜色,颜色参数用CIE LAB亮度(L*)、红度(a*)、黄度(b*)和色度(C*)表示。
1.3.2.4 蒸煮火腿的MbNO色素含量以及总色素含量测定
参照Song Xiao等[22]的方法,并稍有修改。
每个样品随机切取5 g火腿,剪碎,放入50 mL离心管中,加入20 mL丙酮和5 mL去离子水,混匀后静置,上层清液用0.45 μm水洗滤膜过滤后,用分光光度计测定其在波长540 nm处的吸光度,计算火腿中的MbNO色素质量浓度,采用80%丙酮溶液作为空白对照。
每个样品上另取5 g火腿,剪碎,放入50 mL离心管中,加入20 mL丙酮和5 mL浓盐酸,混匀后静置1 h,上层清液用0.45 μm水洗滤膜过滤后,用分光光度计测定其在波长640 nm处的吸光度,计算火腿中的总色素质量浓度,采用80%丙酮-盐酸溶液作为空白对照。整个实验过程需要避光操作。
样品测得的MbNO色素质量浓度的平均值作为MbNO色素质量浓度,测得总色素质量浓度的平均值作为火腿的色素质量浓度,参与计算该实验组样品的MbNO色素百分比。
1.3.2.5 蒸煮火腿的亚硝酸盐残留
参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》中的分光光度法(盐酸萘乙二胺法)测定。
1.4 数据统计与分析
使用SPSS 17.0软件和Origin 8.0软件进行数据处理、分析和作图,每次实验重复3 次。
2 结果与分析
2.1 RF-PAW对肌红蛋白颜色的影响
2.1.1 RF-PAW活性成分
如图1a所示,RF等离子体处理得到的PAW,其H2O2的浓度随处理时间的延长增长趋向平缓。如图1b所示,RF-PAW的亚硝酸盐含量在处理的6 min内大幅度增长,增长速度不断加快,从处理0.5 min条件下的37.78 mg/L增长至处理6 min条件下的584.86 mg/L,增长为15 倍。在RF-PAW中并未检出硝酸钠。
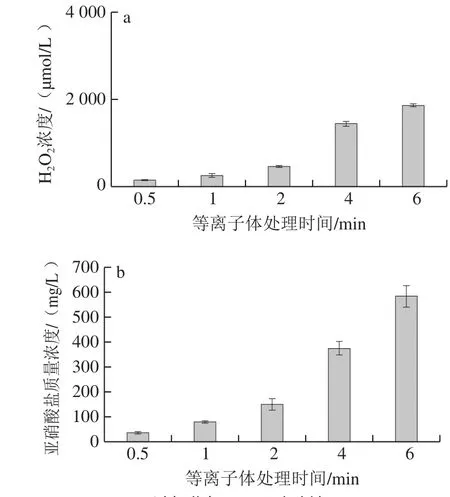
图1 RF-PAW主要活性成分Fig.1 Active ingredients of RF-PAW
将PAW用于腌制红肉的发色,其中关键的发色成分是亚硝酸钠和硝酸钠。为了累积足够的亚硝酸盐和硝酸盐,应该延长等离子体的处理时间。但为了尽量避免过强的氧化性对肌红蛋白的影响[19,23],必须使H2O2等强氧化性成分含量控制在合适的范围内,而当H2O2浓度低于1 300 μmol/L时,肌红蛋白的血红素结构不会被破坏。目前的实验结果显示,RF-PAW有较高的亚硝酸盐累积量和较低的H2O2累积量,适用于腌制红肉。
2.1.2 metMb和oxyMb的外观颜色
如图2、3所示,经RF-PAW-0.5、RF-PAW-1、RFPAW-2、RF-PAW-4和RF-PAW-6处理,metMb溶液颜色对比空白对照均无显著变化(图2a)。即本研究中的RF等离子体设备处理6 min以内得到的PAW,不会对metMb的颜色产生显著影响。经过不同RF-PAW的处理,metMb在soret带和Q带的特征峰并未出现位移,峰的强度轻微减弱,说明此时metMb的血红素结构并未发生改变,与颜色变化规律一致(图3a、b)。

图2 RF等离子体处理时间下得到的RF-PAW对metMb(a)和oxyMb(b)颜色表达的影响Fig.2 Effect of RF-PAW obtained at different processing times on color expression of metMb (a) and oxyMb (b)
如图2b所示,经RF-PAW-0.5、RF-PAW-1和RFPAW-2处理,oxyMb溶液颜色呈现鲜红色,对比空白对照没有显著变化;经RF-PAW-4和RF-PAW-6处理的oxyMb,变为红棕色。如图3c、d所示,soret带的特征峰由波长415 nm逐渐红移至409 nm;Q带代表oxyMb的特征峰(548 nm和579 nm)逐渐减弱,而代表metMb的特征峰逐渐增强(503 nm和630 nm),说明RF-PAW-0.5、RF-PAW-1、RF-PAW-2、RF-PAW-4和RF-PAW-6使oxyMb逐渐氧化为metMb,与颜色变化规律一致。
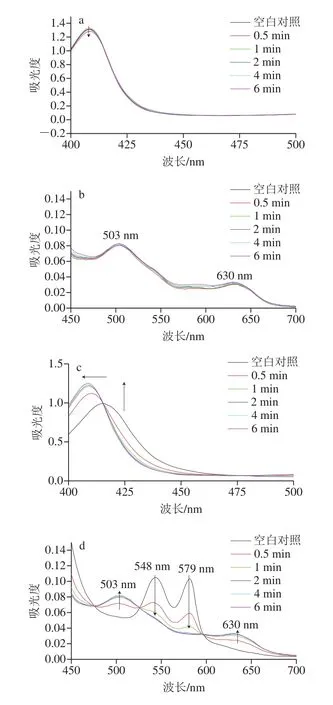
图3 RF-PAW与oxyMb和oxyMb相互作用下的紫外光谱Fig.3 UV absorption spectra of oxyMb or oxyMb interacting with RF-PAW
2.2 PAW对火腿发色的影响
2.2.1 腌制火腿发色过程颜色的变化
如表2所示,从48 h以内的发色效果来看,如果不加L-抗坏血酸,用PAW腌制的猪肉a*值虽然先下降,但在发色48 h后a*值恢复且比发色0 h高;而NI腌制的猪肉a*值有明显下降。这说明了PAW直接处理的猪肉反而能比NI腌制的猪肉保持更高的a*值,可能是因为PAW中除了亚硝酸根,还有其他含氮物质被还原成NO[24],与肌红蛋白结合。

表2 处理方式对腌制火腿的发色过程颜色的影响Table 2 Effects of different treatments on the color of ham during color development
在腌肉体系中加入L-抗坏血酸,用2 种亚硝酸盐来源腌制猪肉,都使猪肉a*值升高,且发色过程中的a*值均比不加L-抗坏血酸高(P<0.05),说明L-抗坏血酸能够更好地辅助MbNO形成[25-26]。而PAW+L-抗坏血酸与NI+L-抗坏血酸腌制的猪肉发色效果相近(P>0.05),说明PAW中的H2O2不会对猪肉的发色效果造成负面影响。
在发色0~24 h之内,无论是否加入L-抗坏血酸,不同亚硝酸盐来源腌制猪肉的b*值均没有表现出显著性差异。在发色48 h时,L-抗坏血酸的加入,使腌制的猪肉b*值显著下降(P<0.05)。研究表明,L-抗坏血酸能够在辅助生成红色MbNO的同时,抑制绿色亚硝肌红蛋白的形成[27]。另外,发色48 h,PAW腌制猪肉的b*值比NI组低(P<0.05);PAW+L-抗坏血酸腌制猪肉的b*值比NI+L-抗坏血酸组低(P<0.05)。研究表明,当更多MbNO形成时,猪肉发色后的b*值更低,这说明当亚硝酸盐含量一致的情况下,PAW能使猪肉生成更多的MbNO色素,发色效果更好[12,28]。猪肉发色48 h的颜色见图4。肉眼观察结合表2色差分析a*值结果,添加L-抗坏血酸的组发色效果均好于不添加组,但对照组的颜色却优于实验组,这与赵敏[29]的研究结果不同,该研究发现经过亚硝酸盐等发色剂腌制过的肉糜a*值高于未加发色剂的对照组。研究结果存在差异可能是由于本研究使用的腌制液是一定浓度的碱性焦磷酸盐,亚硝酸盐在较强碱性条件下难以生成NO,因此不能使肉品顺利发色,并且亚硝酸盐自身具有氧化性,能使血红蛋白部分氧化成高铁血红蛋白,因此PAW组和NI组的肉糜呈现一种浅棕色,且a*值比PPI组低,而加入L-抗坏血酸之后PAW及NI组a*值有所升高,这是因为还原剂能够在一定程度上阻止血红蛋白发生过度氧化生成高铁血红蛋白。有研究表明碱性条件下,肉中的血红蛋白能够避免被过度氧化为高铁血红蛋白,呈现良好的色泽,而实验组的肉糜处于碱性条件下,且未添加亚硝酸盐,因此在腌制过程中,肌红蛋白与氧气结合呈现浅红色。在发色48 h内,实验组的样品,L*值无有显著性差异(P>0.05)。在发色24 h后,加入L-抗坏血酸组的C*值比不加组高(P<0.05),此研究结果与Song Xiao等[22]的一致,肉的a*值和C*值越高,则生成MbNO的含量越高。

图4 处理方式对猪肉发色48 h颜色的影响Fig.4 Effects of different treatments on the color of pork at 48 h of color development
2.2.2 腌制火腿蒸煮后的颜色
从表3可以看出,无论是否加入L-抗坏血酸,蒸煮火腿都能形成粉红色外观。当不加L-抗坏血酸,2 种亚硝酸盐来源腌制的蒸煮火腿也能形成粉红色外观,说明新鲜猪里脊中的还原系统没有被氧化破坏,仍能形成MbNO色素;但L-抗坏血酸的加入能辅助猪肉本身的还原系统,形成更多的MbNO色素,火腿a*值更高。

表3 处理方式对腌制火腿蒸煮后颜色测定值的影响Table 3 Color parameter values of cooked hams
无论猪肉中是否加入L-抗坏血酸,以PAW为亚硝酸盐来源火腿的a*值均比NI组高(P<0.05);PAW组的b*值也比NI组低(P<0.05),说明PAW腌制猪肉形成更多的MbNO色素。腌制火腿蒸煮后的外观颜色见图5。观察可见,不加L-抗坏血酸的PAW与NI+L-抗坏血酸组的发色效果相近,PAW+L-抗坏血酸组腌制的火腿形成的粉红色最明显。说明了PAW确实能在亚硝酸根含量相同的情况下,比NI的发色效果更好。
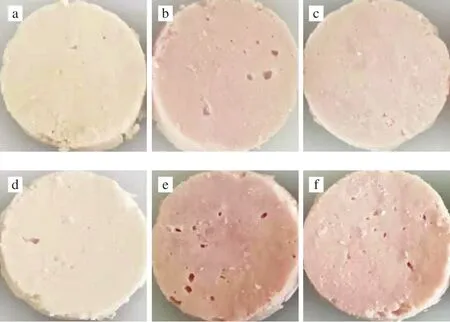
图5 处理方式对腌制火腿蒸煮后颜色的影响Fig.5 Effects of different treatments on the color of cooked hams
2.2.3 蒸煮火腿的MbNO色素含量以及总色素含量
如表4所示,从MbNO色素百分看,与蒸煮火腿测得的L*、a*、b*值和C*值的结果一致,发现PAW腌制出的火腿之所以有更高的a*、C*值以及更低的b*值,是因为生成了更多的MbNO色素。从以往研究来看,PAW作为亚硝酸盐的来源腌制火腿,也得到了PAW比传统亚硝酸盐腌制发色效果更好的结果,但具体原因未知[11]。本研究使用PAW中,并未测得硝酸根,但PAW中除了硝酸根和亚硝酸根,还有存在过氧亚硝基、硝酸、亚硝酸等含氮化合物,可能参与MbNO的形成。
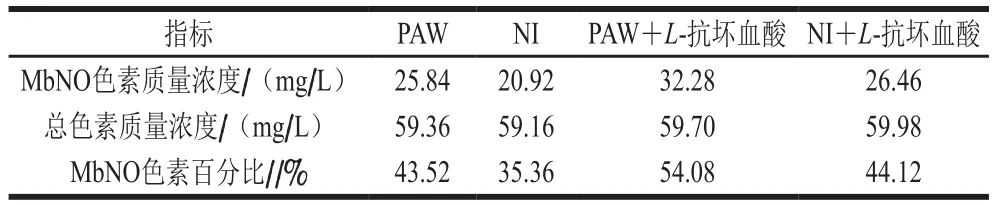
表4 处理方式对腌制蒸煮火腿色素含量的影响Table 4 Effects of different treatments on pigment contents of cooked ham
2.2.4 蒸煮火腿的亚硝酸盐残留
如图6所示,PAW、NI组腌制火腿的亚硝酸盐残留量少于国家标准规定的70 mg/kg(以亚硝酸钠计)。而猪肉中加入L-抗坏血酸,制成火腿的亚硝酸盐残留大幅降低,说明L-抗坏血酸能辅助减少火腿中亚硝酸盐的残留,这可能是L-抗坏血酸能够促进亚硝酸盐更多地转化为NO,从而形成更多的MbNO色素造成的[26,30]。
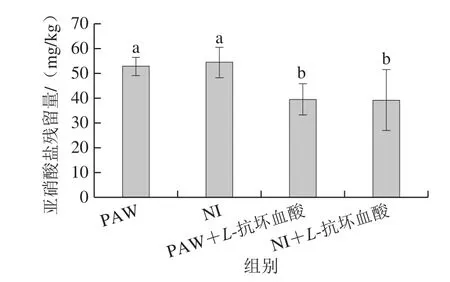
图6 不同亚硝酸盐来源腌制蒸煮火腿的亚硝酸盐残留Fig.6 Residual nitrite levels in cooked hams cured separately with nitrite and PAW
从不同的亚硝酸盐来源看,无论是否在腌肉过程中加入L-抗坏血酸,PAW与NI腌制火腿的亚硝酸盐残留均无显著性差异。已知各实验组加入的亚硝酸盐含量一致,且PAW的发色效果更佳,但各组的亚硝酸盐残留没有表现出显著性差异,推测PAW中除了亚硝酸盐外,还有其他含氮化合物参与了MbNO的形成,使PAW比相同亚硝酸盐含量处理组腌制发色效果更佳而亚硝酸盐残留相差不大,但未知是哪一种含氮化合物也参与了反应。这一研究结果与Jung等[11]的不同,该研究发现,PAW腌制的火腿比传统亚硝酸盐腌制的火腿,MbNO含量更高,且亚硝酸盐含量更低。这说明了,不同PAW处理相同肉制品得到的发色效果和肉品质量存在差异,造成差异的具体原因,需要进一步探讨。
3 结 论
RF-PAW中的活性物质不会直接对肌红蛋白的颜色造成不良影响。采用RF-PAW、NI为亚硝酸盐来源腌制火腿,均能使新鲜猪肉发色,PAW中的活性物质并未对火腿发色造成影响。如果在猪肉体系中加入L-抗坏血酸,发色效果更佳,且火腿的亚硝酸盐残留更低。无论是否加入L-抗坏血酸,PAW比NI的发色效果更好,PAW腌制得到的蒸煮火腿呈现更红的颜色。对比分析RF-PAW、NI腌制的蒸煮火腿,通过测定其MbNO含量和亚硝酸盐残留,发现PAW腌制比NI腌制形成更多的MbNO色素,使火腿的红色更深,但2 种火腿样品的亚硝酸盐残留无显著性差异,因此推论,PAW中除了亚硝酸盐,可能还有其他含氮化合物参与发色过程。PAW是含有多种活性成分的复杂体系,需要对经过等离子体处理后的肉品进行成分分析,检测一些强氧化性物质如过氧化氢残留量是否超标,并开展毒理学实验,进一步论证PAW加工肉制品的安全性。
