米糠蛋白O/W及W/O/W乳液制备及界面稳定性
2021-12-03王可心段庆松王依凡段玉敏霍金杰江睿生高育哲肖志刚
王可心,段庆松,王依凡,段玉敏,霍金杰,江睿生,何 东,高育哲,*,肖志刚,,*
(1.沈阳师范大学粮食学院,辽宁 沈阳 110034;2.沈阳农业大学食品学院,辽宁 沈阳 110866;3.沈阳师范大学实验中心,辽宁 沈阳 110034)
米糠是稻米加工的副产物,含有15%~22%脂肪,7%~11.4%纤维,34.1%~52.3%碳水化合物及10%~16%蛋白[1],是粮油副产物中蛋白质含量较高且产量较大的一种可再生资源[2]。其蛋白质主要由清蛋白、球蛋白、谷蛋白和醇溶蛋白4 种组分构成[3],氨基酸组成与比例和联合国粮食与农业组织/世界卫生组织推荐模式接近。米糠蛋白消化率高达92%,生物效价大约为2.0~2.5,优于大豆蛋白、玉米蛋白和小麦蛋白。米糠蛋白还具有低致敏性的特点,可以添加到婴幼儿食品中[4]。
蛋白质乳液的成因是具有两亲性质的蛋白质在油-水界面吸附,其二级和三级结构重排,相邻蛋白质分子通过疏水性或二硫键相互吸附,在水-油界面进一步聚合形成黏弹性保护层,从而形成乳液液滴并在液滴之间防止乳液发生聚结和絮凝[5]。蛋白质乳液也有多种形态,通常分为单层乳液和多重乳液。单层乳液通常有W/O和O/W 2 种形态;多重乳液,通常指双重乳液,是指乳液内分散着更小的乳液系统,可以看成乳液中的乳液,常见类型为W/O/W型和O/W/O型[6]。因结构特殊,双重乳液可以更好地包埋活性物质免受胃肠环境的破坏[7]以及控制包埋物质的缓释速度[8],成为近年来研究热点。
米糠蛋白刚性强、亲水基团和疏水基团被隐藏在高度卷曲的结构中,致使其乳液界面稳定性较差。双重乳液在基料种类和制备方法上选择较多,目前双乳化研究的热点大多数为复合颗粒、改性淀粉或乳清蛋白,对于天然植物蛋白的研究鲜有报道,且其与单层乳液稳定性的区别与机理还有待研究。因此,本研究制备W/O/W双乳液,考察不同米糠蛋白质量浓度下,乳液的微观结构及其对乳液稳定性的影响规律,对比O/W乳液及W/O/W乳液的形成及稳定规律。进一步研究双乳化法对天然米糠蛋白乳液的稳定机制。
1 材料与方法
1.1 材料与试剂
脱脂米糠 沈阳奥达油脂有限公司;大豆油 嘉里粮油(中国)有限公司;聚甘油蓖麻油酸醇酯PGPR 90山东优索华工科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
LD4-2型低速离心机 贝克曼库尔特商贸(中国)有限公司;ULTRA TURRAX®T25高速分散机 德国IKA公司;BX50光学显微镜 日本奥林巴斯公司;TSC SP8激光共聚焦显微镜 德国徕卡公司;Zeta sizer Nano-ZS90激光粒度分析仪、Master sizer 3000激光粒度仪英国马尔文公司;RVDV-3 Ultra流变仪 美国博勒飞公司;UV-1200S型紫外-可见分光光度计 翱艺仪器(上海)有限公司。
1.3 方法
1.3.1 米糠蛋白的提取
参照周耸励[9]的方法并稍作修改。脱脂米糠中加入10 倍体积的蒸馏水,调pH值至9.5,于室温搅拌0.5 h,5 000 r/min离心15 min,收集上清液;沉淀重复操作,并合并上清液,调至等电点pH 4.5,4 ℃静置0.5 h,5 000 r/min离心15 min,沉淀调节为中性,凯氏定氮确定蛋白含量。
1.3.2 米糠蛋白乳液的制备
取一定量的大豆油,加入5 g/100 mL的PGPR 90作为稳定剂,于室温600 r/min搅拌1 h作为油相备用。
1.3.2.1 米糠蛋白O/W乳液的制备
以乳液目标总体积为基准,配制质量浓度为0.3、0.4、0.5、1.0、1.5、2.0 g/100 mL以及2.5 g/100 mL的米糠蛋白溶液并与油相按6∶4(V/V)的比例混合,于高速均质机9 500 r/min室温均质1 min。
1.3.2.2 米糠蛋白W/O/W乳液的制备
参照Ali[10]及Natalie[11]等的方法并修改。以乳液目标总体积为基准,配制质量浓度为0.3、0.4、0.5、1.0、1.5、2.0 g/100 mL以及2.5 g/100 mL的米糠蛋白溶液并与油相按1∶4(V/V)的比例混合,高速均质机转速13 500 r/min处理40 s;再将处理后的乳液按1∶1(V/V)的比例加入去离子水,高速均质机转速9 500 r/min处理1 min。
1.3.3 乳液微观结构测定
1.3.3.1 光学显微镜观测成像
取不同乳液样品适当稀释后滴加到带凹槽载玻片中央,加盖盖玻片,置于光学显微镜载物台上,用40 倍光学显微镜进行观察。利用仪器自带软件获得乳液显微结构图像。
1.3.3.2 光共聚焦显微镜成像
参照王丽娟[12]的方法对乳液进行染色处理,并稍作调整。采用0.1%尼罗红和0.1%尼罗蓝分别对油相与蛋白相进行染色。在激发波长488 nm时,将绿色作为油相荧光信号;激发波长633 nm时,采用红色作为蛋白质荧光信号。扫描频率为100 Hz,扫描密度为1 024×1 024。使用LAS AF Lite软件进行图像处理。
1.3.4 表观稳定性的测定
取等量乳液于10 mL离心管中倒置于黑色背景前,分别于0、24 h和48 h对乳液的表观状态进行图像采集。
1.3.5 乳化活性及乳液稳定性的测定
参考鞠梦楠等[13]的方法并稍作修改。取10 mL新制乳液置于20 mL小瓶中,瞬时用移液枪在瓶底取20 μL加入至5 mL 0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液中。以0.1%的SDS溶液作为空白对照,于波长500 nm下读取瞬时吸光度A0。于10 min后用移液枪在瓶底取20 μL加入至5 mL的0.1% SDS溶液中,读取吸光度A10。乳化活性及乳化稳定性按式(1)、(2)计算:
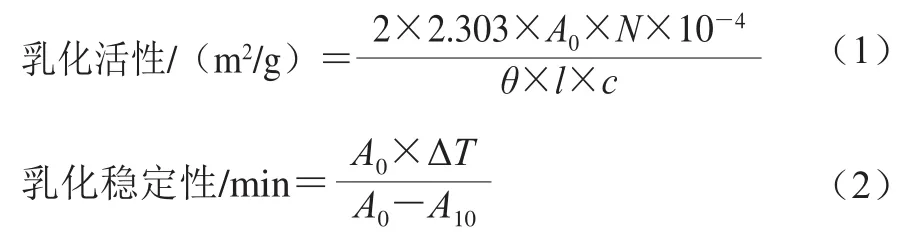
式中:A0为0 min吸光度;A10为10 min吸光度;N为稀释倍数;θ为油脂占总数的比例;l为光路长度/cm;c为蛋白质量浓度/(g/mL);ΔT为间隔时间/min。
1.3.6 黏度的测定
取适量乳液加入至流变仪测量筒中,选用SC4-18型转子,于转速50 r/min下测定乳液的黏度,测试结果由Rheocalc软件采集。
1.3.7 蛋白质界面吸附率的测定
参照Qin Xinsheng等[14]的测定方法并稍作修改。取20 mL乳液4 000 r/min离心10 min,轻轻吸取下清液并通过凯氏定氮法测定其蛋白含量,按式(3)计算乳液的界面吸附率:
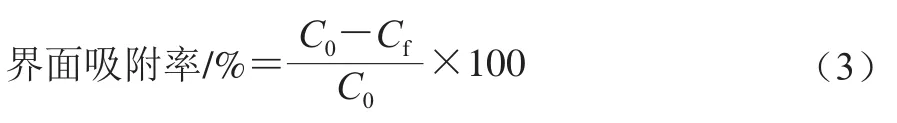
式中:C0为乳液总蛋白质量浓度/(g/mL);Cf为下清液蛋白质量浓度/(g/mL)。
1.3.8 粒径的测定
采用激光粒度仪进行测定。分散介质为水,微粒的折射率设置为1.59,采用体积平均直径d(4,3)表征乳液液滴粒度的大小。
1.3.9 Zeta电位的测定
将乳液用去离子水稀释250 倍之后由粒度电位仪测定。移取0.10 mg/mL样品于密封容器中,上样体积1 mL,测定过程中设折光系数为1.450,25 ℃保温平衡2 min。实验结果取3 次平行。
1.4 数据处理
所有实验重复测定3 次。采用SPSS 20.0软件进行单因素方差分析,平均数间比较釆用Duncan模型检验法,P<0.05,差异显著。釆用Origin 9.1软件进行作图。
2 结果与分析
2.1 乳液微观结构表征
2.1.1 乳液光学显微镜镜观察
如图1所示,2 种乳液液滴均呈圆球形,且大小较为均匀。O/W乳液中,蛋白质和PGPR 90在水油界面形成了一层致密的保护膜,乳液内部油相分布均匀,且当米糠蛋白质量浓度大于1.0 g/100 mL时,乳液的粒径相对较大。在放大同样倍数的情况下,W/O/W乳液的镜下微观状态形成了图像所表征的“乳液当中含有小液滴”的W/O/W形态,乳液内部各个液滴大小不一,W/O/W液滴直径明显大于O/W乳液,这是因为双层乳液经过两步搅打体系中层级复杂造成的,此结果也与乳液粒径的测试结果趋势一致。当米糠蛋白质量浓度在0.5 g/100 mL以下时,乳液内部的初乳W/O液滴大小不一,可能是由于内水相蛋白质量浓度较低导致内部发生了架桥絮凝现象[15];蛋白质量浓度为0.5 g/100 mL时,W/O/W乳液内部液滴较多且相对均匀;蛋白质量浓度在1.0~1.5 g/100 mL之间时,乳液内部的初乳W/O液滴较少且其粒径较小,PGPR 90在最外层的水油界面上形成了致密保护层,乳液与外界分隔明显;当蛋白质量浓度大于2.0 g/100 mL时,乳液内部W/O液滴不断絮凝,部分大粒径的液滴逐渐向外部移动,且有破乳的趋势,这可能是因为蛋白质过量引发了界面竞争从而造成界面紊乱[16]。
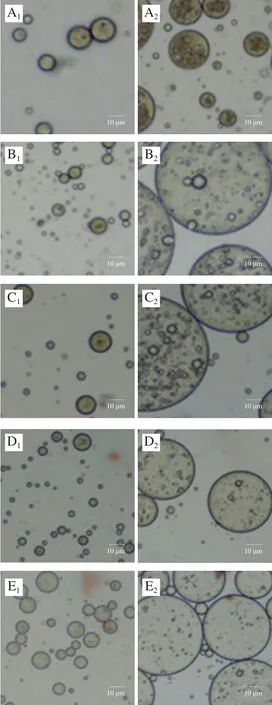
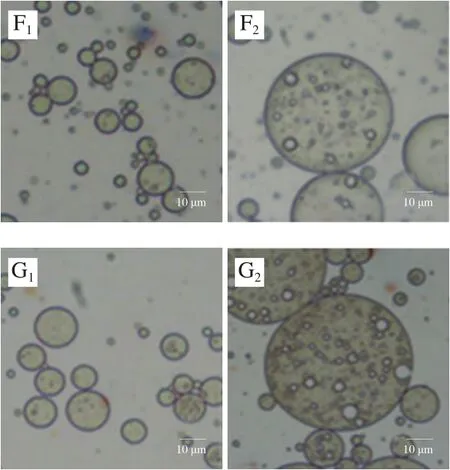
图1 米糠蛋白O/W及W/O/W乳液的光学显微镜图Fig.1 Optical microscopic images of rice bran protein-stabilized O/W and W/O/W emulsions
2.1.2 激光共聚焦显微镜图像
如图2所示,米糠蛋白质量浓度为0.4 g/100 mL时,2 种形态的乳液均在不同荧光下发出明显荧光信号。O/W乳液中,油滴呈绿色圆球状,蛋白质呈红色颗粒分布在连续相中。这说明当O/W乳液蛋白质量浓度为0.4 g/100 mL时存在着一定的颗粒游离现象。在W/O/W乳液中,呈绿色的油相和呈红色的蛋白质均匀且交替分布在乳液内部,蛋白质大部分在液滴内部的水-油界面起到稳定作用,形成空间位阻,防止了W/O液滴之间的聚集作用[17]。与蛋白质大量游离在体系中的O/W乳液相比,W/O/W乳液体系中游离蛋白质颗粒明显较少,蛋白质利用率高,这也证实了将蛋白质置于内水相的双乳化法制备的W/O/W乳液可以更好地发挥米糠蛋白的界面性质,在内相W/O液滴中起到稳定的作用。
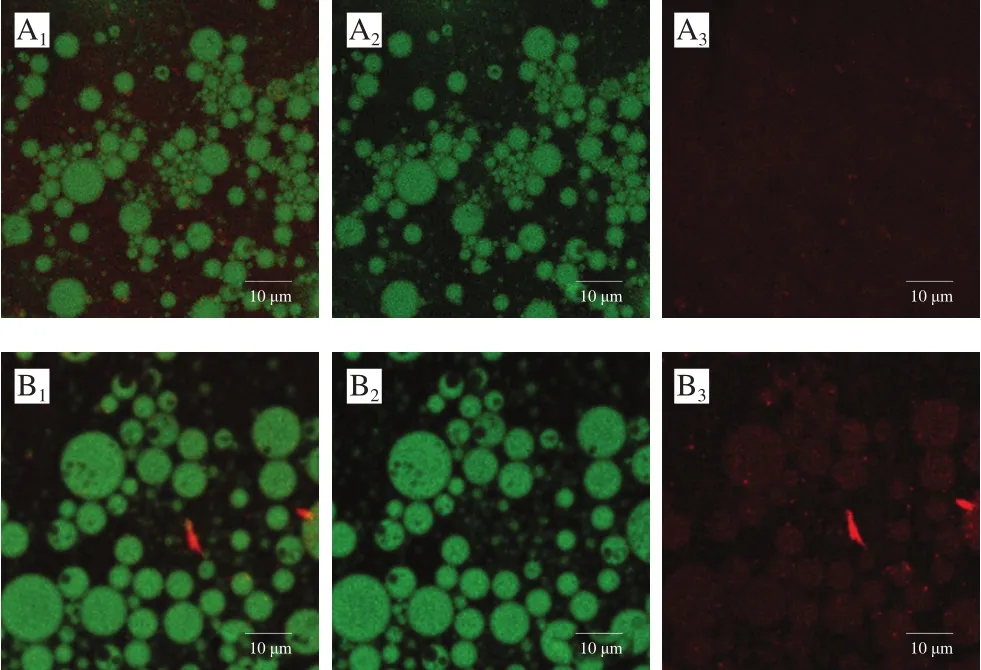
图2 米糠蛋白O/W(A)及W/O/W(B)乳液的激光共聚焦显微镜图Fig.2 CLSM images of rice bran protein-stabilized O/W (A) and W/O/W (B) emulsions
2.2 米糠蛋白质量浓度对O/W及W/O/W乳液表观稳定性的影响
将不同质量浓度的米糠蛋白制备的O/W乳液和W/O/W乳液分别于制备结束当时(0 h)、放置24 h和放置48 h的图像记录。由图3可知,在0 h,各实验组均呈乳白色,无析出现象,液体有类似牛奶的流动特性。随着时间的延长,2 种乳液均有不同程度的分层现象。24 h后,O/W乳液出现明显分层现象,且质量浓度越高,析出的液体颜色越深。部分W/O/W乳液也开始出现析出现象,但总体明显比O/W乳液稳定,且质量浓度越高,与O/W乳液的差异越明显;W/O/W乳液析出的水相颜色较浅,含有蛋白颗粒较少,这也进一步证实同样条件下W/O/W乳液的稳定性明显优于O/W乳液。48 h后,W/O/W乳液均出现乳析现象,但其乳析指数的大小与米糠蛋白质量浓度并不具有相关性,这可能是蛋白质在界面上发生重组和排列,或者是发生了界面竞争的现象导致。

图3 米糠蛋白O/W及W/O/W乳液的稳定性Fig.3 Stability of rice bran protein-stabilized O/W and W/O/W emulsions
2.3 质量浓度对米糠蛋白乳化活性及乳液稳定性的影响
由图4A可知,相同质量浓度下,双乳化法制备的W/O/W型米糠蛋白乳化体系中,蛋白质的乳化活性均高于O/W乳液。这表明,双乳化法可以有效激发米糠蛋白颗粒在界面上吸附水相和油相进而形成乳液的能力。同时,随着米糠蛋白质量浓度逐渐升高,乳化活性均呈逐渐下降趋势,推测是因为界面上的米糠蛋白过量,体系混乱导致的界面张力升高,进而影响了乳液的稳定性[18-19]。
由图4B可知,随着蛋白质量浓度的增加,O/W乳液体系中,米糠蛋白的乳化稳定性逐渐下降,这可能是大豆油中添加的亲脂性乳化剂PGPR 90与米糠蛋白在O/W界面上发生了竞争,乳化剂超量导致多余的蛋白质颗粒游离在连续相中,加剧了蛋白的团聚程度,蛋白质之间的吸附力超过了界面吸附力,导致液滴破乳[20]。W/O/W乳液中,蛋白质的乳化稳定性先上升后下降,在米糠蛋白质量浓度为0.4 g/100 mL时达到最高。可能是米糠蛋白质量浓度为0.3 g/100 mL时,用于稳定界面的颗粒数量不足,导致了蛋白质的共用现象,液滴之间聚合[21],而质量浓度大于0.5 g/100 mL时,界面上的颗粒较多,W/O/W乳液体系相对混乱导致了米糠蛋白的乳化稳定性下降。但当米糠蛋白质量浓度为0.5 g/100 mL及以上时,W/O/W乳液与O/W乳液中米糠蛋白的乳化稳定性几乎无明显差异,这与图3表观图像观察到的乳液的稳定程度不同。推测这可能是贮存过程中蛋白质在界面上发生吸附和重排导致。
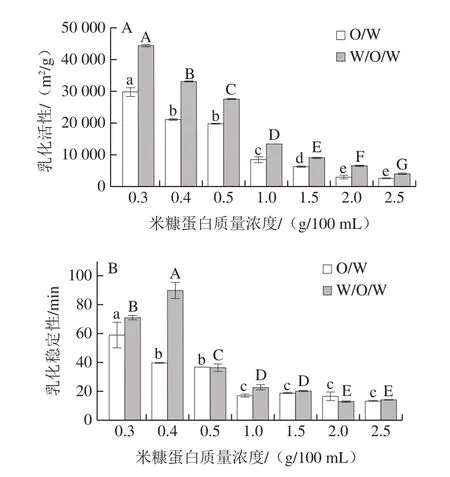
图4 不同质量浓度米糠蛋白的乳化活性(A)和乳化稳定性(B)Fig.4 EAI (A) and ESI (B) of emulsions stabilized with different concentrations of rice bran protein
2.4 米糠蛋白质量浓度对O/W及W/O/W乳液黏度的影响
由图5可知,O/W乳液的黏度基本维持在10 mPa•s以下,其黏度较低、质地偏稀,乳液的流动性大,易产生油滴沉降现象,从而导致乳液失稳;W/O/W乳液的黏度呈先上升再下降的趋势。在米糠蛋白质量浓度为1.5 g/100 mL之前,随着米糠蛋白溶液的增多,W/O/W乳液的黏度逐渐升高,这可能是蛋白质颗粒逐渐增多,在界面发挥的稳定作用越强,减缓了乳液的絮凝现象[22]。在米糠蛋白质量浓度为2.0 g/100 mL时,乳液的黏度最高,可能是多余的蛋白质颗粒游离在连续相中,增大了连续相的黏稠性[23];当质量浓度为2.5 g/100 mL时,乳液的黏度开始变小,这可能是因为界面中蛋白质含量过于饱和,多余的颗粒游离在连续相中与界面上的颗粒发生竞争,导致体系混乱破乳,液滴各相之间开始趋于分离,黏度开始降低[24]。
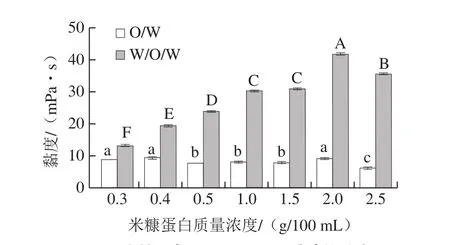
图5 米糠蛋白O/W及W/O/W乳液的黏度Fig.5 Viscosity of rice bran protein-stabilized O/W and W/O/W emulsions
2.5 米糠蛋白质量浓度对O/W及W/O/W乳液界面吸附率的影响
蛋白质作为两亲性的稳定剂,其在水-油界面的吸附率也对乳液的稳定性起到关键作用。吸附在界面上的蛋白颗粒可以有效地在界面上形成一层致密的分隔层,在油水两相之间形成空间位阻,阻止了液滴的破乳和絮凝现象,但过多的颗粒可能会引起蛋白质在界面上因张力过大引发的竞争或交联现象,加大了破乳的可能。由图6可知,双乳化法制备的W/O/W乳液的颗粒吸附率均高于O/W乳液,这是因为将蛋白质置于W/O/W乳液的内水相可以更好地激发蛋白质颗粒的稳定能力,在W/O/W乳液内部起到稳定剂的作用。当米糠蛋白质量浓度不小于0.4 g/100 mL时,W/O/W乳液中蛋白质的界面吸附率高达78%以上。在米糠蛋白质量浓度为0.3 g/100 mL时,蛋白质颗粒在界面的吸附量明显低于其他质量浓度,这可能是因为蛋白质量浓度过低导致的液滴在界面短暂稳定后发生了游离现象。
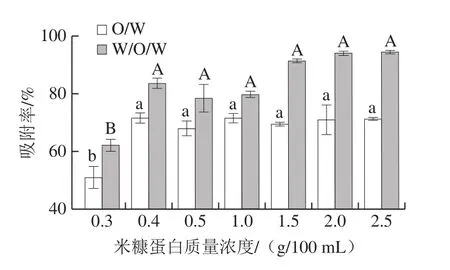
图6 米糠蛋白O/W及W/O/W乳液的吸附率Fig.6 Proportion of adsorbed protein in rice bran protein-stabilized O/W and W/O/W emulsions
2.6 米糠蛋白质量浓度对O/W及W/O/W乳液粒径和电位的影响
由表1可知,相同质量浓度下,W/O/W乳液的液滴的粒径均大于O/W乳液,这与光学显微镜的拍摄结果一致。可能是由于W/O/W乳液经过2 次乳化,液滴中包裹小液滴的结构导致粒径较大[25];也可能有少部分乳液液滴破乳聚集形成的[26];其形态如图7所示。W/O/W乳液的粒径随着米糠蛋白质量浓度的上升先增大后减小,当蛋白质量浓度为0.4 g/100 mL时,乳液内部包裹了更多的W/O液滴,粒径较大;米糠蛋白质量浓度为0.5 g/100 mL以上时,乳液的粒径基本维持在30~40 μm之间,可能是在体系中米糠蛋白在界面发生重排进而稳定了水油两相;没有多余蛋白质进入连续相导致的体系失稳,也避免了由于蛋白质量浓度不足导致的液滴短暂稳定后的絮凝现象[27-28]。
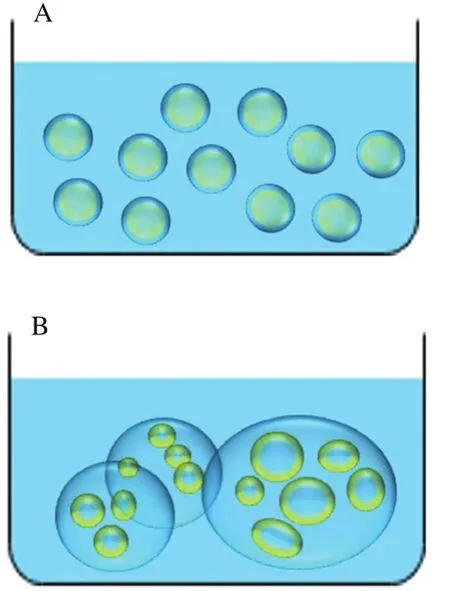
图7 O/W乳液(A)及W/O/W乳液(B)的形态示意图Fig.7 Morphology diagrams of O/W emulsion (A) and W/O/W emulsion (B)
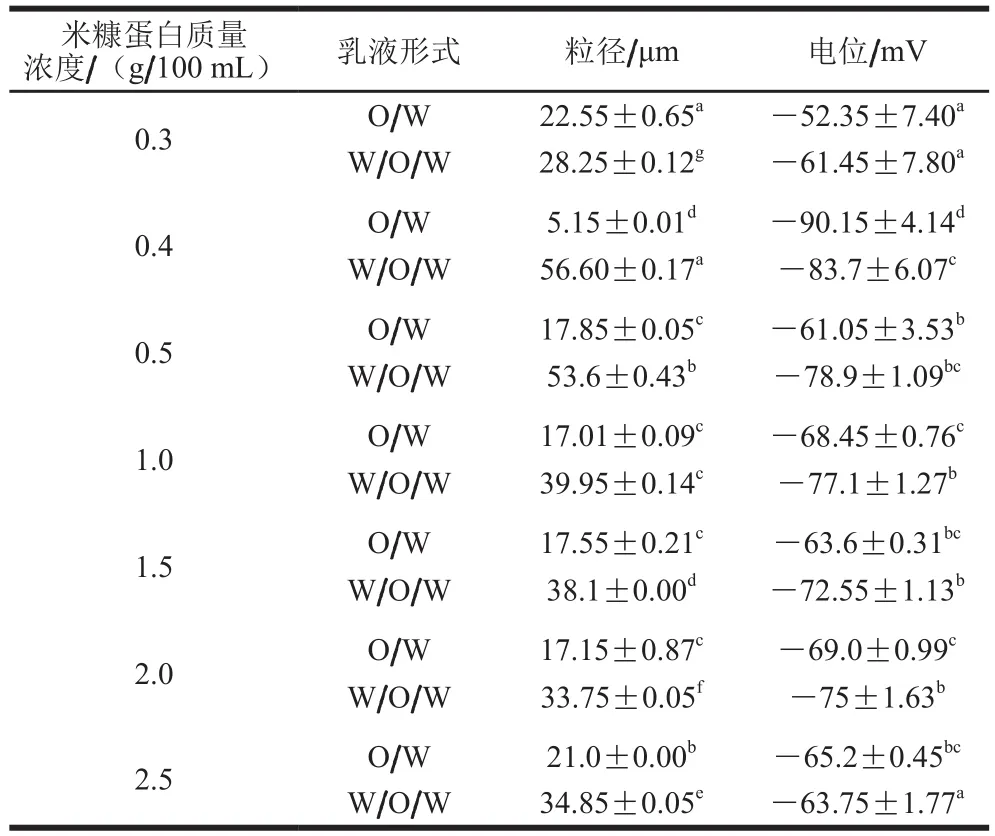
表1 不同米糠蛋白质量浓度乳液的粒径和电位Table 1 Particle sizes and zeta potentials of emulsions stabilized with different concentrations of rice bran protein
同时,W/O/W乳液的电位值也随质量浓度的升高呈现先增大再减小的趋势。O/W乳液很难借助静电斥力达到稳定乳液的目的,而除0.3 g/100 mL组外,其他质量浓度W/O/W乳液均能够借助静电斥力达到稳定乳液的目的[29]。米糠蛋白质量浓度为0.4 g/100 mL时,W/O/W乳液的电位绝对值达到最大,乳液液滴之间的静电排斥作用越强,有效地防止了液滴之间的聚集,对乳液的稳定有积极作用[30-31]。
3 结 论
本研究方法可有效制备O/W及W/O/W乳液,且W/O/W乳液的稳定性显著高于O/W乳液。贮存48 h后,O/W乳液大量析出,且随着蛋白质量浓度的升高析出液体颜色越深;W/O/W乳液析出液体明显较少,且颜色较浅,这是因为W/O/W乳液的界面蛋白质吸附率普遍高于O/W乳液且当米糠蛋白质量浓度不小于0.4 g/100 mL时,W/O/W乳液中蛋白质的界面吸附率高达78%以上。O/W乳液的稳定指数随着米糠蛋白质量浓度的上升逐渐降低,黏度均小于10 mPa•s;W/O/W乳液的稳定指数、黏度均显著高于O/W乳液;当蛋白质量浓度为2.0 g/100 mL时,W/O/W乳液的黏度高达42 mPa•s,相当于等量蛋白质O/W乳液的4 倍。这些数据表明了W/O/W乳液颗粒利用率高,体系黏度大,油相不易沉降,有更好的乳化能力和稳定性。当米糠蛋白质量浓度为0.4 g/100 mL时,W/O/W乳液的稳定性较O/W乳液提高了1 倍以上,此时液滴间的静电斥力最强,绝对值达到84左右,这是造成此乳液更加稳定的主要因素。本研究为天然米糠蛋白质在食品级乳液中的开发提供参考,为粮食副产物的综合利用提供了新思路。
