基于质控图联合Westgard多规则理论的替考拉宁血药浓度监测的室内质控评估
2021-12-03唐原君王倩茹唐晶晶石晨阳
陈 明,唐原君*,王倩茹,唐晶晶,石晨阳
0 引言
替考拉宁(Teicoplanin)又称肽可霉素,由游动放线菌属发酵产生。其作用机制与万古霉素相似,与细菌细胞壁肽聚糖前体分子结合,抑制细胞壁的合成,从而抑制或杀灭细菌[1-2]。研究表明,替考拉宁的抑菌效应与其达到最低抑菌浓度和抗菌后效应有关,提示了替考拉宁血药浓度监测的重要意义[3-4]。替考拉宁药品说明书2018版也指出,在完成负荷剂量治疗方案后,在稳态时监测替考拉宁浓度,有助于确保达到最低血清谷浓度,表明替考拉宁血药浓度监测的必要性已经得到共识[5]。替考拉宁为糖肽类抗生素,主要由5个结构类似的化合物组成(TA2-1、TA2-2、TA2-3、T2-4、TA2-5),其中TA2-2为主要组分,占各组分总含量的40%~60%。当临床上检测浓度较低时,会出现TA2-1、TA2-3、T2-4和TA2-5的峰,有可能还会出现这4个峰和其他杂质峰达不到有效分离[6]。有文献报道采用TA2-2峰的峰面积定量与采用5种成分的峰面积加和定量,其结果并无临床显著差异[7]。
考虑以上因素,本实验室建立了测定人血清中替考拉宁(TA2-2峰)浓度的高效液相色谱法(HPLC),并应用于临床血药浓度监测。为保证替考拉宁血药浓度监测结果的准确性和可靠性,现对2019年1-6月室内质控结果进行回顾性分析,以确保替考拉宁的血药浓度监测质量,为临床医师使用和调整替考拉宁治疗方案提供实验室依据,保证临床安全、有效地使用替考拉宁。
1 材料
1.1 仪器 SHIMADZU LC-10AD高效液相色谱仪(SHIMADZU,美国),包括LC-10AT色谱泵,SIL-10AD自动进样器,CTO-10AS柱温箱,SPD-10A检测器;HY-5涡旋混合器(SI公司,美国);Centrifuge 5804R冷冻离心机(Eppendorf公司,德国);AL104-01电子分析天平(METTLER TOLEDO,瑞士);CPA2250电子分析天平(赛多利斯,德国);SK7200H超声仪(上海科导超声仪器有限公司);Hitech-Kflow水纯化系统(18.2 MΩ)(上海和泰仪器有限公司)等。
1.2 试药 替考拉宁对照品(纯度:每毫克相当于894单位,中国食品药品检定研究院,批号:130374-201002);富马酸喹硫平对照品(大连美仑生物技术有限公司,批号:N1102AS,纯度:>98%);磷酸二氢钠(上海凌峰化学试剂有限公司,分析纯);甲醇(Merck,HPLC级);乙腈(Merck,HPLC级);二氯甲烷(上海凌峰化学试剂有限公司,分析纯);磷酸(分析纯);水为超纯水。
2 方法与结果
2.1 工作溶液配制 精密称取替考拉宁标准品20.36 mg,置于10 ml棕色容量瓶中,加水溶解并定容,配制成浓度为2.036 mg/ml的标准品储备液。4 ℃避光保存。精密称取喹硫平标准品8.18 mg,置于50 ml棕色容量瓶中,加水溶解并定容,配制成0.16 mg/ml内标储备液,4 ℃避光保存。
2.2 血浆样品及质控品处理方法 人血浆样品及随行质控样品室温下解冻后,分别取400 μl置于1.5 ml 塑料离心管中,加入50 μl内标工作液,混匀,加入600 μl乙腈沉淀,涡旋振荡5 min,于13 000 r/min离心5 min。取上清液900 μl置于另一1.5 ml EP塑料离心管中,加入400 μl二氯甲烷,涡旋振荡5 min,于13 000 r/min离心5 min。取上清液200 μl置于进样器中自动进样20 μl,进行LC-UV分析。
2.3 色谱条件 分析柱:Waters Symmetry C18色谱柱(250 mm×4.6 mm,5 μm);内标:喹硫平;柱温:35 ℃;流动相:0.01 mol/L NaH2PO4(pH 2.7)-乙腈(76∶24);流速:1.0 ml/min;进样量:20 μl;检测波长:240 nm。典型色谱图见图1。由图1可见,空白血浆在替考拉宁和喹硫平出峰处无明显杂质峰干扰,替考拉宁和内标的保留时间分别为8.41 min和12.62 min。
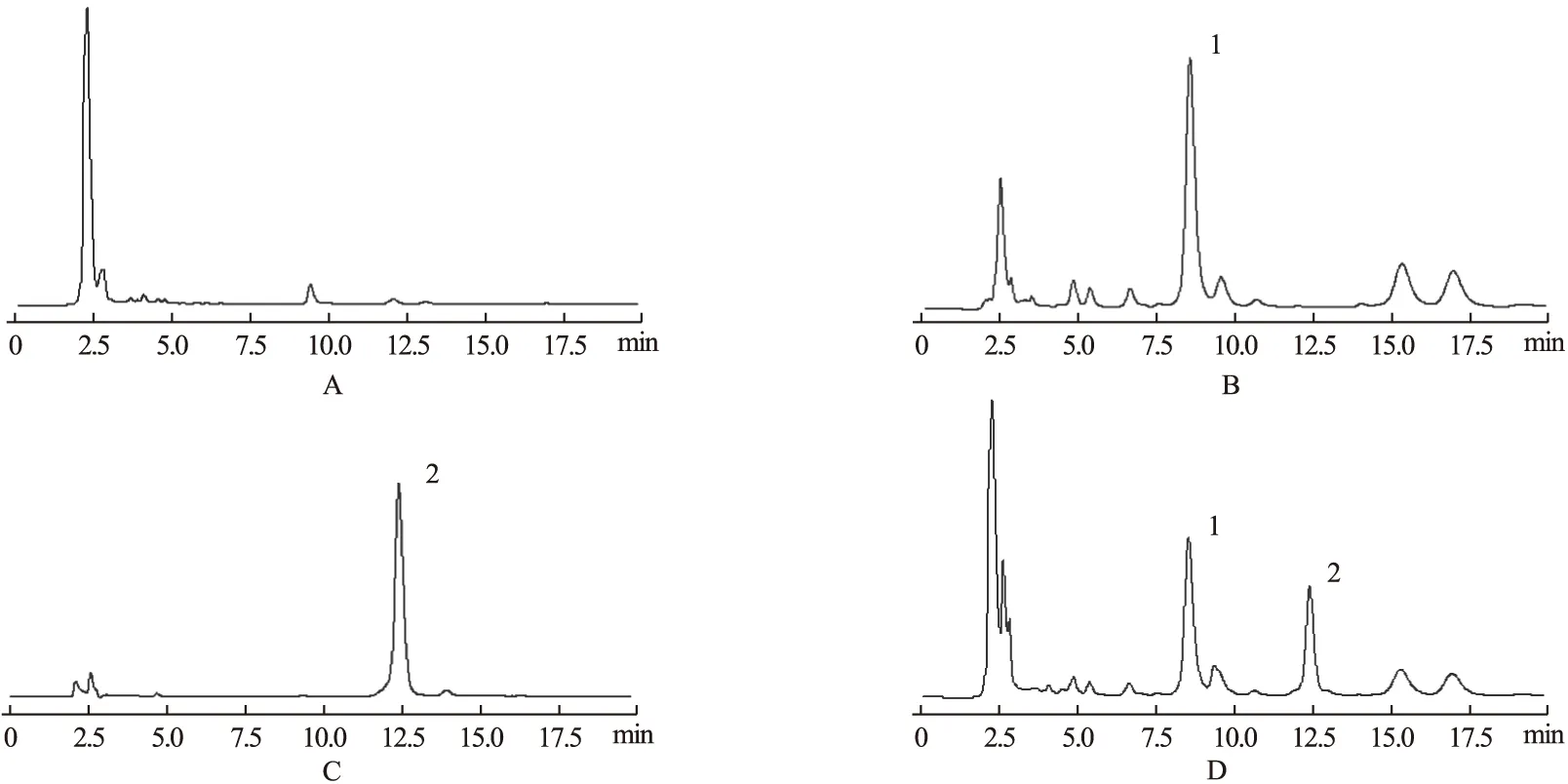
图1 人血浆中替考拉宁高效液相色谱图注:A.空白血浆,B.替考拉宁对照品,C.内标喹硫平对照品,D.患者滴注替考拉宁达稳态后的血浆样品。1.替考拉宁,2.喹硫平
2.4 室内质量控制
2.4.1 线性范围评价及定量下限(LLOQ) 配制浓度为101.80、50.90、25.45、12.72、6.36、3.18 mg/L的替考拉宁血浆样品,每一浓度各3份,按“2.2”项下操作,记录替考拉宁和内标峰面积,以替考拉宁浓度(mg/L)为横坐标,替考拉宁TA2-2峰面积(A)与内标峰面积(AI)的比值(A/AI)为纵坐标,采用加权最小二乘法进行两者线性回归运算,得到标准曲线方程为y=0.03 062 x-0.013 14 (R2=0.999 8),结果表明,人血浆中替考拉宁浓度在3.18~101.80 mg/L范围内具有良好的线性关系。配制替考拉宁定量下限3.18 mg/L血浆样品5份,按“2.2”项下操作,计算得替考拉宁定量下限信噪比大于10,RSD小于2%,RE小于10%。
2.4.2 准确度和精密度 配制低、中、高3种浓度(3.77、11.31、33.93 mg/L)的替考拉宁质控样品,每个浓度的样品平行制备5份,按“2.2”项下处理,记录替考拉宁和内标峰面积。按标准曲线回归方程计算浓度,对比求得日内精密度。连续测定3 d,考察方法的日间精密度。测定浓度与理论浓度对比,求得准确度。结果见表1。
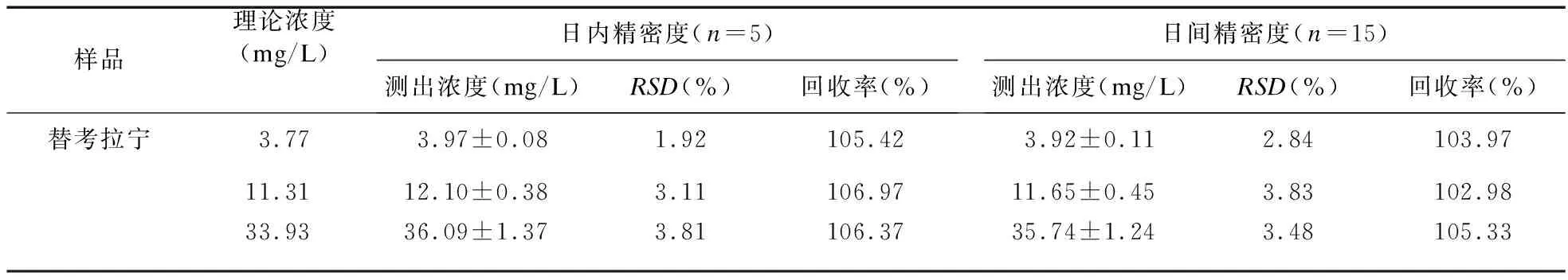
表1 HPLC法测定替考拉宁的方法回收率和精密度
2.4.3 提取回收率评价 配制低、中、高(L、M、H) 3个浓度的替考拉宁血浆质控样品各5份,同时配制低、中、高(L、M、H) 3个浓度的不含血浆质控样品各5份,按“2.2”项下处理,记录替考拉宁和内标峰面积,将相应浓度的替考拉宁血浆样品峰面积与不含血浆质控样品峰面积进行对比,计算提取回收率。见表1。同理,计算内标喹硫平提取回收率为94.82%。
2.4.4 稳定性考察 配制低、中、高 3 个浓度(3.77、11.31、33.93 mg/L)的替考拉宁质控样品各5份,置于不同条件下进行稳定性考察:冻融稳定性,样品反复冻融3次;室温稳定性,样品室温放置24 h;进样器放置24 h稳定性,样品按前处理方法处理后,在进样盘内放置24 h。质控样品按上述条件处理后,以测得值与真实值比较,偏差均小于15%。结果表明,样品在反复冻融3次、室温放置24 h、进样器放置24 h条件下均稳定。
2.5 回顾性质量控制
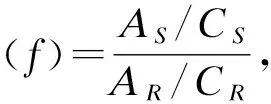
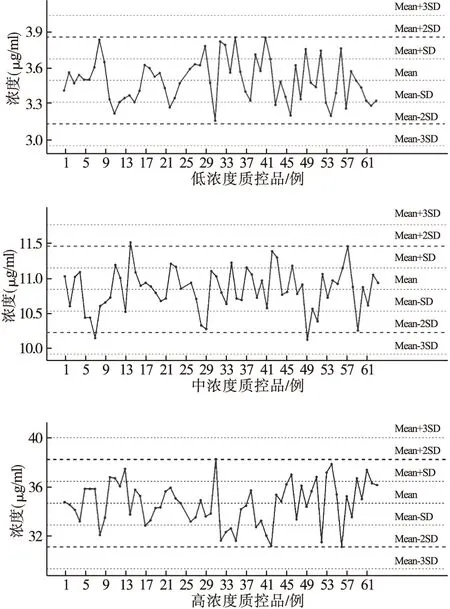
图2 替考拉宁低、中、高浓度质控品 Levey-Jennings 质控图
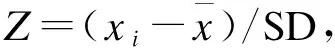
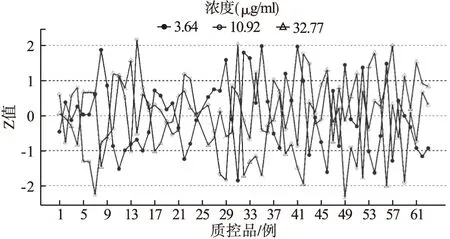
图3 替考拉宁低、中、高浓度质控品 Z-分数质控图
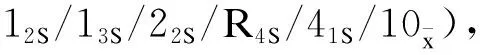
3 讨论
治疗药物浓度监测对于临床合理用药、减少不良反应的发生具有重要意义,而测定结果的准确性和稳定性是制定个体化给药方案的重要前提[14]。室内质控是保证临床实验室发出高质量报告的基本要求。根据我国颁发的《临床实验室质量管理办法》中要求,室内质量控制为检验人员按照一定的频度连续测定稳定样品中的特定组分,并采用一系列方法进行分析,按照统计学规律推断和评价本批次测量结果的可靠程度,以此判断检验报告是否可发出,及时发现并排除质量环节中的不满意因素[15]。目前,大多数药学人员开展治疗药物浓度监测工作尚未执行统一质量控制标准,国内外HPLC 监测血药浓度的室内质量控制研究尚不完善,且所用质控品均为自行配制。关于替考拉宁血药浓度监测的室内质控研究尚未见报道,因此,本研究在已有实验室条件下,对HPLC法测定替考拉宁血药浓度的室内质量控制评价体系进行了相关探索。

室内质量控制活动中经常使用Levey-Jennings图和Z分数质控图来监测检测结果的误差是否在可接受的范围。Levey-Jennings质控图主要用于同一浓度水平质控品的精密度比较,但不适用于判断准确度;而Z分数质控图可以将不同浓度水平质控品进行标准化后绘制在同一张质控图上,通过单值质控图连续评价实验室的质量控制能力[18-19]。观察上述质控图,可以看出Z分数质控图的低、中、高浓度质控品测定值在不同时间点的变化趋势与Levey-Jennings质控图保持一致。将Levey-Jennings质控图与Z分数质控图联合Westgard多规则理论,可以降低假失控和假报警率,从而呈现室内质控的准确性。
本文采用Levey-Jennings图和Z分数质控图,结果显示,替考拉宁血药浓度监测的室内质控分析结果均在误差允许范围内,保证了血药浓度测定的准确性和可靠性,具有较好的临床指导意义。本实验室在日常治疗药物浓度监测工作中通过及时绘制质控图进行监测,可以及时发现质控测定中出现的漂移、趋势性变化、失控等问题,也可及时发现影响测定结果准确性的潜在因素。有助于实验人员判断误差类型并排除误差原因,增加血药浓度监测结果的可靠性。
