糖基化黄酮类化合物与肠道菌群的相互作用影响机体健康的研究进展
2021-12-02雷和花张利民
吴 方, 陈 桂, 曹 政, 雷和花, 陈 川, 张利民
黄酮类化合物在体内与肠道微生物相互作用直接影响其代谢和生物活性。本文就黄酮类化合物与肠道菌群的相互作用影响机体健康的研究进展进行综述。
1 不同黄酮糖苷化合物的吸收与活性
多酚被认为在人类健康中扮演着重要的角色,特别是预防与生活方式相关的疾病,包括代谢综合征、动脉粥样硬化、冠心病和骨质疏松症等[1-3]。黄酮类是主要的膳食多酚,广泛存在于中草药、水果和蔬菜等植物中,具有多种生物效应,如抗炎、抗氧化、抗病毒、抗菌、心血管和化学预防等[4]。黄酮糖苷类天然产物是植物中黄酮类化合物的主要存在形式,常见的糖基配体有葡萄糖基、鼠李糖基、新橙皮糖基和芸香糖基(见图1)。有研究表明,不同黄酮类化合物的基本结构,即苷元的结构以及糖的类型对其生物利用度有很大的影响,而生物利用度是决定其体内活性的关键因素[5]。大多数黄酮苷元及部分黄酮糖苷类化合物在水中存在溶解性差、生物利用度低等问题,从而导致人体对黄酮类药物吸收慢、药效不显著,极大地限制了其临床应用,给黄酮类新药的寻找与开发带来相当大的困难。已有研究表明小肠是黄酮单糖苷类物质吸收的重要部位,小肠中的β-葡萄糖苷酶可水解黄酮单糖苷,苷元再进一步在相关酶的作用下形成葡萄糖醛酸等代谢物进入体循环中,这明显提高了黄酮类物质的生物利用度[6]。因β-葡萄糖苷酶不能水解非单糖苷类黄酮苷(例如芦丁苷),这些多糖苷的黄酮苷类大多在盲肠和结肠中被微生物分解为可吸收的苷元[7]。此外,当黄酮苷元直接进入体内,例如橙皮素,大部分的橙皮素是直接通过与P糖蛋白结合后通过尿液直接排出,导致其生物利用度低[8]。相关研究表明,对黄酮类化合物进行糖基化修饰是提高其水溶性,改善其生物利用度的有效方法之一[9]。da Silva等[10]用鼠李糖苷酶处理橙皮苷和柚皮苷进行去糖基化后变成橙皮素-7-葡萄糖苷和柚皮素-7-葡萄糖苷,发现去糖基化后产物的抗氧化活性相比于橙皮苷和柚皮苷有了明显增加。Jiang等[11]发现葛根素-7-O葡萄糖苷比葛根素具有更高的血液浓度,且在血液中的平均停留时间更长。此外,有学者研究了槲皮素及其不同类型糖苷衍生物在大鼠体内的生物利用度,他们给予大鼠直接口服槲皮素、槲皮素-3-O-芦丁苷、槲皮素-3-O-葡萄糖苷、槲皮素-3-O-麦芽糖苷、槲皮素3-龙胆苷、α-单葡萄糖基芦丁、α-低葡萄糖基芦丁和酶修饰异槲皮苷(α-低聚葡萄糖基异槲皮苷),发现槲皮素-3-O-麦芽糖苷、槲皮素-3-O-葡萄糖苷和α-低聚葡萄糖基异槲皮苷的Cmax、AUC0-12和生物利用度均显著高于槲皮素。然而槲皮素3-龙胆苷和槲皮素-3-O-芦丁苷的Cmax、AUC0-12和生物利用度均明显低于槲皮素。槲皮素-3-O-葡萄糖苷葡萄糖基团α-键的延长提高了其生物利用度[12-14]。通过给予大鼠口服等摩尔剂量的毛蕊异黄酮葡萄糖苷和毛蕊异黄酮,发现前者在血浆和组织中的暴露量比后者高,提示毛蕊异黄酮葡萄糖苷可作为毛蕊异黄酮的前药,且可能具有更高的生物利用度[15]。综上所述,与苷元相比,黄酮苷类在血浆中的含量较高,在血液中的平均停留时间更长,且黄酮单糖苷类的生物利用度存在比非单糖苷类高的潜在可能。
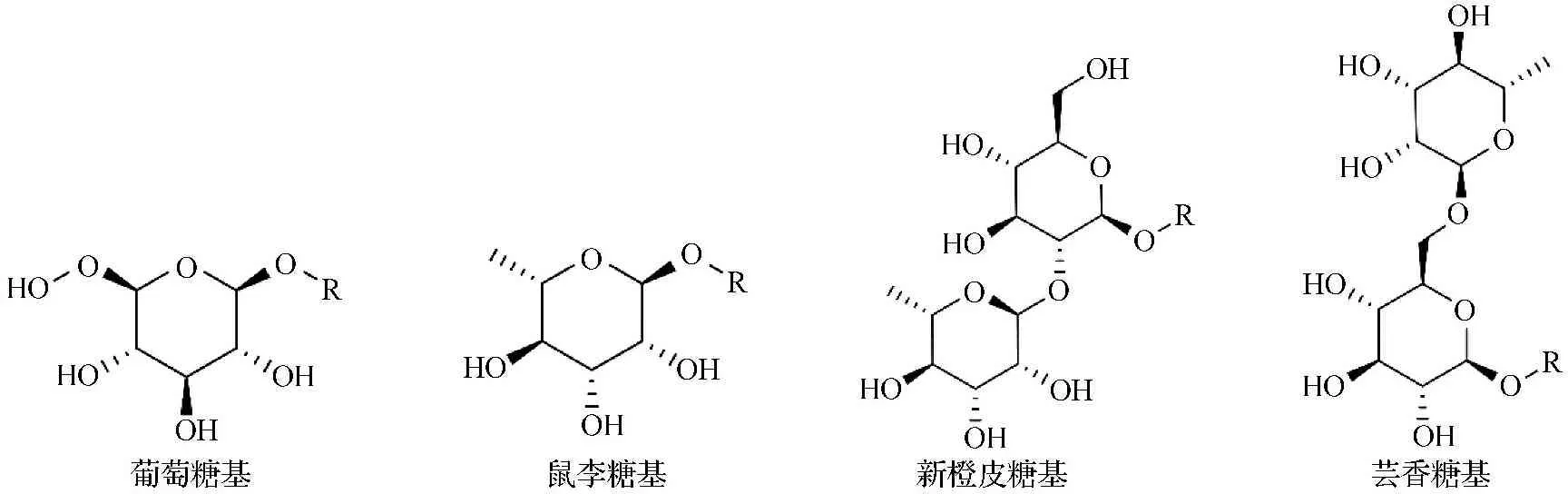
图1 常见糖基配体的结构图
2 肠道菌群与类黄酮糖苷化合物之间的关系
肠道是一个复杂的生态系统,拥有密集多样的微生物群落,称为肠道菌群,与宿主共同进化,形成互惠关系[16]。肠道微生物群含有大量不同类型的酶,它们在饮食摄入的化合物进入结肠之前对其进行修饰。除了几种羟化酶,包括糖苷酶、葡萄糖醛酸酶、硫酸盐酶、酰胺酶和酯酶之外,还有微生物酶催化各种类型的反应,包括氧化、还原、脱羧、去甲基化、异构化和环裂解反应[17]。近年来,肠道微生物的变化成为越来越多疾病及药物的研究热点。正常肠道菌群的生态失调可导致胃炎、炎症性肠综合征、腹泻和结直肠癌等疾病。此外,随着生活节奏的加快,越来越多的人在生活中有不良饮食习惯、缺乏锻炼、压力过大等情况,而这会引起机体菌群持续性的改变,导致一系列的疾病风险,例如神经退行性疾病、心血管疾病和肥胖等[18]。因此,研究药物与肠道菌群之间的作用显得越来越重要。由于黄酮糖苷类化合物的结构特性,肠道及微生物成为影响其吸收的重要因素,微生物群开始被认为是一种代谢器官,促进糖基化黄酮化合物的代谢,进而影响其生物利用度和所显示的生物效应[19-20]。有研究发现通过体外厌氧培养,毛蕊异黄酮葡萄糖苷可被大鼠肠道菌群快速完全水解,产生的毛蕊异黄酮在肠道菌群中高度稳定。此外,体内研究也发现微生物转化和肝脏葡萄糖醛酸化是毛蕊异黄酮葡萄糖苷代谢物(毛蕊异黄酮-3′-O-葡萄糖醛酸)代谢至大鼠全身的关键[21]。另有研究发现人体肠道微生物对芹菜素-7-葡萄糖苷的代谢具有较大影响,其主要是通过影响宿主形成的黄酮及其衍生代谢物的转化,从而影响芹菜素-7-葡萄糖苷在宿主体内的生物活性[22]。不仅肠道微生物可以影响黄酮糖苷的代谢与生物活性,相对应的摄入类黄酮也可以调节肠道微生物群落。其中肠道微生物双歧杆菌和乳酸杆菌能产生β-葡萄糖苷酶,它能有效水解类黄酮苷,产生苷元和葡萄糖[23]。淫羊藿次苷I(淫羊藿素-7-O-葡萄糖苷)是从淫羊藿中分离得到的一种新型化合物,有研究发现口服淫羊藿次苷I可以改善荷瘤小鼠盲肠内容物的菌群结构,并且显著回调小鼠盲肠内容物中乳酸菌和双歧杆菌的丰度,从而达到调节肠道菌群及其衍生代谢产物,改善宿主肠道屏障和免疫功能的作用[24]。由此可见,类黄酮糖苷与肠道菌群具有相互作用。首先,黄酮类化合物可被肠道微生物代谢,从而提高其生物利用度。其次,黄酮类化合物可调节肠道微生物种群结构,从而进一步影响宿主代谢。膳食中的黄酮类化合物与肠道微生物之间的这种相互关系往往增强了黄酮类化合物的生物活性,因为它们的代谢物可能比它们的母体化合物具有更高的生物活性。由于黄酮糖苷中糖基配体的不同,微生物对其影响也不尽相同。许多研究发现,黄酮类物质的糖苷形式比苷元形式与肠道菌群的相互作用更为显著。一些体外研究发现,黄酮苷元相比于黄酮糖苷具有更高的抗氧化能力,但是体内实验结果却与之不同,苷元的生物活性在许多方面不如黄酮糖苷[20]。这与黄酮糖苷在体内的代谢密切相关,而由于黄酮糖苷的结构特征导致肠道微生物在其代谢过程中起到重要影响。前面讨论了不同黄酮糖苷类物质在体内的吸收过程,黄酮单糖苷类物质主要在小肠段被水解为苷元吸收,水解脱落的糖基则进入大肠中,被微生物分解利用。而一些双糖苷的黄酮类化合物则主要在大肠段经由微生物代谢的相关酶水解后被吸收代谢。类黄酮糖苷与微生物之间的这种相互影响有利于进一步研究不同类型的类黄酮糖苷的生物学意义,在基于肠道菌群研究的基础上探索类黄酮糖苷对于疾病的作用机制。肥胖现在成为越来越值得关注的健康问题,有研究发现,黄酮类化合物可以通过调节肠道炎症相关的微生物群的组成,发挥对肥胖等相关疾病的保护作用[25]。长期补充膳食中的异槲皮素和可溶性菊粉纤维可以通过有益性地改变肠道菌群来介导减缓高脂饮食小鼠代谢综合征的发展[26]。此外,类黄酮的摄入还与心血管疾病及肠道微生物之间有密切关系。黄酮类化合物通过肠道微生物代谢转化后,在预防和治疗心血管疾病方面具有潜在价值[27]。总而言之,肠道微生物与类黄酮糖苷在类黄酮糖苷的代谢及相关的代谢性疾病上存在着相互作用,这有利于进一步了解类黄酮糖苷的作用机制,有针对性地采取干预措施,以改善肠道微生物组成,从而预防或治疗代谢疾病。
3 肠道菌群与类黄酮糖苷化合物的靶向代谢组学研究
除了肠道微生物本身外,微生物直接影响的宿主代谢物如胆汁酸以及微生物衍生的代谢产物,短链脂肪酸和色氨酸(tryptophan)代谢产物,均具有各自的生物学功能,可调节多种代谢综合征,如肥胖、糖尿病和高血压[16,28-29](见图2)。它们构造了肠道菌群的组成,并为宿主细胞和肠道菌群提供能量来源。宿主基因组和微生物组(即肠道微生物群的基因组)共同产生这些的代谢物可作为重要的信号传递因子和能量基质参与到宿主的生命活动中,调节免疫系统和代谢表型,并影响疾病的危险因素和对治疗的反应[30]。

图2 饮食摄入的黄酮类化合物通过调节肠道菌群及其宿主代谢改善代谢性疾病的示意图
3.1类黄酮糖苷影响宿主肠道菌群及宿主胆汁酸代谢 胆汁酸主要在肝脏中合成,转运至肠道后再通过重吸收进入肠上皮细胞,而后在循环系统的作用下再回到肝细胞,形成了一个完整的肝肠循环[31]。在远端小肠和结肠中,胆汁酸受到肠道菌群胆盐水解酶(bile salt hydrolase,BSH)的解偶联作用,从而阻止结合型胆汁酸在肝肠循环中的主动摄取。解偶联后的胆汁酸经过微生物转化,包括脱羟基、差向异构化和氧化产生一系列的次级胆汁酸[32]。因此,肠道微生物对于胆汁酸的代谢具有重要意义。此外,胆汁酸的变化也与代谢性疾病和恶性肿瘤等疾病有关[32]。柚皮苷是来自柑橘中的一类主要类黄酮糖苷,有研究发现,柚皮苷可以通过“肠道菌群-肝脏-胆固醇”轴来调节Apoe基因敲除小鼠的胆固醇代谢从而缓解动脉粥样硬化,其中主要通过抑制肠道法尼醇X受体(farnesoid X receptor,FXR)/成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)信号通路来调节胆汁酸合成途径中的限速酶细胞色素P450 7A1(cytochrome P450 7A1,CYP7A1),从而促进胆汁酸的合成及排出[33]。
3.2类黄酮糖苷影响宿主与肠道菌群的共生代谢物
短链脂肪酸主要包括由膳食纤维产生的乙酸、丙酸、丁酸和肠道菌群发酵产生的非消化碳水化合物,是肠内细胞的主要能量来源,广泛参与微生物生长和宿主能量代谢。短链脂肪酸不仅为宿主提供能量,它还是调控生物过程的信号分子,由短链脂肪酸介导的G蛋白偶联受体41/43(G-protein-coupled receptor 41/43,GPCR-41/43)信号与肥胖及其引起的代谢性疾病密切相关[34]。此外,短链脂肪酸可调节宿主的肠上皮黏液水平维持天然肠道屏障功能、调节肠道运动、肠脑轴及免疫功能等[35]。大量研究发现,黄酮类化合物在调节肥胖引起的肠道菌群紊乱中,短链脂肪酸起到了一定的介导作用。有研究发现黄芩苷可能通过影响短链脂肪酸的产生来改善高脂饲养诱导的小鼠糖脂代谢异常[36]。另有研究表明,橙皮素及其衍生物诱导的短链脂肪酸改变了微生物组成,从而使腹部脂肪组织积累显著减少,脂肪酸合成、脂肪酸氧化和体内脂肪分解的增加[37]。色氨酸在胃肠道中的代谢有三个主要途径:(1)色氨酸直接通过肠道微生物直接转化为吲哚及其衍生物;(2)在免疫细胞和肠上皮细胞中在吲哚胺2,3-双加氧酶(indoleamine 2,3 dioxygenase,IDO)1的作用下代谢为犬尿酸;(3)在肠嗜铬细胞中通过色氨酸羟化酶1(tryptophan hydroxylase 1,TpH1)代谢为5-羟色胺(5-hydroxytryptamine,5-HT)[16]。其中由肠道微生物直接代谢而成的吲哚及其衍生物中,有许多是多环芳烃核受体(aryl hydrocarbon receptor,AhR)的配体,AhR信号通路被认为是免疫应答的关键组成部分,并且对肠道内环境稳定至关重要[38]。在一些代谢性疾病如肥胖、糖尿病和炎症性肠病(inflammatory bowel disease,IBD)中,由于肠道菌群的失调,引起机体AhR的配体减少[39]。在针对黄酮单糖苷的研究中发现,健康小鼠饮食摄入橙皮素单葡萄糖苷(hesperetin-7-O-glucoside)后,其粪便中色氨酸相关代谢物的水平发生变化,其中尤以吲哚-3-乙醇(indole-3-acetic acid,IAA)和吲哚-3-丙酸(indole-3-propionic acid,IPA)的上调最为显著。与之相关的肠道菌乳酸菌(Lactobacillus)、瘤胃球菌(Ruminococcus)、假单胞菌(Pseudomonas)、丁酸蓖麻单胞菌(Butyricimonas)和嗜胆汁菌(Bilophila)也都发生了显著性变化[40]。
4 结语
随着经济的快速发展,人们生活水平和饮食条件得到了明显改善,同时由饮食带来的问题也受到越来越多的关注,膳食黄酮也成为了一些研究的热点。针对不同糖苷的类黄酮,总结其吸收和代谢的不同特征,进一步论述了类黄酮糖苷与微生物及宿主之间的关系。不同类黄酮糖苷代谢及其作用机制的不同与其结构有着密切关系。肠道微生物作为其中较为重要的一环,对其代谢及生物活性有着重大的影响。与此同时,肠道微生物作为新的靶点和方向为未来进一步研究不同类黄酮糖苷的作用机制提供了新的角度,从而进一步发掘黄酮类物质的生物活性,使其在调节人体健康的道路上具有更广阔的前景。
