黄烷-3-醇类化合物在体内的吸收、代谢特征与机制研究进展
2021-12-02刘若男陈婉冰晏芳芳
刘若男,陈婉冰,晏芳芳,刘 敏,鲁 群,杨 宏,刘 睿,*
(1.华中农业大学食品科学与技术学院,环境食品学教育部重点实验室,湖北 武汉 430070;2.武汉市蜂产品质量控制工程技术研究中心,湖北 武汉 430000;3.农业农村部华中都市农业重点实验室,湖北 武汉 430000)
黄烷-3-醇类化合物基本组成单位的分子骨架是C6—C3—C6,即两个芳香环(A环、B环)之间以一个三碳链的吡喃环(C环)相连,形成最基本的黄烷-3-醇单体,其中以儿茶素、表儿茶素及其衍生物最为常见,再以此聚合形成黄烷-3-醇聚合物(即原花青素),包括二聚体、三聚体和高聚体等。根据聚合方式的不同将黄烷-3-醇聚合物分为A型原花青素和B型原花青素,B型原花青素是基本结构单元之间通过C4—C8键或C4—C6键连接而形成,而A型原花青素还在C2—C7、C2—C5间形成醚键[1]。黄烷-3-醇类化合物分布广泛,水果(葡萄、苹果、蓝莓和蔓越莓等)及其制品、豆类(鹰嘴豆、蚕豆、芸豆和小扁豆等)、坚果(夏威夷果、榛子和开心果等)、谷物(高粱)、中草药(银杏、黄连和桂皮等)等都是黄烷-3-醇类化合物的重要来源,且大多数为人类日常饮食,因此人类对黄烷-3-醇类化合物的摄入量并不匮乏。据调查,美国成年人的黄烷-3-醇类化合物摄入量为95 mg/d;黄烷-3-醇类化合物摄入量的占比由高到低依次为高分子聚合物(30%)、单体(22%)、二聚体(16%)、四至六聚体(15%)、七至十聚体(11%)和三聚体(5%)[2-3];西班牙人的类黄酮摄入量为313 mg/d,其中黄烷-3-醇类化合物为189 mg/d,占类黄酮摄入量的60%[4]。
许多国内外研究都证明黄烷-3-醇类化合物在促进健康方面发挥着重要作用,如抗氧化,抗炎,预防心血管疾病、癌症以及衰老相关的代谢综合征。同时随着消费者对于其相关功能性食品和产品的需求增加,以及植物性保健食品和膳食补充剂等商业产品开发的兴起,黄烷-3-醇类化合物在体内的吸收和代谢也受到了关注。近年来许多研究发现摄入黄烷-3-醇类化合物后,其代谢产物可能比母体化合物在体内发挥的生物活性更强[5]。有研究报道人体摄入原花青素后,其在体内血液中的浓度仅能达到10-9~10-8mol/L,人体吸收量不到摄入量的1%[6]。但Stoupi等的研究结果提示评估黄烷-3-醇类化合物在体内发挥的作用时需要考虑其代谢产物,他们首先对14C标记的原花青素B2生物利用度进行了评估,根据雄性大鼠口服14C标记的原花青素B2后0~96 h尿液中14C的总放射性,得出14C标记的原花青素B2绝对生物利用度约为82%;然后对比了静脉摄入和经口摄入后血液中的14C总放射性,结果表明,14C标记的原花青素B2经口摄入后,其血浆放射性代谢动力学特征值(总清除率和表观分布体积)比静脉摄入高出8 倍,但是经口摄入的曲线下面积(血液中原花青素B2浓度随时间变化的积分值)仅为静脉摄入曲线下面积的11%;这些都表明经口摄入后进入血液循环的14C标记化合物不仅有母体化合物本身,还包含其他物质,而这些物质是由母体化合物代谢和转化而来,研究者将母体化合物代谢和转化归因于肠道微生物[7]。因此要充分评价黄烷-3-醇类化合物在体内的生物利用度,不仅要考虑黄烷-3-醇类化合物在体内的吸收情况,还要考虑肠道微生物对其代谢过程及代谢产物。
1 黄烷-3-醇类化合物在体内的吸收与分布
黄烷-3-醇类化合物经口摄入后首先进入胃,但在胃部基本不被吸收。6 名健康受试者食用了富含黄烷-3-醇类化合物的可可饮料后,黄烷-3-醇类化合物在胃运输持续约50~60 min,在此期间并未观察到胃内容物中黄烷-3-醇类化合物含量的变化,这表明黄烷-3-醇类化合物在胃环境中稳定,大多数经口摄入的黄烷-3-醇类化合物可以完整地到达小肠[8],在小肠进行黄烷-3-醇类化合物(主要是单体和少量的低聚体等)的初次吸收,其余大量的黄烷-3-醇类化合物将完好无损地到达大肠[9]。Stalmach等在研究中发现大量黄烷-3-醇类化合物会从小肠转运到大肠,他们获取了人摄取绿茶后的回肠液,发现回肠液中含有70%的黄烷-3-醇类化合物及其代谢物,其中33%是未被胃和小肠吸收的母体化合物,其余37%是黄烷-3-醇类化合物的代谢物,这两类化合物都将到达大肠进一步被代谢[10];被吸收的一小部分黄烷-3-醇类化合物及其代谢产物可通过II-相代谢酶的作用代谢为葡萄糖醛酸衍生物、硫酸盐衍生和甲基衍生物。这些葡萄糖醛酸衍生物的亲水性有助于其分布于各组织和器官,而硫酸盐衍生物和甲基衍生物主要在肝脏中积累[1]。
目前的研究认为高分子质量的原花青素在胃和小肠中难以吸收,而小分子质量的黄烷-3-醇类化合物可以被小肠直接吸收。摄入黄烷-3-醇类化合物后,少量的二聚体(包括B1[11]、B2[12]、B5[13]、A1[14]和A2[14])以及三聚体C1[15]均在血浆中被检测到。此外有研究也证实黄烷-3-醇类化合物单体比聚合物更容易被吸收,二聚体或三聚体的吸收率仅能达到黄烷-3-醇单体的10%。Shoji等使用高效液相色谱/串联质谱法研究大鼠对苹果黄烷-3-醇类化合物吸收的过程,以1 g/kgmb的剂量经口给药后,表儿茶素、原花青素二聚体B2和三聚体C1在体内的吸收呈现差异,发现大鼠摄入后2 h,二聚体B2和三聚体C1在血浆中的浓度达到峰值,分别为0.4 μmol/L和0.14 μmol/L,而单体表儿茶素在给药后1 h达到峰值(1.3 μmol/L)[13],远高于黄烷-3-醇聚合物在血浆中的浓度。这一现象也在口服葡萄籽提取物的小鼠实验中出现,以1 g/kgmb的剂量口服给药1 h后,(-)-表儿茶素、原花青素二聚体和三聚体在血浆达到的最大浓度分别为2.5、0.57、0.10 nmol/L,而且二聚体和三聚体的吸收率分别仅为1.69%和0.04%[14]。
摄入黄烷-3-醇类化合物后,其代谢产物几乎遍布全身。大鼠摄入原花青素B2后,原花青素B2本身可在小鼠血浆、小肠、肝脏、心脏、肾脏等组织中被检出;其代谢产物在血浆、肝脏、小肠、肾脏、肺、心脏、脑组织和脾脏中被检出,原花青素B2的结合型代谢产物在肝组织中被检出的种类最多,亦有少部分经过血液循环在被肾脏组织富集后排泄[15]。肝脏被认为可能是原花青素及其代谢产物积累的主要器官,而大肠(盲肠和结肠)被认为是机体代谢原花青素非常活跃的器官。聚合度大于4的原花青素几乎不能被小肠直接吸收,而是直达大肠被肠道微生物分解代谢。经过肠道微生物代谢的产物一部分会出现在粪便中,另一部分则经门静脉抵达肝脏,在肝脏经历II-相代谢反应,这类反应形成的代谢产物将进入循环系统;最终,一部分代谢产物会经尿液、粪便排出[1]。大鼠急性摄入榛子皮黄烷-3-醇类提取物(5 g/kgmb)后,其代谢物几乎到达全身的各个器官(肝、脑、肺、肾、肠、睾丸、脾脏、心脏和胸腺),甚至可以穿越血脑屏障[16];此外,Wu Qian等研究发现大鼠急性摄入荔枝果皮黄烷-3-醇类提取物后在脑组织中最先检测到原花青素——A型原花青素二聚体、A型原花青素三聚体和甲基-(-)-表儿茶素[17]。机体摄入黄烷-3-醇类化合物的吸收分布总结见图1。
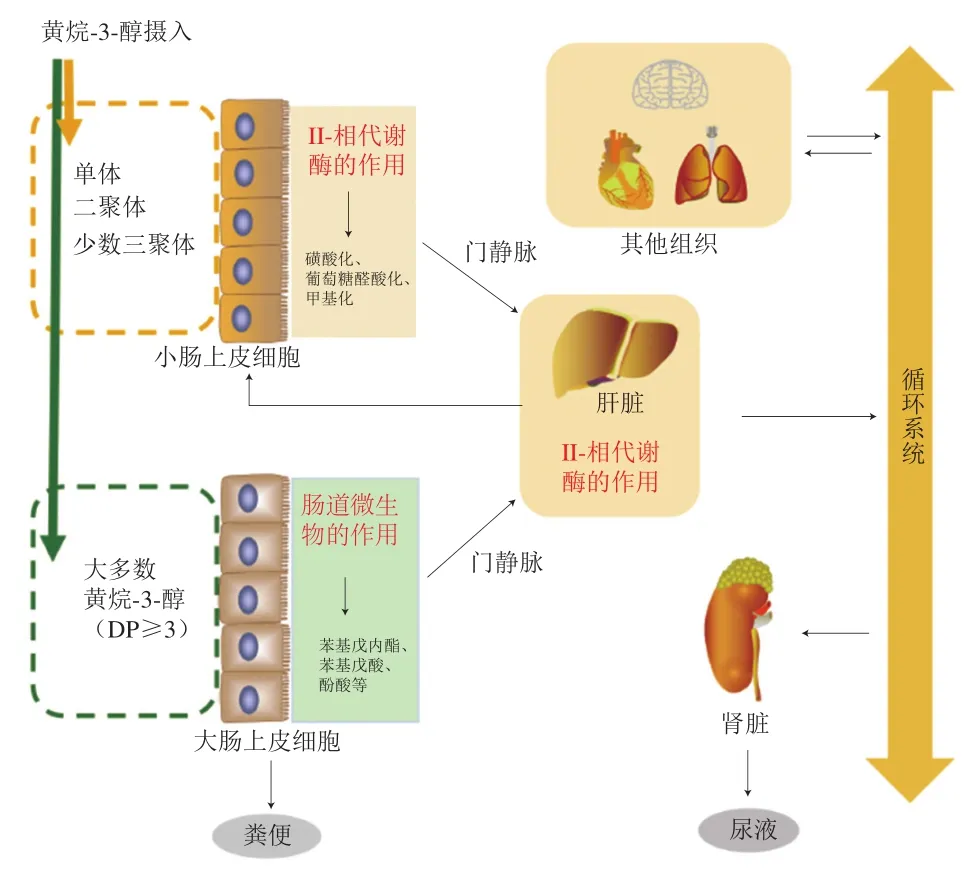
图1 黄烷-3-醇类化合物在体内的吸收与分布Fig. 1 Absorption and distribution of flavan-3-ols in humans
2 黄烷-3-醇类化合物在体内的代谢
2.1 代谢机制
2.1.1 黄烷-3-醇类化合物在小肠中的代谢
黄烷-3-醇类化合物在人体内经历多种代谢历程,最先发生代谢的场所是小肠。肠上皮细胞会对黄烷-3-醇类化合物进行结构修饰,通过磺基转移酶、葡萄糖醛酸转移酶和甲基转移酶的作用发生磺酸化、葡萄糖醛酸化和甲基化等[18-19]。这一过程相当迅速,在1 h内就可在血浆中检测到这些衍生化的代谢产物[20],同时也表明黄烷-3-醇类化合物进入肠上皮细胞被代谢为衍生物后,再次被排出。将(+)-儿茶素通过小鼠小肠灌注时证实了这一点,肠系膜静脉中检测到甲基化代谢产物和葡萄糖醛酸代谢产物[20]。研究发现葡萄糖醛酸转移酶在小肠和大肠的肠黏膜中活性最高,磺基转移酶在肝脏中活性最高,而甲基转移酶在肝脏和肾脏中活性最高[21]。
2.1.2 黄烷-3-醇类化合物在大肠中的代谢
大肠肠道微生物被认为可以进一步代谢黄烷-3-醇类化合物。1964年,Griffith等研究发现大鼠仅通过口服方式摄入(+)-儿茶素时,在尿液和粪便中可以检测到间羟基苯丙酸和间羟基马尿酸,而通过腹腔注射摄入(+)-儿茶素或者大鼠经过饲喂抗生素减少其肠道微生物后再经口摄入(+)-儿茶素,在粪便和尿液中均未检测到间羟基苯丙酸和间羟基马尿酸,后两种摄入方式没有经历大肠肠道菌群的作用;因此,该作者认为黄烷-3-醇类化合物某些代谢产物的形成依赖于肠道菌群的作用[22]。这一发现引起了学者们的兴趣,主要包括黄烷-3-醇类化合物的肠道微生物转化及这一转化对黄烷-3-醇类化合物生物活性的影响。
许多研究认为肠道微生物参与并促进了黄烷-3-醇类化合物在体内的分解代谢,同时在提高其生物活性和改善生物利用度等方面具有积极效果;另一方面,黄烷-3-醇类化合物可以发挥出良好的肠道菌群调节作用,促进肠道有益菌(主要是双歧杆菌、乳酸菌、阿克曼菌)生长,并抑制肠道有害菌(主要为沙门氏菌、假单胞菌、奇异变形杆菌、致病性大肠杆菌)的繁殖[23],这种相互作用也被认为是黄烷-3-醇类化合物在生物体内代谢的重要机制之一。葡萄籽提取物(含98%的黄烷-3-醇类化合物)能促进人粪便微生物体外发酵模型中乳酸杆菌生长,抑制肠球菌和溶组织梭菌生长,通过对葡萄籽提取物中黄烷-3-醇类化合物的代谢产物分析发现,与发酵前相比,变化最大的是酚酸类代谢产物,且主要发生在孵育10 h后,但是在该研究中没有明确发现微生物种群与母体化合物或微生物代谢物之间的相关性[24]。在其他的研究中鉴定出一些可以代谢黄烷-3-醇类化合物的肠道微生物,有研究者从转化表儿茶素的人粪便悬液中分离出2 种细菌菌株rK3和aK2,基于表型特征和16S rRNA基因序列,将其分别鉴定为Eggerthella lenta和Flavonifractor plautii。其中Eggerthella lentarK3可以还原性切割(-)-表儿茶素和(+)-儿茶素的杂环C环,生成1-(3’,4’-二羟基苯基)-3-(2’,4’,6’-三羟基苯基)丙烷-2-醇;而Flavonifractor plautiiaK2可以进一步将1-(3’,4’-二羟基苯基)-3-(2’,4’,6’-三羟基苯基)丙烷-2-醇转化为5-(3’,4’-二羟基苯基)-γ-戊内酯和4-羟基-5-(3’,4’-二羟基苯基)戊酸[25]。Stoupi等研究发现人粪便微生物Eubacterium oxidoreducens能够在黄烷-3-醇类化合物的A环中插入氧形成新的羟基,从而促进A环的打开[26],关于其他不同微生物介导的黄烷-3-醇单体的代谢见表1。此外,在体外发酵荔枝皮的过程中发现,添加饮食来源的嗜热链球菌和干酪乳杆菌能够代谢荔枝果皮中的A型原花青素,嗜热链球菌能够将原花青素A2转化为其异构体,而干酪乳杆菌可以分解原花青素A2,形成3-(3’,4’-二羟基)苯乙酸、4-羟基苯丙酸、间香豆酸和对香豆酸等[27]。

表1 不同微生物介导的黄烷-3-醇单体的代谢Table 1 Metabolism of flavan-3-ol monomer mediated by different microorganisms
2.2 代谢动力学
多年来,研究者主要是通过富含黄烷-3-醇类化合物的膳食干预来探究其代谢动力学。目前报道的膳食研究对象有茶类、可可、葡萄及葡萄制品、蔓越莓、苹果、杏仁以及富含黄烷-3-醇类化合物的食品补充剂。
摄入富含黄烷-3-醇类化合物的膳食后,代谢产物主要有3 种类型:母体化合物及其II-相代谢产物、5-碳开环代谢产物(主要为戊内酯类和戊酸类及其II-相代谢衍生物)、小分子的酚酸以及II-相代谢衍生物。后两类代谢物在血浆或尿液中的含量占主导。大鼠摄入红酒的黄烷-3-醇类化合物提取物后,血浆中检测到(-)-表儿茶素、原花青素B1和B2在1 h时浓度达峰值,分别为27、127、101 nmol/L;血浆中黄烷-3-醇单体浓度低于其二聚体浓度,可能是因为单体被II-相代谢酶迅速作用,产生了(表)儿茶素衍生物,如(表)儿茶素-5-葡萄糖醛酸、(表)儿茶素-7-葡萄糖醛酸、(表)儿茶素-3-甲氧基-5-葡萄糖醛酸、3’-甲氧基-(表)儿茶素-5-硫酸盐、3’-甲氧基-(表)儿茶素-5-葡萄糖醛酸等,上述化合物在血浆中的浓度也在摄入1 h达到峰值,这些(表)儿茶素衍生物浓度峰值的平均值之和高达5 393 nmol/L;5-碳开环代谢产物在摄入黄烷-3-醇类化合物后4~8 h在血浆中浓度达到峰值(1 306 nmol/L);而小分子的酚酸以及II-相代谢衍生物达到的浓度峰值高于5-碳开环代谢产物,约为4 700 nmol/L[34]。人体摄入100 g黑巧克力(含有79 mg表儿茶素、26 mg儿茶素和49 mg原花青素B2)后1~4 h,血浆中黄烷-3-醇类化合物相关的II-相代谢产物水平达到最大值,且主要以葡萄糖苷酸、硫酸盐和甲基衍生物的形式出现;而在血浆中检测到的一些开环代谢产物(2-(3’,4’-二羟基)-苯乙酸、2-(4’-羟基)-苯乙酸、2-(3’-羟基)苯乙酸、2-(3’-甲氧基-4’-羟基)-苯乙酸、马尿酸、羟基马尿酸、3-甲基没食子酸、苯甲酸和丁香酸等)主要是大肠中微生物作用的结果,而且这些代谢物在血浆中达到最大浓度的时间也较晚,通常在5~10 h左右[35]。志愿者摄入绿茶(主要成分为儿茶素)后,在其尿液和血浆中均检测到两种代谢物,分别被鉴定为(-)-5-(3’,4’,5’-三羟基苯基)-γ-戊内酯和(-)-5-(3’,4’-二羟基苯基)-γ-戊内酯,且这两种代谢产物在血浆中达到最大浓度的时间是在5~12 h,而胃和小肠基本排空的时间为5 h左右,因此相较于胃和小肠等部位对茶中儿茶素的吸收和代谢,处于消化道后端的大肠微生物作用可能对其在体内分解代谢具有更重要的意义。值得注意的是,这两种主要的代谢产物经尿液排泄时浓度达到峰值的时间相对于血浆浓度达到峰值时间有3 h左右的滞后,大约在摄入绿茶后7.5~13.5 h[36]。人食用可可粉后也有相似的情况,形成5-(3’,4’-二羟基苯基)-γ-戊内酯以及其他酚酸代谢产物,如3-(4’-羟基)苯丙酸、羟基苯甲酸、香草酸和2-(4’-羟基)苯乙酸等,这些代谢物在摄入6 h后在血浆中被检测到[37]。一项关于葡萄渣中黄烷醇-3-醇类化合物代谢动力学的研究发现,5-(3’4’-二羟基)-γ-戊内酯和其衍生物为最丰富的代谢产物,血浆中它们的最高浓度在268~1 171 nmol/L,其余的苯基-γ-戊内酯最高浓度均未超过100 nmol/L。大多数开环代谢产物(苯基-γ-戊内酯以及衍生物、苯基-γ-戊酸以及衍生物和小分子质量的酚酸等)在血浆中浓度达峰值时间约5~7 h,之后逐渐降低,24 h后血浆中浓度基本都低于100 nmol/L[38]。
此外,有研究指出实验对象的病理状态会影响到黄烷-3-醇类化合物的代谢,同样给予1 000 mg/kgmb葡萄籽黄烷-3-醇类提取物,相较于健康大鼠而言,具有代谢综合征的大鼠血浆黄烷-3-醇类化合物浓度达到峰值的时间延迟,且它们的II-相代谢物和微生物代谢物水平升高[39]。因此,黄烷-3-醇类化合物的代谢和生物利用度也依赖于机体的健康状态。
2.3 代谢途径
黄烷-3-醇单体在小肠中产生的代谢物主要是以(表)儿茶素-3’-O-葡萄糖醛酸、3’-O-甲基-(表)儿茶素-5-硫酸盐和(表)儿茶素-3’-硫酸盐的形式存在,部分母体化合物到达结肠后经历了肠道微生物群介导的生物转化,产生了5-碳环裂变代谢产物,如5-(羟苯基)-γ-戊内酯和5-(羟苯基)-γ-羟基戊酸[40]。
B型原花青素的代谢途径中,首先最为可能发生的是裂解分子结构单元间的黄烷键。原花青素B2与人类粪便菌群混合孵育12 h后,在培养基中检测到(+)-表儿茶素,证明了上述途径[26]。但是,该途径似乎较慢且分解代谢的原花青素B2不到10%;更主要的途径可能是原花青素在特定细菌的作用下,其上部结构单元发生A环裂解将直接形成小分子酚酸,其下部结构单元发生C环裂解或A环裂解以形成代谢物[41],转化为5-(3’,4’-二羟基苯基)-γ-戊内酯和/或4-羟基-5-(3’,4’-二羟基苯基)戊酸[41-42]。代谢产生的苯基戊内酯类化合物仍可在肠道菌群或者人体内酶的作用下被进一步代谢,其中,微生物代谢产物苯基戊内酯类的脱羟基作用发生在脂肪族侧链C4’位置处,它们被缓慢降解为苯基戊酸,再进一步通过α-氧化和β-氧化反应缩短苯基戊酸的侧链长度,从而产生苯丙酸、苯乙酸和苯甲酸及其衍生物[43-45](图2)。这一代谢途径被Sanchez等利用人粪便细菌孵育黄烷-3-醇类化合物的代谢研究证实,他们发现在孵育的前10 h产生了苯基戊内酯,在10~48 h更长的时间内,戊内酯类代谢物被进一步代谢(链缩短和脱羟基),这一过程在整个代谢过程中占据主要地位[46]。聚合度不同的黄烷-3-醇类化合物代谢速率也存在一定差异,肠道菌群体外代谢模型(猪盲肠微生物模型)代谢不同结构原花青素(B2、B5、C1),研究发现原花青素B5在2 h内有62%被分解,之后降解速率降低,在4 h内几乎完全消失;而原花青素B2也是在4 h内几乎完全降解;但在这4 h内,三聚体C1含量仅降低了约12%,而且在这次研究中4 h内没有检测到三聚体C1的降解产物,仅有少量三聚体C1与基质发生结合。很显然,微生物介导黄烷-3-醇类化合物代谢时,二聚体降解速率显著快于三聚体C1[47]。

图2 原花青素B2的代谢途径Fig. 2 Metabolic pathway of procyanidin B2
A型原花青素除了分子结构单元间的C4—C8或C4—C6连接键外,还具有更牢固的C2—O—C7或C2—O—C5共价键,这种结构使得其抵抗肠道微生物分解代谢的能力比B型原花青素强[48]。大鼠分别摄入等量原花青素A2(二聚体)和原花青素A3(三聚体),原花青素A2在两组大鼠尿液中的排出量分别为0.50 mol和0.88 mol,前者原花青素A2的排泄是原花青素A2部分吸收的结果,后者原花青素A2的排泄是由于原花青素A3三聚体降解,这也表明在C环打开之前,会存在二聚体和三聚体会被部分分解为单体[49]。借助猪盲肠模型研究原花青素A2和肉桂酸单宁B1(一种A型三聚体)的代谢时,相对于二聚体(原花青素A2)而言,A型三聚体多羟基代谢物更丰富,这可能是由于A型三聚体的分子质量更大,结构更复杂,其肠道微生物代谢机制也更复杂;但是两种A型原花青素代谢的共性是在降解过程中末端单元上的C环均会发生裂解,并进一步代谢生成羟基或二羟基苯甲酸、苯乙酸、苯丙酸酸和间苯三酚[50]。因此,A型原花青素的降解始于部分分解为单体和末端结构单元C环的裂解,随后进一步代谢形成各种酚酸。
2.4 代谢特征
大肠菌群代谢黄烷-3-醇类化合物的能力随着被代谢化合物分子质量的增大而降低。大鼠分别摄入黄烷-3-醇单体、二聚体、三聚体及多聚体后,对尿液中代谢产物进行分析发现,酚酸类代谢产物的产率依次降低,分别为10%、7%、0.7%和0.5%[51]。两组志愿者分别摄入等剂量的表儿茶素和原花青素低聚体,22%的表儿茶素转化成苯基-γ-戊内酯通过尿液途径排泄;而原花青素低聚体转化为苯基-γ-戊内酯的量非常有限,且前者(摄入儿茶素)苯基-γ-戊内酯通过尿液的排泄量是后者(摄入原花青素)的10 倍,由此可见黄烷-3-醇单体转化为苯基-γ-戊内酯的转化率高于原花青素低聚体[52]。
尽管A型和B型原花青素具有不同的化学结构,但是两种不同结构类型原花青素的代谢产物却有交叉和共性,例如(表)儿茶素、3-(3’,4’-二羟基)-苯丙酸、3-(3’,4’-二羟基)-苯乙酸、5-(3’,4’-二羟基苯基)-γ-戊酸以及5-(3’,4’-二羟基苯基)-γ-戊内酯。其中,代谢产物γ-苯基戊酸类和γ-苯基戊内酯类及其衍生物被认为是黄烷-3-醇类化合物在体内发挥生物活性的主要贡献者[53],这主要是因为摄入膳食来源的黄烷-3-醇类化合物后,这两者在循环系统和尿液中含量较高,如人体在摄入绿茶后,苯基戊内酯类代谢产物在尿液中的含量是(表)儿茶素II-相代谢产物的10 倍[36]。对比经常摄入可可(富含黄烷-3-醇类化合物)和不摄入可可的两类人群,发现前者血浆和尿液中的5-(3’,4’二羟基苯基)-γ-戊内酯及其硫酸盐衍生物、葡萄糖衍生物的含量显著高于后者[54]。志愿者食用专门制备的可可饮料(含黄烷-3-醇单体到十聚体),24 h内5-(3’,4’二羟基苯基)-γ-戊内酯经尿排泄量大约为93 μmol[55]。在人摄入葡萄渣中黄烷-3-醇类提取物(葡萄酒和果汁工业的主要副产品)后,发现在血浆中γ-苯基戊酸类和γ-苯基戊内酯类浓度可高达2 500 nmol/L,而(表)儿茶素及其衍生物的最高浓度仅能达到330 nmol/L,小分子的酚类及酚酸(苯甲酸、苯乙酸以及衍生物等)最高浓度约为1 600 nmol/L[37]。
此外,其他类黄酮(槲皮素、杨梅素、木犀草素、柚皮素和山柰酚鼠李糖苷)通过微生物分解代谢也可以产生[56],而苯基戊内酯仅能在摄入富含黄烷-3-醇类化合物的绿茶[57]、可可粉[52]和松树皮萃取物[57]等的受试者血浆中被检测到,即苯基戊内酯可能是黄烷-3-醇类化合物的典型代谢产物,其中5-(3’,4’-二羟基苯基)-γ-戊内酯被认为是主要的代谢产物之一。在一些粪便体外代谢模型和大鼠体内代谢的尿液中发现苯基戊内酯的浓度超过了游离的苯基戊酸和缺乏侧链羟基的酚酸浓度,这可能一方面是由于在代谢过程中黄烷-3-醇类化合物的环裂解产物——二苯基丙烷-2-醇衍生物可以直接代谢转化为苯基戊酸,进而形成各种小分子游离酚酸;另一方面,二苯基丙烷-2-醇衍生物需要先代谢为苯基戊内酯类,进而形成戊酸和一些缺乏侧链羟基的酚酸,并且在苯基戊内酯和苯基戊酸之间存在一定的相互转化[58]。但是对于这一现象仍需要进一步研究以确认原因,例如:苯基戊内酯是否是由侧链羟基自发形成的以及苯基戊内酯在血浆和大肠环境下水解的难易程度[59-60]。
黄烷-3-醇类化合物的肠道微生物代谢物是否仍然具有生物活性及活性发生变化的机制也同样值得探讨。原花青素A2经大鼠肠道(盲肠和结肠)的微生物体外孵育结果表明,其代谢产物的抗氧化能力显著高于原花青素A2。在体外孵育代谢6 h时,其代谢产物的总抗氧化活性、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)清除能力自由基和2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸阳离子自由基清除能力分别提高了2.01、2.16 倍和1.34 倍。并且最近的一项研究显示,采用体外粪便微生物共孵育培养24 h后,儿茶素和表儿茶素孵育体系抗氧化活性的增加与C环裂解代谢物的积累呈正相关,并且研究者对这一结果进一步验证,从孵育液中分离出了C环裂解代谢物(1-(3’,4’-二羟基苯基)-3-(2’,4’,6’-三羟基苯基)丙-2-醇),该代谢物的DPPH自由基清除能力显著提高(儿茶素的2 倍、表儿茶素的1.8 倍)[61]。因此代谢产物很可能在母体化合物生物活性作用过程中发挥重要作用[62]。此外,黄烷-3-醇类化合物的典型代谢产物——5-(3’,4’-二羟基苯基)-γ-戊内酯就体外抗氧化能力而言虽然低于其母体化合物之一的(+)-表儿茶素,但强于L-抗坏血酸[63]。Lee等的研究证实,5-(3’,4’-二羟基苯基)-γ-戊内酯是原花青素A1、A2、B1、B2和(+)-儿茶素、(-)-表儿茶素这6 种黄烷-3-醇类化合物的标志性代谢产物,且该化合物具有比其母体化合物以及母体化合物的其他代谢产物(3-(3’,4’-二羟基)苯丙酸和2-(3’,4’-二羟基)苯乙酸)更强的抑制THP-1(人类单核细胞)对人脐静脉内皮细胞黏附的作用,说明5-(3’,4’-二羟基苯基)-γ-戊内酯在预防动脉粥样硬化方面具有更高的潜力[64]。同时也有研究发现5-(3’,4’-二羟基)-γ-戊内酯和5-(3’-甲基-4’-羟基)-戊内酯比其母体儿茶素具有更强的抑制巨噬细胞中一氧化氮产生及炎症相关酶(基质金属蛋白酶)活性的作用[65-66]。(-)-儿茶素的15 种肠道代谢物中,(3’,4’,5’-三羟基苯基)-戊酸对宫颈癌细胞增殖具有最强的抑制作用,半抑制浓度为5.58 μmol/L,证实了儿茶素的肠道代谢产物对预防宫颈癌具有重要作用[67]。而且苯基-γ-戊内酯能够抑制由过氧化氢诱导的棕色脂肪细胞氧化应激并抵消炎症[68]。大鼠摄入冷冻干燥蓝莓(主要含有黄烷-3-醇类化合物)后,主要代谢产物是小分子酚酸,如马尿酸、3-(3’-羟基)苯乙酸、3-(3’羟基)苯甲酸、3-(3’-羟基)苯丙酸和3-(4’-羟基)苯丙酸等。并且这些酚酸代谢物的混合物能够抑制炎症细胞因子的产生和泡沫细胞的形成,这对于动脉粥样硬化具有潜在保护作用[69]。
3 黄烷-3-醇类化合物及其代谢产物的排泄
黄烷-3-醇类化合物代谢产物可随人体的粪便和尿液排出体外。尿液排泄前未被吸收的一部分黄烷-3-醇类化合物以及发生吸收和转化的一些代谢产物(包括部分母体化合物、小肠部分吸收产生的代谢物以及大肠菌群介导的代谢产物)均可通过门静脉到达肝脏并被吸收,其中一部分可通过II-相代谢酶的作用产生结合衍生物,随后随尿液排出;此外,粪便中主要含有未吸收的高分子质量母体化合物、代谢产物及其衍生物[70]。
尿液是黄烷-3-醇类化合物代谢产物的主要排出途径。大鼠摄入(分为静脉摄入组和经口摄入组,摄入剂量相同)14C标记的原花青素B2后,放射性物质排尽的时间为96 h,在这期间这两种不同摄入方式组尿液放射性物质含量都高于粪便,且最主要的排泄时间在24 h内;0~24 h时静脉注射组在尿液中的放射性物质占总摄入放射性物质剂量的68.7%,粪便中为24.6%;而经口摄入组上述指标在尿液和粪便中分别为58.3%和39.6%[7]。这些结果表明原花青素无论是经口摄入还是静脉摄入,形成的代谢产物大部分是经过肾脏代谢途径清除,小部分经肝脏进入胆汁,由胆汁流入肠腔,然后随粪便排出。大鼠摄食含有高粱麸皮(原花青素含量为23.3 mg/g)的饲料后,尿液中总酚酸排泄量为23 μmol/d,未摄入高粱麸皮的大鼠尿液中总酚酸的排泄量为0.8 μmol/d[71]。黄烷-3-醇类化合物代谢产物排泄的主要的形式之一是酚酸及其衍生物。Urpi-Sarda等研究发现,与未食用可可粉组相比,食用40 g富含黄烷-3-醇类化合物可可粉的受试者尿液中香豆酸、香草酸、3-羟基苯甲酸酸和阿魏酸含量均增加了2 倍以上[72]。同样,人食用80 g巧克力(含586 mg黄烷-3-醇类化合物)后,3-(3’-羟基)苯丙酸、2-(3’-羟基)苯乙酸、香草酸(4-羟基-3-甲氧基)苯甲酸和间羟基苯甲酸的尿排泄量增加[73]。大鼠在分别摄入黄烷-3-醇单体(含儿茶素16.4 mg和表儿茶素79.6 mg)和黄烷-3-醇二聚体(含原花青素B1 21.2 mg和原花青素B2 74.8 mg)后,两组尿液中均发现了大量酚酸及其II-相代谢产物[74]。
4 结 语
黄烷-3-醇类化合物是重要的膳食多酚,大量的研究证实其具有抗氧化、抗肿瘤、抗炎、防治心脑血管疾病等多种生理功能和药理活性,并被应用于医药、膳食补充剂、日化等产品中。黄烷-3-醇类化合物在体内的吸收、代谢途径,在体内循环系统中的分布、排泄以及在各器官中发挥生理活性的机制已经成为膳食多酚现阶段研究领域的热点。
到目前为止,关于黄烷-3-醇类化合物代谢产物的定性及部分定量工作已经取得很大的进展,同时在黄烷-3-醇类化合物的代谢机制与代谢途径方面也得到了越来越深刻的认识,研究者们将黄烷-3-醇类化合物的代谢归因于肠道菌群的作用。最为关键的是,黄烷-3-醇类化合物对于健康的益处可能更大程度上归因于它们的肠道微生物代谢产物,这意味着黄烷-3-醇类化合物在人体内发挥作用时不再仅局限于母体化合物,这些研究结果表明代谢产物可能会成为改善健康且不具有排斥性和副作用的精准目标物质。但是这些代谢产物发挥生理活性时剂量的确定以及验证这些代谢产物的活性仍有一定的困难,如获得的代谢产物经口摄入时是否会再次发生改变;其在发挥生理功能时的机制仍需进一步的研究和确认;某些目标代谢物的大量获得会面临一些挑战。
虽然肠道微生物在黄烷-3-醇类化合物的代谢过程中发挥的重要作用已被证实,但是这一过程中活跃的具体微生物(群)以及其对黄烷-3-醇类化合物代谢过程中的明确作用等仍然需要继续关注。接下来,还需清晰全面地探究这些相关微生物,进一步的研究可以通过一定方式有针对性地改善人体的肠道菌群来提高黄烷-3-醇类化合物在体内的生物利用度,或者可以在体外条件下精准培养这些发挥代谢作用的微生物来产生和富集目标代谢产物,这对于未来产品研发将大有益处。
