重组别藻蓝蛋白的超快能量传递过程
2021-09-09甄张赫朱锐丹秦松陈海龙蒲洋翁羽翔2李文军
甄张赫,朱锐丹,秦松,陈海龙,蒲洋,翁羽翔2,*,李文军*
( 1.中国科学院烟台海岸带研究所,山东 烟台 264003;2.中国科学院大学,北京 100049;3.中国科学院物理研究所 北京凝聚态物理国家研究中心/软物质物理重点实验室,北京 100190;4.中国科学院海洋大科学研究中心,山东 青岛 266071;5.鲁东大学 农学院,山东 烟台 264025)
1 引言
藻类进行光合作用的第1步是捕捉光能并将光能传递至光合反应中心,该过程是由藻类捕光蛋白完成的[1]。藻胆体是蓝藻和红藻中非常重要的捕光复合体,主要由杆结构和核结构两部分组成[2-3]。藻胆体的杆结构可以帮助藻类在水下的弱光环境高效地捕捉光能,而藻胆体的核结构可以将杆结构捕捉的光能以95%以上的效率传递至光合反应中心[4-5]。
别藻蓝蛋白(allophycocyanin,APC)三聚体是红、蓝藻藻胆体核结构的主要组成成分之一[6]。晶体结构揭示(图1),APC三聚体是由3个单体组成的厚约为3 nm,直径约为13 nm的圆盘状结构,中央存在1个直径约为3.5 nm的可插入连接蛋白的空腔[7-8]。APC三聚体每个单体包含1个α亚基和1个β亚基,每个α亚基和β亚基的Cys84位点都结合有1个藻蓝胆素(phycocyanobilin,PCB),这些 PCB 可以与氨基酸共同构成发色团,发色团参与了APC的捕光和能量传递[9]。
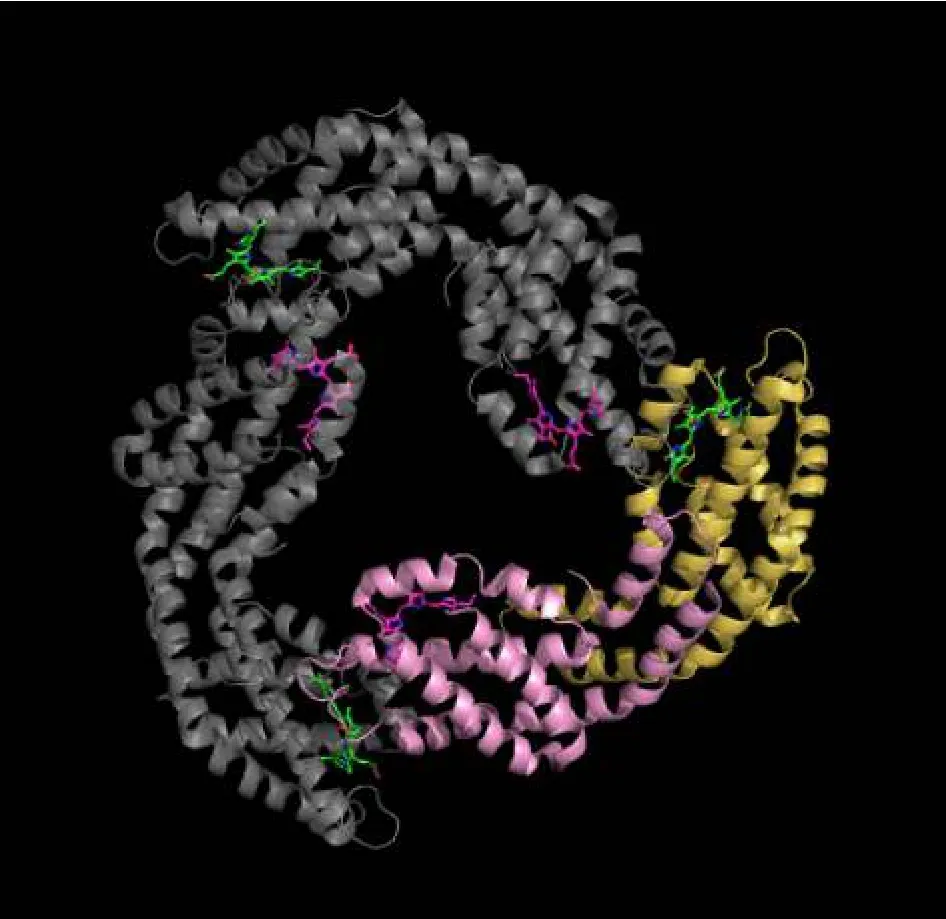
图1 别藻蓝蛋白三聚体晶体结构图Fig.1 Allophycocyanin trimer crystal structure
虽然APC三聚体只结合有6个PCB,但APC三聚体内部的能量传递却非常快速[10]。APC三聚体Cys84位点上的两个发色团结构与蓝藻的藻蓝蛋白(Cyanobacteria-phycocyanin,C-PC)三聚体 Cys84位点上的两个发色团的结构相似,但是APC三聚体电子弛豫的速度是C-PC的10倍[7,11]。APC三聚体的能量吸收光谱从620 nm传递到650 nm的时间约为200~600 fs[12-13]。这种快速的能量传递方式被认为与APC相邻单体之间的两个发色团(β84PCB,α84PCB)的强耦合相关。由于强耦合作用产生了电子态的能级分裂,导致激发态波函数在两个色素分子间离域,并加速了能量传递进程[9]。在其他文献报道的超快时间分辨光谱的动力学分析中,均拟合有10~30 fs的超短时间常数。通常认为,这可能反映了激子态上的弛豫时间[9]。并且,有研究发现[14],APC的初始各向异性明显大于0.4,这证明APC三聚体中存在着相干激发态的色素分子对。目前,有观点认为,在隐藻藻胆蛋白PE545以及PC645中存在的强耦合色素分子对导致了量子相干节拍的产生,且部分离域振动可使能量传递速率增强[15-16]。因此,别藻蓝蛋白中存在的强激子耦合可能也会引发相干能量转移,以加速并辅助APC的定向能量转移,这可能是藻胆体核心结构高效并快速转移能量的主要原因[14]。但是3种机制是如何相互配合的,一直以来是APC高效传能的研究热点和难点。
研究APC的高效光能传递规律,需要具备高纯度的APC亚基、单体和三聚体等,如果从蓝藻中制备,需要引入SDS、尿素或者极端pH作为蛋白质变性条件,这个过程虽然能获得部分单体或者亚基,但是获得的亚基、单体和三聚体等往往出现降解,产生混合物,如果加大变性条件,又会损伤APC的发色团空间结构,造成测试结果的不准确甚至错误。此外,目前一些报道所用的APC样品为商品化的冻干蛋白粉末,冻干、复溶等步骤都有可能对蛋白构象造成不易觉察的伤害,从而导致色基微环境发生变化。所以,APC自组装过程中,藻胆素分子的构象变化是否影响色素耦合状态,进一步改变藻胆素分子的能量状态一直是研究APC高效传能的瓶颈。
针对APC高效传能机制以及对APC自组装过程中藻胆素及传能关系的研究,本文以重组异源表达[17-18]的具有和天然APC一样结构特性和稳态光谱特性的重组别藻蓝蛋白(recombinant allophycocyanin,rAPC)单体和三聚体为实验材料[17,19-20],通过各种稳态和瞬态光谱技术对rAPC三聚体不同时间尺度的能量传递过程进行了检测,探究rAPC自组装过程中,藻胆素分子的构象变化,其产生的色素耦合状态是否会改变藻胆素分子的能量状态;探究重组rAPC自组装过程中,伴随结构和构象的变化,长距离的福斯特共振能量转移机制(föster resonance energy transfer,FRET)、短距离的激子耦合理论(dexter mechanism)以及空间离域的“相干态传能”3种机制是如何相互配合以实现APC的高效能量传递。这将为继续深入研究rAPC激发态的能量传递过程,揭示藻胆体核心高效快速的能量转移机制提供了数据基础。
2 材料与方法
2.1 样品准备及鉴定
将本实验室自构建的含有rAPC质粒的生物工程大肠杆菌接种于含卡那霉素(索莱宝,北京)(浓度:50 μg/mL)及壮观霉素(麦克林,上海)(浓度:50 μg/mL)的 LB(Luria-Bertani)培养基(索莱宝,北京)中,37℃振荡培养过夜,次日以1%接种量重新接种至LB培养基中(含抗性),37℃振荡培养至对数中期(OD600nm约为0.7)(OD为光吸收密度),然后加入IPTG(索莱宝,北京)(浓度:0.5 mmol/L),28℃ 过夜诱导表达。18 h后离心(12 000×g,2 min)收集菌体。此时,对诱导前后的菌体以荧光显微镜(Olympus BX51,日本)进行蓝光和绿光激发,并采集荧光发射图。其中质粒构建、蛋白表达及诱导的方法参考Liu等[17]的方法。
将菌体用20 mmol/L的缓冲盐缓冲液(pH:6.0)重悬(浓度:0.1 g/mL),以细胞超声破碎仪(功率:300 W)(新芝,宁波)破碎(破碎3 s,停止5 s)至重悬液均一。破碎后离心(10 000×g,30 min,4℃)并收集上清液。上清液用孔径为0.22 μm滤膜过滤后,通过重力法过Ni-IDA琼脂糖凝胶柱(康为世纪,中国北京)进行纯化。对纯化收集得到的rAPC通过30 kD超滤管(Millipore,美国)浓缩去咪唑,然后通过不连续蔗糖梯度密度(蔗糖密度依次为:0.3 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L、1.5 mol/L)继续进行纯化,离心力为 200 000×g,温度为 4℃,时间为 21 h。rAPC纯化方法参考Liu等[17]、李文军等[20]的方法。对收集的蓝色rAPC三聚体蛋白进行各种光谱检测,同时对蛋白进行SDS-PAGE蛋白胶鉴定。部分rAPC三聚体用于制备rAPC单体,参考Liu等[17]的方法,设置rAPC单体为宽带泵浦探测的对照组。
2.2 光谱特性测定
用Agilent Cary 60 紫外吸收光谱仪对rAPC进行250~800 nm的全波长扫描,用Agilent Cary Eclipse荧光光谱仪测定rAPC的荧光发射光谱,激发波长为620 nm。用Chirascan plus的圆二色光谱仪对rAPC三聚体进行180~260 nm的紫外区扫描以及250~750 nm的可见光区扫描,光径均为1 mm。
2.3 时间分辨光谱探测
为了探测rAPC的超快时间分辨传能过程,自行研制的非共线光参量放大器(NOPA)被用于进行宽带泵浦探测,NOPA装置具体参数参考Zhu等[21],王云鹏等[22]的方法。NOPA宽带脉冲覆盖范围为550~760 nm,该范围覆盖了rAPC的吸收范围。NOPA的脉冲宽度为11 fs,可用于检测大于11 fs的传能过程。其泵浦源是光谱中心为800 nm的35 fs掺钛蓝宝石脉冲激光放大器(Spitfire Ace; Spectra-Physics),重复频率为1 kHz。rAPC样品的最大吸光度OD值控制在0.3~0.4之间,样品厚度为1 mm。
3 结果和讨论
3.1 rAPC三聚体蛋白表达、纯化及成分鉴定
当rAPC在大肠杆菌中被诱导表达后,如图2a和图2b所示,菌体呈现绿色,这是rAPC的蓝色和大肠杆菌的黄色叠加色。收集诱导前和诱导后的菌体,发现诱导后的菌体受表达的rAPC的颜色影响呈天蓝色,诱导前的菌体依然是大肠杆菌原本的淡黄色。通过蓝光和绿光对菌体进行激发,结果如图2a所示,诱导前的菌体对蓝光和绿光均无反应。而诱导后的菌体在蓝光下无反应,但是在绿光下被激发出红色的荧光,红光的光谱区间位于625~740 nm[23],这符合APC三聚体可于660 nm处产生荧光发射的光谱特性[24],说明rAPC诱导表达成功。
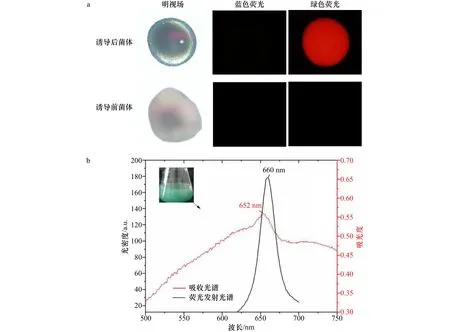
图2 诱导后菌体的稳态光谱及荧光性质变化Fig.2 Steady-state spectra and fluorescence properties of induced bacteria
以诱导前的菌体为基线,对诱导后的大肠杆菌进行全波段稳态吸收光谱扫描,如图2b所示,在652 nm处有明显的吸收峰,以600 nm为激发波长测量菌体的荧光发射光谱,最大荧光发射峰位于660 nm处。该结果符合rAPC三聚体的光谱特征[25],证明了rAPC在大肠杆菌中被成功的诱导表达且其表达的α亚基和β亚基已经成功组装成为三聚体。
通过不连续蔗糖密度梯度离心对rAPC进行纯化的结果如图3a所示。少量rAPC单体位于0.6 mol/L蔗糖分层处,多数的rAPC三聚体位于0.8 mol/L蔗糖分层处。rAPC三聚体呈天蓝色(图3b)。蔗糖密度分离结果说明,异源表达的rAPC多数可组装成为三聚体,但是可能由于其两个亚基的表达比例不平衡,或部分亚基组装有误导致部分单体不能成功组装成三聚体。吸取rAPC三聚体进行SDS-PAGE蛋白胶鉴定,结果证实rAPC三聚体α亚基和β亚基的分子量分别约为 21 kD 和 19 kD(图3c)[7,26]。

图3 rAPC三聚体纯化及亚基鉴定Fig.3 Purification and composition identification of rAPC trimer
3.2 rAPC三聚体稳态光谱特性
rAPC三聚体的稳态吸收光谱(图4a)显示,在可见光区650 nm处存在1个特征吸收峰,620 nm及590 nm处存在吸收肩峰,这与二阶导数显示的吸收峰趋势一致。而rAPC单体仅在620 nm处存在一个吸收峰。二阶导数吸收光谱确认吸收峰趋势与稳态吸收光谱一致(图4a)。其中,rAPC三聚体650 nm处的特征吸收峰与天然APC三聚体的吸收光谱一致[14,24,27]。有研究人员认为,APC三聚体中的β84PCB通过与周围氨基酸的相互作用而导致的吸收光谱红移至650 nm,而α84PCB则保留原有构象,吸收峰依旧为620 nm[28-31]。但也有少数观点认为,光谱红移是由于α84PCB的构象发生了变化[25]。但是考虑到β亚基进化上更为保守,关于β亚基构象变化的晶体学数据也更加充分,目前多数观点支持前者的结论,且认为在rAPC三聚体中能量遵循FRET,可以从α84PCB传递至β84PCB。除了FRET能量转移机制,也有观点认为,吸收峰红移至650 nm是由于激子耦合理论导致,也就是说是由于相邻单体之间的两个发色团之间的距离小于20 Å而发生的强耦合导致[32-33]。目前公认的观点是,在APC三聚体的能量传递过程中,FRET和激子耦合能量转移共同存在。值得注意的是,rAPC三聚体620 nm处的吸收肩峰,对比天然APC三聚体,该峰更明显一些。我们认为,这是由于在蛋白溶液中存在少量未组装成三聚体的单体或由三聚体解聚的游离单体导致。rAPC三聚体在590 nm处的吸收肩峰,虽在其他的数据中均也有被观测到,但对于它的解释较少。结合本实验及其他文章报道的圆二色(Circular Dichroism, CD)光谱数据(详见3.3节),我们认为,该处可能存在弱耦合的能量传递过程[12-13,20,34]。此外,在近紫外区340~370 nm附近还存在藻胆素的特征吸收峰[35-36]。

图4 rAPC单体和三聚体的稳态吸收光谱及荧光发射光谱Fig.4 Steady-state absorption spectra and fluorescence spectra of rAPC trimer
rAPC单体和三聚体的稳态荧光发射光谱显示(图4b),以600 nm激发rAPC单体,rAPC单体的最大荧光发射峰位于640 nm处,而rAPC三聚体的最大荧光发射峰位于663 nm(图4),这是APC三聚体的特征荧光发射峰,证明了rAPC三聚体组装成功,该结果与其他报道一致。在720 nm左右存在一个荧光发射肩峰,这被认为可能对应1 200 cm-1附近的电子振动耦合跃迁[13-14,16]。
3.3 rAPC三聚体圆二色光谱特性
对rAPC三聚体进行CD紫外区和可见光区的光谱探测,设定rAPC单体为对照组。紫外区可反映rAPC的二级结构的组装情况,可见光区则可反映rAPC色基微环境的变化[37]。
分析rAPC单体及三聚体CD的紫外区光谱(图5a),发现两者具有一样的光谱特性,均在209 nm和222 nm处表现出吸收特征,这说明rAPC单体组装成三聚体的过程不影响蛋白质的二级结构。在CD光谱中,209 nm和222 nm反映的是α螺旋结构,β折叠则反映在216 nm处[38-39]。因此,本实验结果揭示了rAPC主要以α螺旋结构为主,不存在β折叠结构。
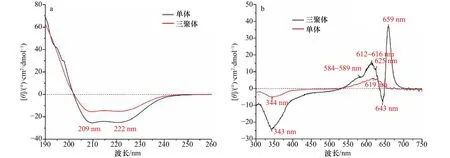
图5 rAPC单体和三聚体的CD光谱Fig.5 CD spectra of rAPC monomer and trimer
对rAPC单体和三聚体CD的可见光区光谱进行探测发现(图5b),rAPC单体CD可见光区的光谱仅显示了619 nm处的正峰以及344 nm处的负峰。相比而言,rAPC三聚体的CD可见光区光谱则显示出了更多的峰:659 nm和612~616 nm处存在两个正峰,643 nm和343 nm处存在两个负峰,正负峰交汇,出现了3个零点:648 nm、635 nm以及530 nm。此外,特别发现在584~589 nm和625 nm处存在波动的小肩峰。这证实了rAPC从单体组装成三聚体后色基微环境变得复杂。
在天然APC三聚体的CD光谱中,也存在659 nm处的正峰以及643 nm处的负峰,本实验结果与之相符,且其他报道已通过解叠法证明它们组成了一对正负峰[34,40-41]。多数观点认为,这两个峰的存在支持了650 nm处的生色团对由于偶极-偶极相互作用而导致激子分裂的观点,能量因此跃迁至659 nm以及643 nm波长处[41]。此外,343 nm处出现的负峰也较为明显,该峰对应于稳态吸收光谱340 nm范围内PCB的吸收峰。
需要特别分析的是,本实验中584~589 nm处和625 nm处为波动的小肩峰。而在其他APC三聚体CD光谱的报道中,589 nm处为负峰,625 nm处为正峰,且将CD光谱解叠后,这两个峰组成了正负峰对,有部分观点认为,这个正负峰对是APC三聚体中存在弱耦合色素对的证据[34,41]。然而,在本实验的结果中,625 nm处的正峰似乎蓝移至612~616 nm处,而589 nm处的负峰仅表现为一个小肩峰(图5b)。考虑到其他多种研究证明的APC三聚体CD光谱的复杂性[42-43],我们推测,这可能是由于不同实验中生色团所处的微环境的异质性导致的CD光谱存在差异,例如本实验溶液中存在的部分的游离单体(导致620 nm处的吸收肩峰更明显),可能导致弱耦合信号更加减弱。此外,结合吸收光谱,我们认为,589 nm处的CD光谱负峰可能与吸收光谱中590 nm处的吸收峰相对应,因此,590 nm处很可能有弱耦合发色团对相关的能量传递过程。综上,rAPC三聚体的CD光谱基本与天然APC三聚体的CD光谱结果一致。证明了rAPC三聚体中存在着强耦合的发色团对,且强耦合导致了激子分裂,该结果同时也是rAPC三聚体结构完整性及能量传递高效性的一个辅助证据。
3.4 rAPC三聚体能量传递的宽带泵浦探测分析
为了能够测量rAPC三聚体在百飞秒内的能量传递过程,本实验对rAPC三聚体进行了宽带泵浦探测实验,同时设定rAPC单体为对照组,脉冲覆盖范围及样品吸收光谱如图6所示。为了避免由于多光子吸收所引起的额外的超快非线性过程[44],在进行宽带泵浦探测之前,先对rAPC单体和三聚体分别进行激发能量依赖的宽带泵浦探测实验(图7)。分析动力学早期T等于100 fs时ΔOD值的变化,可以看到,无论是rAPC单体或三聚体,在激发能量密度小于40 μJ/cm2的激发条件下都随着激发能量密度呈线性变化。但特别的,当三聚体的能量密度超过70 μJ/cm2时,ΔOD不再是线性变化,有可能是出现了多光子吸收的过程[44],这将影响后续的光谱分析,因此实验所采用的激发能量密度均小于 40 μJ/cm2。
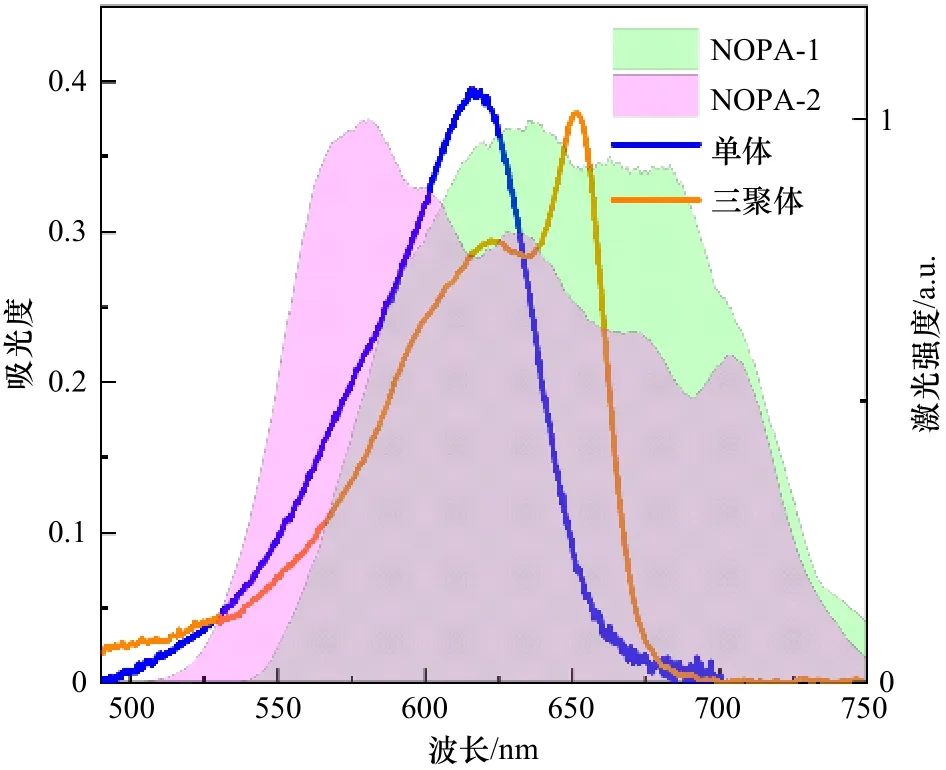
图6 NOPA脉冲覆盖范围及rAPC单体和三聚体稳态吸收光谱Fig.6 Coverage of NOPA pulse and steady-state absorption spectra of rAPC trimer

图7 rAPC单体及三聚体的激发能量依赖Fig.7 Excitation energy dependence of rAPC monomer and trimer
对宽带泵浦探测结果进行动力学拟合。在rAPC单体在620 nm处拟合出3个时间寿命常数,分别为(57±10) fs、(7.4±4.8) ps以及 400 ps;rAPC 三聚体在 620 nm处拟合出3个时间寿命常数,分别为(19±7) fs、(630±100) fs以及400 ps;在656 nm处拟合出两个时间寿命常数,分别为 (470±100) fs以及 400 ps(表1)。rAPC单体(57±10) fs和(7.4±4.8) ps两个寿命常数被认为对应于单体的快速溶剂化过程,这与8a图中单体由于溶剂化而光谱红移并伴随动力学衰减的结果相一致[45-46]。而 rAPC 三聚体 (19±7) fs以及 (630±100) fs两个时间常数被认为对应于三聚体的能量传递过程,将在后面做细致的讨论。其中最后一个寿命(400 ps)为固定的寿命参数,因为超出了实验所采集的时间范围(100 ps)。

表1 rAPC单体和三聚体瞬态吸收动力学拟合常数Table 1 The fitting constants of rAPC trimer transient absorption dynamics
19 fs的超短时间常数与其他文献中报道的10~60 fs的时间常数相一致,这样短的传能时间通常被认为与相干过程有关,该时间常数在其他报道中被指认为是两个PCB分子组成的激子对的电子退相干时间[12-14,27]。考虑到本次实验的脉冲宽度为11 fs,检测到19 fs的电子退相干时间是有可能的[47]。但是该时间常数所代表的具体相干过程目前还没有研究进行细致的报道,关于相干传能过程的具体研究还需要后续借助于高分辨率的二维时间分辨光谱技术来完成[48]。470~630 fs的时间常数我们认为是能量在620 nm和656 nm这两个吸收峰代表的色素之间无辐射衰减的过程。这与宽带泵浦探测的其他动力学分析结果相一致。如图8b所示,对比rAPC单体(图8a),600 fs内rAPC三聚体在656 nm处表现了显著的能量增长,而在620 nm处表现出能量弛豫(图8b),这证实了三聚体中能量从620 nm向650 nm传递的过程。
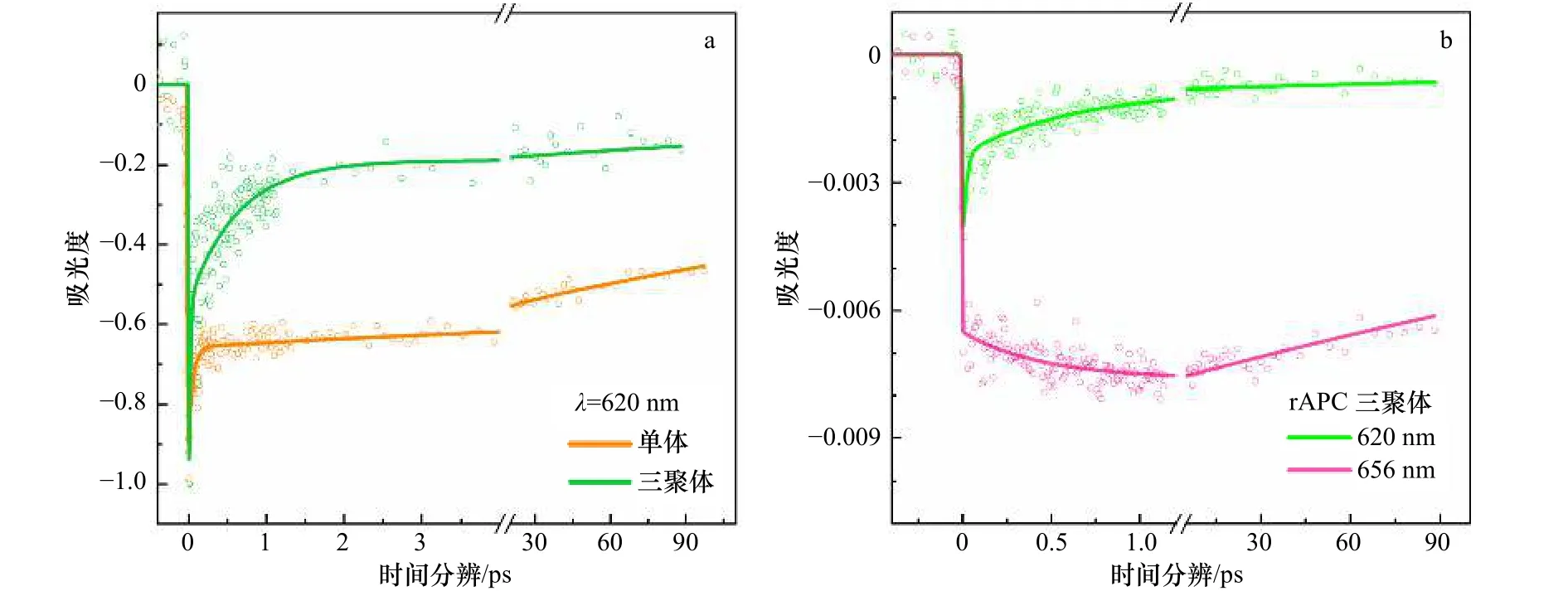
图8 rAPC三聚体及单体的瞬态探测Fig.8 Transients detected of rAPC trimer and monomer
截取不同时间分辨率下的宽带泵浦探测光谱进行动力学分析(图9b),其中光谱中的负峰表示基态漂白和受激发射的信号贡献,而正峰表示激发态吸收过程。在T等于104 fs时的光谱中明显的干涉信号是由于样品对激发光的散射造成的。结果显示,rAPC三聚体在0~600 fs的过程中,618~625 nm范围内的负峰逐渐减弱,这反映了能量从620 nm传递至650 nm的过程几乎在600 fs以内完成。但与其他报道不同的是,在本实验中655~658 nm处的信号基本保持不变,而不是信号显著增长。这是因为在其他报道中泵浦探测用的是窄带激发脉冲,因此650 nm处的信号仅反映了由620 nm传递过去的能量[27]。而本实验采用的宽带脉冲可以直接激发650 nm。对比rAPC单体的瞬态光谱变化(图9a),发现rAPC单体625.5 nm处的负峰红移至633 nm,该红移过程被认为是由于溶剂化过程导致[49]。但红移现象在三聚体中并不明显(仅红移3 nm),这可能是由于三聚体中色基之间存在强耦合使溶剂化过程减弱。
rAPC三聚体不同时间下瞬态光谱结果显示了三聚体的整体传能过程(图9b),激发0 fs后的瞬态光谱形状对比稳态光谱基本没有改变:在650 nm左右处有锐利的特征吸收峰,并伴随着较弱的590 nm和较强的620 nm的肩峰信号(图9b)以及680 nm处的正峰信号。655~658 nm处锐利的峰形符合强激子耦合的光谱特征。在590~600 nm范围内,始终存在的负吸收信号与吸收光谱结果一致。结合吸收光谱的结果分析,我们认为,此处可能存在弱耦合的色素对。但由于宽带泵浦探测光谱的动力学分析并没有与此相关的动力学过程,且600 fs内,600 nm左右的泵浦探测光谱波动较大,因此无法确定传能过程。但考虑到该峰并不存在于rAPC单体中(图9a),590~600 nm范围内的负峰被认为可能与三聚体的能量传递有关。此外,rAPC三聚体的泵浦探测光谱显示,稳定存在着一个680 nm的正信号,该信号在rAPC单体的宽带泵浦探测光谱中也一直存在。已有其他文献报道[27],该信号对应于第一激发态往更高的电子激发态跃迁所产生的激发态吸收过程。另外,在三聚体中还可能包含了激子耦合所产生的双激子态所造成的激发态吸收过程。
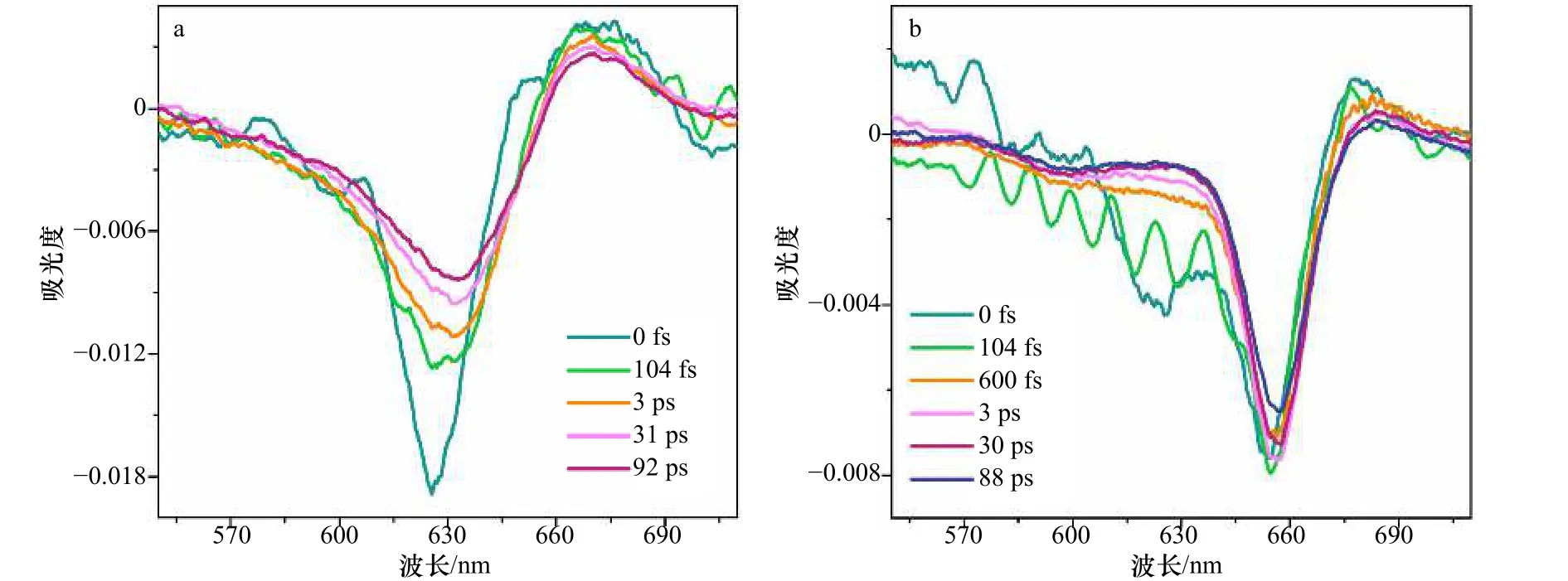
图9 rAPC单体及三聚体不同时间下的瞬态光谱变化Fig.9 Energy transfer dynamics of rAPC monomer and trimer at several delay times
4 结论
本实验对rAPC三聚体在室温下进行了多种光谱探测,并设立rAPC单体为对照组,这些光谱在不同的光谱分辨率下反映了rAPC三聚体的传能过程。
其中,稳态光谱结果证明,rAPC三聚体具有和天然APC一样的光谱特性,这些特性由三聚体独特的蛋白结构导致的独特的生色团微环境决定,因此,光谱特性一定程度上反映了rAPC三聚体的蛋白结构。而CD光谱证明了rAPC单体组装成rAPC三聚体时,并不改变蛋白质的二级结构,但是会影响发色团的微环境。同时CD光谱证实了650 nm处激发态的激子分裂情况,这是证明rAPC三聚体发色团及蛋白结构特性的另一有力证据。但是由于环境异质性,在CD光谱中我们并没有看到弱耦合对的存在。
宽带泵浦探测光谱的动力学结果证实了rAPC三聚体中存在300~600 fs时间尺度的620~650 nm的传能过程,且该过程不存在于rAPC单体中。这证明了rAPC三聚体的结构完整性,且传能过程与天然APC一致。此外,我们还测到了19 fs的超短寿命常数,这和其他研究报道的可能的激子态的电子退相干时间基本一致。值得注意的是,590 nm处的激发态在传能动力学过程中也一直存在。然而,该激发态的来源和去向我们并不能清晰的判断,但在后续的实验中,我们将利用二维电子光谱等技术,继续深入研究该激发态与弱耦合色素对相关的能量传递之间的关系。
本实验通过结合多种光谱学手段,对rAPC的能量传递过程进行了探测,这为阐明APC传能的本质,揭示藻胆体的高效能量传递机制提供了数据基础。
