板栗壳黄酮结构分析及其对胰脂肪酶活力的抑制作用
2021-12-02黄雪薇雷嗣超谢辰阳
黄雪薇,雷嗣超,涂 芬,谢辰阳,李 杰,杨 芳,2,3,*
(1.武汉工程大学环境生态与生物工程学院,湖北 武汉 430205;2.武汉工程大学 绿色化工过程教育部重点实验室,湖北 武汉 430205;3.武汉工程大学 新型反应器与绿色化学工艺湖北省重点实验室,湖北 武汉 430205)
肥胖和超重会引发各种慢性疾病[1],其中最常见的慢性疾病包括高血压、心血管疾病以及糖尿病[2],严重影响人体的健康。胰脂肪酶(pancreatic lipase,PL)作为人体肠道内的关键酶,可催化食物中摄入的大部分脂肪水解成甘油和脂肪酸[3],利用胰脂肪酶抑制剂抑制其活力可有效减少人体对脂肪的吸收[4],达到控制和预防肥胖及超重引发慢性疾病的目的。目前,临床上使用最广泛的胰脂肪酶抑制剂为奥利司他[5],但患者服用后会产生腹泻、胀气、脂肪性大便等副作用[6]。因此,从低毒性、来源广泛的植物中提取胰脂肪酶抑制剂成为目前的研究热点[7]。黄酮类化合物具有抗氧化[8]、抗病毒[9]、抗炎[10]、抗血管舒张等活性[11-12],研究表明,板栗壳中含有大量的黄酮类化合物[13],其降脂减肥的机理鲜见报道。本实验以野生板栗壳为原料,提取板栗壳黄酮,并结合超高效液相色谱(ultra-performance liquid chromatography,UPLC)-四极杆/静电场轨道阱质谱(quadrupole/electrostatic field orbitrap mass spectrometry,Q-Orbitrap MS)[14]对提取得到的板栗壳黄酮进行结构鉴定和组成分析,并且研究其在不同条件下对胰脂肪酶活力的影响及其对胰脂肪酶的抑制特性,为进一步将板栗壳黄酮开发为预防和抑制肥胖的功能因子提供理论依据。
1 材料与方法
1.1 材料与试剂
野生板栗采摘于山东省沂蒙山,采摘时间为2020年9月;芦丁标准品(纯度98%)、甲醇(色谱纯)、乙腈(色谱纯)、乙醇(色谱纯)、对硝基苯丁酸酯(p-nitrophenyl butyrate,PNPP)(分析纯)、Triton X-100(分析纯)、硝酸铝九水合物(分析纯)、亚硝酸钠(分析纯)、0.22 μm滤膜 上海麦克林生化科技有限公司;对硝基苯酚(p-nitrophenol,PNP)(分析纯)、牛胰腺胰脂肪酶、N,N-二甲基甲酰胺(生物技术级)、二甲基亚砜(分析纯) 上海阿拉丁生化科技股份有限公司;氢氧化钠(分析纯) 郑州派尼化学试剂厂;AB-8型大孔吸附树脂 北京索莱宝科技有限公司;奥利司他胶囊 山东新时代药业有限公司。
1.2 仪器与设备
FW80型高速万能粉碎机 天津泰斯特仪器有限公司;DZKW-D-2型电热恒温水浴锅 北京永光明医疗仪器有限公司;THZ-100型恒温培养摇床 上海一恒科学仪器有限公司;RE-2000A型旋转蒸发器 上海亚荣生化仪器厂;TG16-WS型台式高速离心机 武汉志海科技有限公司;层析柱(φ1.6 cm×50 cm)、HL-2型恒流泵、HD-3型紫外检测仪、BSZ-100型自动部份收集器上海沪西分析仪器厂有限公司;UV-1800PC型紫外-可见分光光度计 上海翱艺仪器有限公司;LGJ-10普通实验型真空冷冻干燥机 北京松源华兴科技发展有限公司;Q-Exactive型Q-Orbitrap MS仪、Hypersil GOLD C18型色谱柱 美国赛默飞世尔科技有限公司;Ultimate 3000型UPLC仪 美国Dionex公司。
1.3 方法
1.3.1 板栗壳黄酮的提取与纯化
醇提取法:按照本实验室前期建立的板栗壳黄酮提取工艺,将板栗壳去杂、洗净、烘干并粉碎,过20 目筛,按料液比1∶15(板栗壳粉末与70%的乙醇溶液),置于恒温培养摇床中,55 ℃恒温振荡提取90 min,冷却后真空抽滤并于40 ℃旋转蒸发,再冷冻干燥即得板栗壳黄酮粗提物冻干粉。
纯化:取0.5 g板栗壳黄酮冻干粉,用蒸馏水溶解配制质量浓度为10 mg/mL,真空抽滤后过AB-8大孔树脂层析柱[15],用体积分数70%的乙醇溶液进行洗脱,将洗脱液收集后再次旋蒸、冻干,得到纯化后的板栗壳黄酮粉末,低温保存,备用。
1.3.2 板栗壳黄酮含量和提取得率的测定
采用分光光度计法[16]测定提取物中的总黄酮含量。芦丁标准曲线的绘制:称取芦丁标准品0.01 g,用体积分数70%乙醇溶液定容至50 mL,配制成质量浓度为0.20 mg/mL的母液。分别吸取母液0、0.5、1.0、1.5、2.0、2.5、3.0 mL及3.5 mL于10 mL具塞比色管中,用体积分数70%乙醇溶液补充至5 mL,加入质量分数5%的亚硝酸钠溶液0.30 mL并放置6 min,加入质量分数10%的硝酸铝溶液0.30 mL,并摇匀静置6 min,再加入质量分数4%的氢氧化钠溶液4.00 mL,用体积分数70%乙醇溶液补充至10 mL,静置15 min,于510 nm波长处测定吸光度,以芦丁质量浓度为横坐标,对应吸光度为纵坐标绘制标准曲线,得到回归方程为y=11.54x-0.093 1,R2=0.999 4。
板栗壳黄酮中总黄酮含量的测定:称取0.01 g板栗壳黄酮冻干粉,用体积分数70%乙醇溶液定容至50 mL,配制成质量浓度为0.20 mg/mL的板栗壳黄酮溶液,吸取2.00 mL于10 mL具塞比色管中,按上述方法测定510 nm波长处吸光度,代入芦丁标准曲线即得板栗壳黄酮溶液中总黄酮质量浓度。按式(1)计算黄酮含量,按式(2)计算板栗壳黄酮提取得率。

式中:ρ为代入芦丁标准曲线计算出的板栗壳黄酮溶液总黄酮质量浓度/(mg/mL);V为待测样品溶液的体积/mL;m为称取的板栗壳黄酮冻干粉的质量/g;n1为板栗壳黄酮冻干粉到测定样品的稀释倍数。
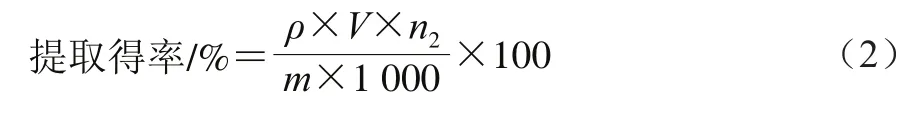
式中:ρ为代入芦丁标准曲线计算出的板栗壳黄酮溶液中总黄酮质量浓度/(mg/mL);V为待测样品溶液的体积/mL;m为板栗壳的质量/g;n2为1.3.1节总板栗壳质量到测定样品的稀释倍数。
1.3.3 板栗壳黄酮结构分析
样品溶液制备:称取1.3.1节中纯化后的板栗壳黄酮冻干粉末0.10 g,用体积分数70%甲醇溶液溶解并定容至100 mL,经0.22 μm滤膜过滤后备用。
色谱条件:使用Ultimate 3000型UPLC(配有Hypersil GOLD C18色谱柱(4.6 mm×150 mm,5 μm))对板栗壳黄酮类化合物进行分离[17],色谱柱温度35 ℃,样品盘温度5 ℃,在进样前后,用200 μL体积分数70%甲醇溶液洗涤自动进样器,洗涤2 次;液相流动相:A相乙腈,B相体积分数0.1%甲醇溶液,进样体积5 μL,流速0.4 mL/min;梯度洗脱:0~5 min,A:15%~50%,B:85%~50%;5~25 min,A:50%~95%,B:50%~5%;25~30 min,A:95%~5%,B:5%~95%;30~50 min,A:5%~95%,B:95%~5%。
质谱条件:使用Q-Orbitrap MS仪对板栗壳黄酮进行分析。质谱分析条件[18-19]:离子源为电喷雾电离源(electrospray ionization,ESI),负离子扫描,电压-3 kV;一级质谱分辨率设置为RP=70 000、m/z200;二级质谱分辨率设置为35 000,m/z200;电探头蒸发器温度350 ℃;扫描质量为m/z100~1 000;MS1阱填充时间为250 ms,自动增益控制设置为1 000 000;MS2阱填充时间设置为120 ms,自动增益控制设置为200 000;标准化碰撞能量25 eV,阶梯能量设置为40%;根据MS1的离子强度,进行MS1-MS2的切换。
1.3.4 胰脂肪酶活力的测定
参考王远等[20]的方法绘制PNP标准曲线。称取0.07 g PNP用磷酸缓冲液(0.20 mol/L、pH 7.4,下同)溶解并定容至100 mL,配制成浓度为5 mmol/L的母液,分别吸取0、0.02、0.04、0.06、0.08、0.10、0.12、0.14 mL于10 mL具塞比色管中,补加磷酸缓冲液稀释成0、0.01、0.02、0.03、0.04、0.05、0.06、0.07 mmol/L的PNP溶液,于405 nm波长处测定吸光度,以PNP浓度为横坐标,对应吸光度为纵坐标绘制标准曲线,得到回归方程为y=11.268x+0.006 4,R2=0.999 7。
胰脂肪酶活力的测定参照Mcdougall等[21]报道的方法并加以改进。称取0.10 g胰脂肪酶,用磷酸缓冲液定容至50 mL,8 000 r/min离心10 min,取上清液,得到2 mg/mL的胰脂肪酶液母液;吸取131.09 μL PNPP溶解于0.25 mLN,N-二甲基甲酰胺,用磷酸缓冲液定容至100 mL,加Triton X-100 25 滴,即得11.2 mmol/L的PNPP溶液(底物溶液);取胰脂肪酶液2 mL于10 mL具塞比色管中,加入4 mL磷酸缓冲液,37 ℃保温10 min后,加入2 mL底物溶液,于水浴锅中37 ℃避光反应20 min后,于405 nm波长处测定吸光度。代入PNP标准曲线即得胰脂肪酶催化底物产生的PNP浓度。胰脂肪酶活力的计算如公式(3)所示,37 ℃下保温10 min,以每分钟内催化底物产生1 μmol PNP定义为1 个胰脂肪酶活力单位(U)。
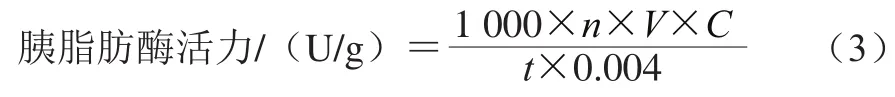
式中:n为稀释倍数;V为待测样品溶液的体积/mL;c为代入PNP标准曲线计算得出的PNP浓度/(mmol/L);t为反应时间/min;0.004为反应体系中胰脂肪酶的质量/g。
1.3.5 不同反应条件下板栗壳黄酮对胰脂肪酶活力影响的测定
1.3.5.1 不同浓度的板栗壳黄酮下胰脂肪酶活力的测定
称取0.02 g板栗壳黄酮冻干粉,用磷酸缓冲液定容至20 mL,即得1.00 mg/mL板栗壳黄酮溶液;称取奥利司他粉末,用少量二甲基亚砜溶解,加磷酸缓冲液水浴加热配制成20 mL 1.00 mg/mL奥利司他溶液。将板栗壳黄酮溶液、奥利司他用磷酸缓冲液分别稀释为0.10、0.20、0.50、0.80、1.00 mg/mL得到不同质量浓度的抑制剂溶液。按照1.3.4节方法,在各反应体系中加入0.50 mL抑制剂溶液,在pH 7.4、37 ℃下避光反应20 min后,于405 nm波长处测定吸光度,按式(4)计算胰脂肪酶活力抑制率。

式中:A1为不加抑制剂反应体系的吸光度;A2为加入抑制剂反应体系的吸光度。
1.3.5.2 不同pH值下胰脂肪酶活力的测定
按1.3.5.1节方法,在各反应体系中加入1.00 mg/mL板栗壳黄酮溶液0.50 mL即为实验组;在各反应体系中加入0.50 mL磷酸缓冲液即为空白组。将空白组和实验组各体系在温度为37 ℃,pH值分别为6.8、7.1、7.4、7.7、8.0条件下反应20 min,于405 nm波长处测定吸光度,计算胰脂肪酶活力抑制率。
1.3.5.3 不同反应温度下胰脂肪酶活力的测定
按1.3.5.1节方法,在各反应体系中加入1.00 mg/mL 0.50 mL板栗壳黄酮溶液即为实验组;在各反应体系中加入0.50 mL磷酸缓冲液即为空白组。将空白组和实验组各体系在pH值为7.4,温度分别为30、33、37、40、43 ℃条件下反应20 min,于405 nm波长处测定吸光度,计算胰脂肪酶活力抑制率。
1.3.5.4 不同反应时间下胰脂肪酶活力的测定
按1.3.5.1节方法,在各反应体系中加入0.50 mL 1.00 mg/mL板栗壳黄酮溶液即为实验组;在各反应体系中加入0.50 mL磷酸缓冲液即为空白组。将空白组和实验组各体系在pH 7.4、37 ℃条件下分别反应10、15、20、25 min及30 min,于405 nm波长处测定吸光度,计算抑制率。
1.3.6 抑制作用类型的测定
固定酶质量浓度为0.67 mg/mL,测定不同质量浓度板栗壳黄酮(0、0.5、1 mg/mL)在不同底物浓度(0.93、1.87、2.80、3.73 mmol/L)条件下的反应速率。取胰脂肪酶液2 mL于10 mL具塞比色管中,加入0.50 mL抑制剂溶液,补加磷酸缓冲液至6 mL,37 ℃保温10 min后,加入2 mL底物溶液,每分钟测量一次405 nm波长处的吸光度,测量总时长20 min,按Lineweaver-Burk双倒数作图法[22],以底物浓度的倒数(1/[S])为横坐标,反应速率的倒数(1/V)为纵坐标,绘制双倒数曲线图。
1.4 数据处理与分析
所有数据均为3 组平行实验数据取平均值得到;采用Origin Pro 9软件进行数据处理;采用SPSS 19.0软件中的t检验进行显著性分析,P<0.05表示组间差异显著。
2 结果与分析
2.1 板栗壳黄酮的提取得率和含量
采用醇提法,将提取得到的样品经AB-8树脂纯化得到板栗壳黄酮提取物,经计算,板栗壳黄酮提取得率为(5.66±0.05)%,其含量为(107.50±1.00)mg/g。可用于后续结构分析及胰脂肪酶抑制活性研究。
2.2 板栗壳黄酮结构分析结果
板栗壳黄酮总离子流图如图1所示。结合高分辨质谱信息和相关研究结果[23-28],本研究共鉴定出9 种酚类化合物,其中8 种属于黄酮类化合物,具体分析如下。
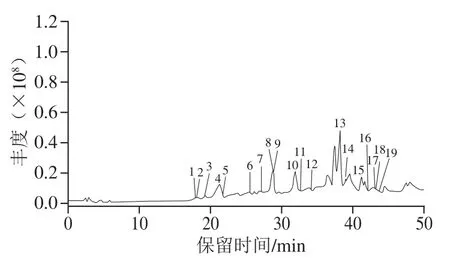
图1 板栗壳黄酮的总离子流图Fig. 1 Total ion current chromatogram of flavonoids from chestnut shells
由图1、表1可知,当保留时间为17.7、26.8 min时,1、7号峰分子离子峰m/z577,可确定化合物1、7的相对分子质量为678,二级质谱峰为m/z425、289、451、407[23]。B型原花青素二聚体是2 个原花青素单体通过C4—C8或C4—C6相连并在C2和C7或者C2和C5之间形成C—O—C键的化合物,在ESI-模式下失去一个氢原子得到m/z578,以m/z578为母体离子进行碰撞诱导分离,主要的裂解碎片离子为m/z289、407、425、451,可鉴定该物质为B型原花青素二聚体[24]。m/z289为QM cleavage分子间断裂失去1 个聚合单元(儿茶素或表儿茶素)得到;m/z407是分子离子先发生逆狄尔斯-阿尔德反应,再失去一分子H2O得到;m/z425则由分子离子发生逆狄尔斯-阿尔德反应得到;m/z451是由分子离子发生杂环裂变反应失去间苯三酚得到;m/z578分子离子失去一分子水得到m/z560。
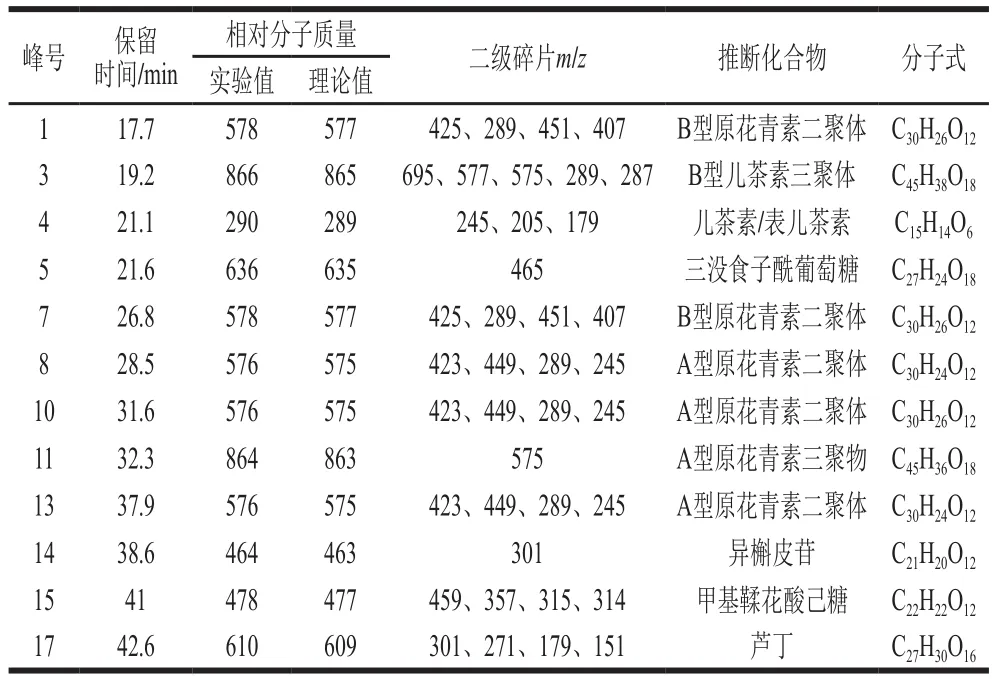
表1 板栗壳黄酮结构分析鉴定结果Table 1 Structural identification and analysis of flavonoids from chestnut shells
当保留时间为19.2 min时,3号峰分子离子峰m/z865可确定化合物3的相对分子质量为866,二级质谱得到的碎片离子峰m/z695、577、575、289、287,可知为B型儿茶素三聚物[25]。
当保留时间为21.1 min时,4号峰分子离子峰m/z289,可确定化合物4的相对分子质量为290,二级质谱得到的碎片离子峰为m/z245、205、179,与参考文献[25]中m/z245.14、205.22、179.26的结果一致,因此可鉴定此化合物为表儿茶素。
当保留时间为21.6 min时,5号峰分子离子峰m/z635可确定化合物5的相对分子质量为636,二级质谱得到的碎片离子峰m/z465,章丽等[26]的报道,可进一步推断此化合物为三没食子酰葡萄糖。
当保留时间为28.5、31.6、37.9 min时,8、10、13号峰分子离子峰m/z575,可确定化合物8、10、13的相对分子质量为576,A型原花青素二聚体是2 个原花青素单体通过C4—C8或C4—C6相连并在C2和C7或者C2和C5之间形成C—O—C键的化合物,在ESI-模式下失去一个氢得到m/z576,以m/z576为母体离子进行碰撞诱导分离,主要的裂解碎片离子为m/z289、407、423、449、539、557。且因为A型原花青素二聚体比相应的B型原花青素二聚体在结构上多1 个C—O—C连接键,分子离子少两个质子,相较于1号化合物,此化合物为A型原花青素二聚体。
当保留时间为32.3 min时,11号峰分子离子峰m/z863,可确定化合物11的相对分子质量为864,与董丽红[25]报道的结果一致,可判断此化合物为A型原花青素三聚体。
当保留时间为38.6 min时,14号峰分子离子峰m/z463,可确定化合物14的相对分子质量为464,与文献[27]中异槲皮苷的相对分子质量一致,二级质谱得到的碎片离子峰m/z301,推测该化合物为异槲皮苷(槲皮素-3-O-葡萄糖苷),分子离子碎片m/z463失去m/z162的葡萄糖基生成槲皮素苷元(m/z301),由此可知,14号峰化合物中存在葡萄糖基,且裂解规律符合异槲皮苷的特点。
当保留时间为41 min时,15号峰分子离子峰m/z477可确定化合物15的相对分子质量为478,二级质谱得到的碎片离子峰m/z459、357、315、314符合甲基鞣花酸己糖的裂解规律。
当保留时间为42.6 min时,17号峰分子离子峰m/z609,可确定化合物17的相对分子质量为610,二级质谱得到的碎片离子峰m/z301、271、179、151,与文献[28]中报道芦丁相对分子质量一致,在二级质谱图中,分子离子碎片m/z609失去质量数为308的葡萄糖基碎片生成苷元槲皮素碎片m/z301,m/z301分子离子碎片1、2处断裂转移两个氢,失去质量数为122的中性碎片生成m/z179的离子;m/z301分子离子碎片发生逆狄尔斯-阿尔德反应生成m/z151的离子,故可判断化合物17为芦丁。
2.3 不同反应条件下板栗壳黄酮对胰脂肪酶活力的影响
2.3.1 不同质量浓度的板栗壳黄酮对胰脂肪酶活力抑制率的影响
采用对硝基苯酚法测定胰脂肪酶活力,在405 nm波长处测得待测样品吸光度,由标准曲线计算得胰脂肪酶催化PNPP产生的PNP浓度为48.46 mmol/mL,经计算得胰脂肪酶活力为0.019 4 U。
以奥利司他为阳性对照,研究板栗壳黄酮对胰脂肪酶的抑制作用。由图2可知,在0~0.062 5 mg/mL范围内,板栗壳黄酮对胰脂肪酶的抑制效果明显弱于阳性对照奥利司他对胰脂肪酶的抑制效果,而在较高质量浓度0.062 5~0.125 mg/mL范围内,板栗壳黄酮对胰脂肪酶的抑制效果逐渐接近奥利司他对胰脂肪酶的抑制效果,当板栗壳黄酮质量浓度高于0.062 5 mg/mL时,抑制效果趋于平缓,说明在此质量浓度时,板栗壳黄酮与胰脂肪酶的结合达到饱和。根据实验数据进行拟合得到板栗壳黄酮及奥利司他对胰脂肪酶的半抑制浓度(half maximal inhibitory concentration,IC50)分别为0.074 mg/mL和0.064 mg/mL。由此可知,在0.012 5~0.125 0 mg/mL范围内,板栗壳黄酮对胰脂肪酶的抑制率与抑制剂浓度存在剂量效应关系,与相同剂量的阳性对照奥利司他对胰脂肪酶的抑制率接近。
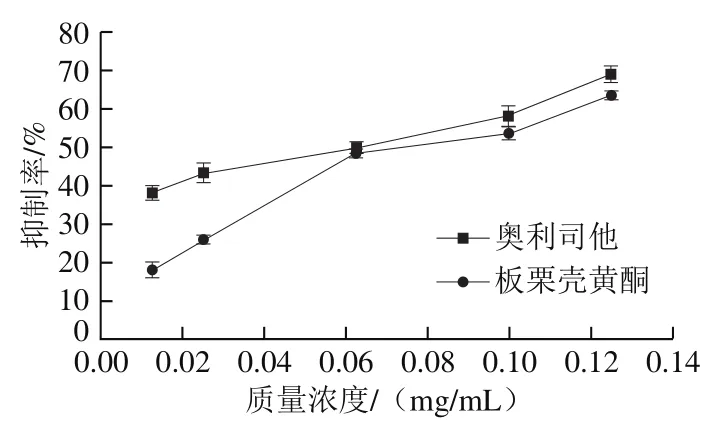
图2 抑制剂质量浓度对胰脂肪酶活力抑制率的影响Fig. 2 Effect of inhibitor concentration on pancreatic lipase activity
2.3.2 不同pH值下板栗壳黄酮对胰脂肪酶活力的抑制作用
酶的活力与pH值密切相关,酶在催化反应中都有其最适pH值,过酸或过碱都会改变酶的结构,使酶丧失活力,因此pH值的改变会影响酶对底物的催化作用[29]。由图3A可知,胰脂肪酶的最适pH值在7.4,这是因为胰脂肪酶的等电点为5.0,在PNPP、磷酸缓冲液、N,N-二甲基甲酰胺及Triton X-100形成的pH 7.4的体系中的油-水界面发生反应时带负电荷,与Triton X-100带负电的羟基形成的亲水端发生互斥作用,更易与底物接触发挥更大活性。加入板栗壳黄酮后胰脂肪酶的最适pH值向碱性条件发生偏移,变更为7.7,初步推断板栗壳黄酮的加入使胰脂肪酶活性部位的基团离子化发生变化,因而产生最适pH值的微小偏移;在pH 7.4时,空白组与样品组的酶活力有显著性差异(P<0.05)。由图3B可知,板栗壳黄酮对胰脂肪酶的抑制率最大,为62.23%,与人体小肠部位的pH值(约6.8)相近[30],说明板栗壳黄酮在小肠部位能对胰脂肪酶发挥较理想的抑制效果。

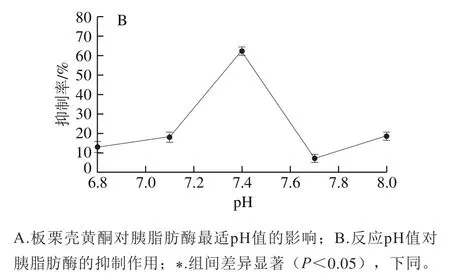
图3 不同pH值下板栗壳黄酮对胰脂肪酶活力的抑制作用Fig. 3 Inhibitory effect of chestnut shell flavonoids on pancreatic lipase activity at different pHs
2.3.3 不同反应温度下板栗壳黄酮对胰脂肪酶活力的抑制作用
温度对酶有双重影响,既可能在最适温度使酶活力达到最大,也能在高温时使酶失去活力。由图4可知,未加抑制剂时,胰脂肪酶活力在30~37 ℃温度范围内呈现逐渐升高的状态,到达临界温度37 ℃时,胰脂肪酶活力达到最高,随即在37~43 ℃胰脂肪酶活力逐渐降低,因此判断胰脂肪酶的最适反应温度为37 ℃,这与人体内温度一致。人体内大多数酶的最适反应温度在35~40 ℃[31],如果继续升高温度可能破坏了胰脂肪酶的共价键结构使其结构发生改变失去活性;而加入板栗壳黄酮,胰脂肪酶活力在30~43 ℃温度范围内差异较小,最大差异为0.003 U/g,胰脂肪酶的最适反应温度发生改变,在高于37 ℃时更耐受,说明板栗壳黄酮的加入影响了胰脂肪酶的空间构象,改变了胰脂肪酶的热稳定性。板栗壳黄酮对胰脂肪酶的抑制在33 ℃即开始发挥较好的作用,在37 ℃时,空白组与样品组的酶活力有显著性差异(P<0.05),抑制效果最佳,抑制率为65.20%;抑制效果在37~43 ℃范围内抑制效果逐渐减弱,这与升高温度破坏胰脂肪酶的共价键结构有关。由结果进一步推测板栗壳黄酮可在体内对胰脂肪酶发挥理想的抑制效果。
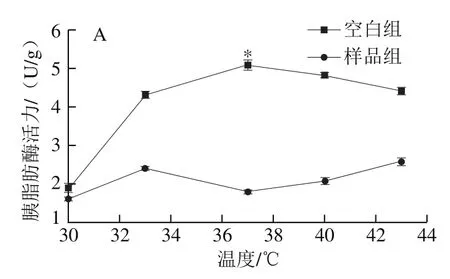
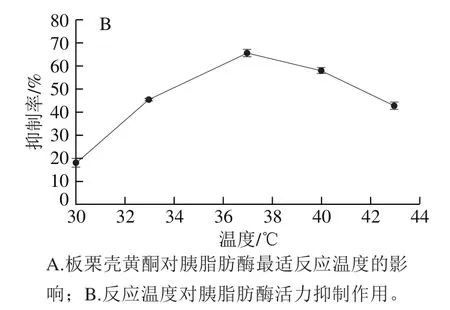
图4 不同反应温度下板栗壳黄酮对胰脂肪酶活力的抑制作用Fig. 4 Inhibitory effect of chestnut shell flavonoids on pancreatic lipase activity at different reaction temperatures
2.3.4 不同反应时间下板栗壳黄酮对胰脂肪酶活力的抑制作用
不同反应时间下板栗壳黄酮对胰脂肪酶活力的抑制作用结果如图5所示,在10~20 min时,胰脂肪酶活力随着时间的延长迅速增加,在20 min之后活力变化较不明显,呈现略微下降趋势,随着时间延长,PNP的生成趋于稳定;加入板栗壳黄酮,胰脂肪酶活力在20 min时最大,为0.022 U/g,而20 min之后的抑制效果强于20 min之前,证明随着时间的延长,板栗壳黄酮与胰脂肪酶的结合逐渐增强。反应时间大于20 min时,样品组的酶活力显著低于对照组(P<0.05),表明板栗壳黄酮对胰脂肪酶的抑制效果随时间延长而增强。
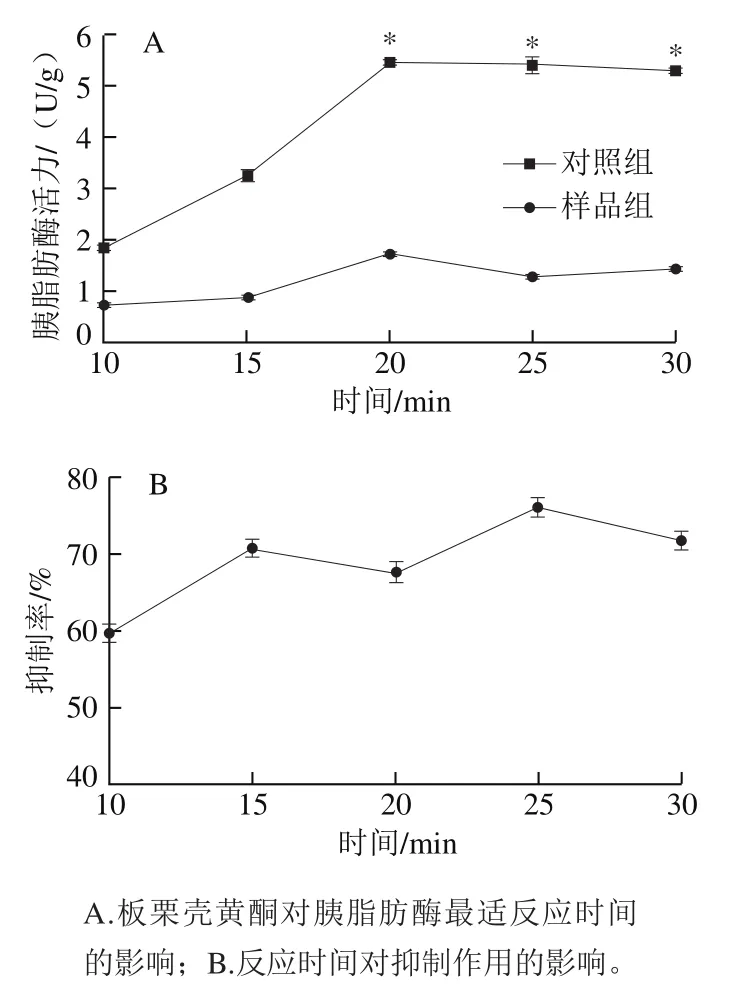
图5 不同反应时间下板栗壳黄酮对胰脂肪酶活力的抑制作用Fig. 5 Inhibitory effect of chestnut shell flavonoids on pancreatic lipase activity at different reaction times
2.4 板栗壳黄酮对胰脂肪酶的抑制作用类型
如图6所示,以1/[S]和1/V进行双倒数作图,当底物物质的量浓度为0.93~3.73 mmol/L时,改变抑制剂的浓度,直线的斜率发生改变,在x轴上的截距不变,即加入抑制剂,最大反应速率(Vmax)降低,米氏常数(Km)不变,这是非竞争性抑制作用的特性,由此可以看出,板栗壳黄酮对胰脂肪酶的抑制作用类型为非竞争性抑制,根据图6计算可得抑制常数(Ki)为53.19 mg/mL,0 mg/mL板栗壳黄酮的Vmax为5.19 μmol/(L·min),0.5 mg/mL板栗壳黄酮的Vmax为3.55 μmol/(L·min),1 mg/mL板栗壳黄酮的Vmax为2.03 μmol/(L·min)。非竞争性抑制的程度仅取决于抑制剂的浓度,板栗壳黄酮与胰脂肪酶活性中心外的必需基团产生结合,与底物之间不存在竞争关系。因此,底物浓度的增加并不影响抑制剂的抑制效果,这为有效地将板栗壳黄酮开发为胰脂肪酶抑制剂提供了理论依据。
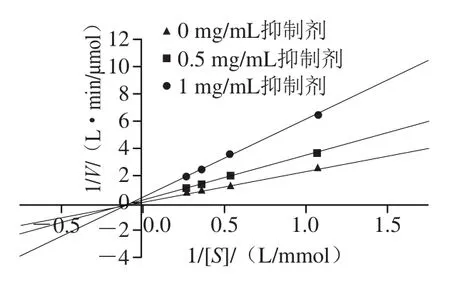
图6 板栗壳黄酮对胰脂肪酶作用的双倒数曲线图Fig. 6 Lineweaver-Burk plots of flavonoids from chestnut shells against pancreatic lipase
3 结 论
用醇提法提取板栗壳黄酮,提取物经AB-8大孔树脂纯化,得到的黄酮含量为(107.50±1.00)mg/g,提取得率为(5.66±0.05)%。通过UPLC-Q-Orbitrap MS对提取得到的板栗壳黄酮进行结构分析,鉴定出9 种酚类化合物,分别为B型原花青素二聚体、B型儿茶素三聚体、儿茶素/表儿茶素、三没食子酰葡萄糖、A型原花青素二聚体、A型原花青素三聚体、异槲皮苷、甲基鞣花酸己糖及芦丁,其中8 种为黄酮类化合物。板栗壳黄酮对胰脂肪酶具有较好的抑制作用,IC50为0.074 mg/mL,在37 ℃、pH 7.4条件下具有较好抑制效果(抑制率为65.20%),证明板栗壳黄酮在小肠部位能对胰脂肪酶发挥较理想的抑制作用。板栗壳黄酮改变胰脂肪酶活性部位的基团,使其最适pH值向碱性偏移。用Lineweaver-Burk双倒数作图法证明板栗壳黄酮对胰脂肪酶的抑制类型为非竞争性抑制,即板栗壳黄酮是与胰脂肪酶活性中心外的必需基团产生结合,与底物之间不存在竞争关系。胰脂肪酶是肠道内脂肪水解过程中的关键酶,抑制胰脂肪酶活力可减少食物中摄入脂肪的水解和吸收,降低肥胖和超重引发各种慢性病的风险。
