黄芪对白灵菇活性成分及抗氧化能力的影响*
2021-12-01蒙秋霞聂建军徐全飞潘保华赵悠悠冯婉君
蒙秋霞,聂建军,徐全飞,潘保华,赵悠悠,冯婉君,牛 宇**
(1.山西农业大学资源环境学院省部共建有机旱作农业国家重点实验室,山西 太原 030031;2.山西农业大学农业经济管理学院,山西太原 030006;3.山西省侯马市出入境检验检疫局,山西 侯马 043000)
白灵菇学名为刺芹侧耳托里亚种(Pleurotus tuoliensis 或 Pleurotus eryngii subsp.tuoliensis)[1],过去也常被称为阿魏蘑、阿魏侧耳。其菇体形似灵芝、色泽洁白、营养丰富、滋味鲜美,富含多糖、氨基酸、脂肪、粗纤维、维生素和矿物质,具有镇咳、消炎、消积、杀虫、解毒、防治肿瘤、增强人体免疫力等功效,其多糖可增强机体的抗氧化能力,是一种食用价值和药用价值都很高的珍稀食用菌[2-4]。
自由基是带有未配对电子的基团或原子,包括活性氧簇(ROS)、活性氮簇(RNS)、活性碳簇(RCS) 和活性硫簇(RSS)[5]。自由基是一把双刃剑,低水平的ROS作为胞间信号通路的第二信使,通过激活核因子 кB(NF-кB) 和低氧诱导因子 1α(HIF),调控细胞的增殖、凋亡、基因表达,为维持细胞正常功能所必需[5]。ROS水平的适度提升可帮助机体抵御多种微生物引起的感染,并参与细胞凋亡过程,清除癌变细胞[6];但若自由基水平超过一定量,多余的自由基会攻击机体的DNA、脂类、蛋白质等生物大分子,造成细胞死亡或功能异常,加速衰老进程,引起多种疾病[5]。因此,清除多余的自由基有益于延缓衰老、预防和治疗多种疾病。抗氧化剂可以提供氢原子或电子,使其与自由基中单独的电子配对,使自由基消失。因此,开发高效无毒、可清除自由基的天然抗氧化剂日益重要。
目前,研究食用菌的抗氧化活性及其提升方法成为功能性食用菌研究开发的一个热点,人们开始探索利用中药材、药渣和微量元素研发复合培养基质,通过科学方法和特殊工艺培育具有更高抗氧化功效的食(药)用菌产品。研究表明,在发酵培养基中添加刺五加、何首乌等中药材,可提高黑木耳、灵芝等食(药)用菌体内活性物质的含量,并增强其抗氧化活性[7-8]。在研究中药材对深层发酵白灵菇生长情况和活性物质含量的影响方面,孟丽等[9]考察了中药阿魏、防风、柴胡、前胡浸出液对白灵菇菌丝生长发育的影响,张劲松等[10]测定了黄芪水提物对白灵菇等5种食用菌菌丝体生长的影响,李赟等[11]测定了党参提取液对深层发酵白灵菇多糖含量的影响。
黄芪为豆科植物蒙古黄芪 [Astragalus membranaceus Bge.var.mongholicus(Fisch.)Hsiao]和膜荚黄芪 [Astragalus membranaceus(Fisch.)Bunge]的干燥根[12]。黄芪最早记录于《神农本草经》,具有益气、排毒、利尿、消肿等功效,目前已被记录以黄芪为原料的药有两百多种[13],因此黄芪被誉为“补药之长”,为历代中医常用中药之一。我国食品药品监督管理局(2002) 51号文件中明确列出了114种可用于保健品的中药,其中就包括黄芪。研究显示,黄芪中的药效成分有黄酮、皂苷和多糖等[14]。黄酮类成分具有抗心肌缺血、保护肝脏、消炎、预防突变、预防肿瘤等功效[15];皂苷可抗炎抑炎、调节免疫、保护神经、预防多发性硬化[16];多糖具有抗肿瘤、降血糖、降血脂、保护心血管、清除多种自由基及延缓衰老等多种药理作用[17-18]。目前,黄芪对深层发酵白灵菇活性物质含量及抗氧化能力的影响尚无报道。
通过深层发酵,探索黄芪水提物对白灵菇菌丝生长、活性物质含量的影响,并从DPPH·清除能力、羟基自由基(·OH) 清除能力、还原力和亚铁离子螯合能力,测定黄芪水提物对白灵菇菌丝体抗氧化活性的影响,为新型功能性食用菌产品开发提供参考。
1 材料与方法
1.1 供试材料
黄芪原药材,山西省浑源县;白灵菇菌株天山2号,北京吉蕈园科技有限公司。
1.2 供试培养基
PDA固体培养基:马铃薯20%、葡萄糖2%、蛋白胨0.3%、硫酸镁0.2%、磷酸氢二钾0.2%、琼脂2%。
液体种子培养基:黄豆芽汁20%、葡萄糖2%、磷酸二氢钾0.2%、酵母膏0.5%、硫酸镁0.1%、VB10.01%,pH自然。
1.3 其他试剂
二苯代苦味酰基自由基(DPPH·) 试剂盒、羟基自由基测定试剂盒,南京建成生物工程研究所;亚硝酸钠、磷酸二氢钠、磷酸氢二钠、酵母浸膏、水杨酸,天津市大茂化学试剂厂;无水乙醇、硝酸铝、硫酸镁、磷酸二氢钾,天津市风船化学试剂科技有限公司;黄芪甲苷、槲皮素,北京北方伟业化工技术研究院;没食子酸,成都市科龙化工试剂厂;葡萄糖,天津市科密欧化学试剂有限公司;香草醛、四氯苯醌、苯酚、氯化铁,南京化学试剂股份有限公司;福林酚试剂,北京索莱宝科技有限公司;硫酸亚铁,无锡市晶科化工有限公司;过氧化氢,天津市东方广诚医药化工有限公司;三氯乙酸,天津市光复精细化工研究所;铁氰化钾,国药集团化学试剂有限公司;无水氯化亚铁,上海依赫生物科技有限公司;氢氧化钠,天津市大陆化学试剂厂;亚铁嗪、硼氢化钠,美国Sigma-Aldrich公司;蛋白胨、琼脂粉,北京奥博星生物技术有限公司;VB1,天津力生制药股份有限公司。所用试剂均为分析纯。
1.4 试验仪器
ME204电子天平,梅特勒-托利多仪器(上海)有限公司;SW-GJ-1FD系列超净工作台,上海博讯实验有限公司医疗设备厂;BS-S恒温振荡培养箱,国华电器有限公司;HH-4数显恒温水浴锅,江苏金坛市环宇科学仪器厂;Christ ALPHA 2-4 LD plus真空冷冻干燥机、HG-9040S电热恒温鼓风干燥箱,宁波东南仪器有限公司。
1.5 黄芪水提物的制备
黄芪原药材切片、干燥、粉碎,过60目筛后,加入其重量10倍量的蒸馏水,搅拌,沸煮1 h。冷却后用4层纱布过滤,收集滤液,重复沸煮过滤2次,合并滤液,减压浓缩。分装后置于-20℃冰箱过夜,于冷冻干燥机内冻干,研末过筛,得黄芪水提物干粉,置于-20℃冰箱备用。
1.6 白灵菇菌种的制备
配置PDA固体培养基,灭菌锅灭菌90 min后趁热倒平板,冷却,待水汽彻底消失后接种白灵菇菌种。培养一段时间,待其生长良好时,收集以供后续试验使用。
白灵菇深层发酵母液的制备:配制液体种子培养基,接入活化的白灵菇菌种,28℃下以转速100 r·min-1恒温振荡培养7 d,得白灵菇深层发酵母液。
1.7 黄芪水提物对平板培养白灵菇菌丝体生长的影响
1.7.1 平板培养
用双蒸水配制0.2 g·mL-1的黄芪水提物母液备用。在50 mL锥形瓶中分别添加黄芪水提物母液0、0.3 mL、0.6 mL、1.2 mL、1.8 mL、2.4 mL、3.6 mL,再向锥形瓶中加入热的PDA培养基至24 mL,震荡摇匀,制成黄芪水提物浓度分别为0、2.5 mg·mL-1、5.0 mg·mL-1、10.0 mg·mL-1、15.0 mg·mL-1、20.0 mg·mL-1、30.0 mg·mL-1的培养基。高压蒸汽灭菌1.5h,趁热倒平板,每个浓度3次重复。待培养基彻底冷却,用打孔器取直径6 mm、活化好的白灵菇菌种,接种于平板。连续培养6 d后,十字交叉法测量菌落直径,计算菌丝生长速率。菌丝生长速率(V,mm·d-1)计算公式为:

式中:L1为菌落直径(mm);L2为接种菌饼直径(mm);D为培养天数(d)。
1.7.2 不同浓度黄芪水体物深层培养白灵菇
锥形瓶中分别加入黄芪水提物浓度为0、2.5 mg·mL-1、5.0 mg·mL-1、10.0 mg·mL-1、15.0 mg·mL-1、20.0 mg·mL-1、30.0 mg·mL-1的液体种子培养基 45 mL,再加入5 mL培养好的白灵菇液体深层发酵母液,每个浓度3次重复。28℃、100 r·min-1恒温振荡培养7 d后,以3 500 r·min-1转速离心20 min,弃上清。洗瓶摇洗、离心2次,收集沉淀,60℃下干燥至恒重,称重并计算菌丝体干重。
1.8 添加黄芪水提物深层培养白灵菇菌丝体的制备
1.8.1 母液制备
按照1.6的方法制备白灵菇深层发酵母液。
1.8.2 添加黄芪水提物的深层发酵
精密称取黄芪水提物干粉,溶解于液体种子培养基中制成50 mg·mL-1的黄芪水提物母液。取4个锥形瓶,瓶中各装入80 mL液体种子培养基,2个作为处理组,2个作为对照组。处理组加入10 mL黄芪水提物母液使其浓度达到5.0 mg·mL-1,对照组加入10 mL液体种子培养基。蒸汽灭菌,冷却后每个锥形瓶中加入10 mL培养好的白灵菇深层发酵母液,28℃下转速100 r·min-1恒温振荡培养7 d。
1.8.3 菌丝体干粉及待测菌丝体溶液的制备
将1.8.2中培养好的深层发酵液于3 500 r·min-1离心20 min,弃上清液,洗瓶摇洗、离心2次,将沉淀于60℃干燥至恒重,研末称重,密封保存于-20℃冰箱。活性成分含量测定时,将菌丝体干粉从冰箱取出静置至室温后进行。抗氧化活性测定前,精密称取菌丝体干粉1 g,用50%甲醇溶液20 mL浸提1 h,离心收集上清液,制成50.0 mg·mL-1菌丝体初始溶液,再用双蒸水稀释成2.5 mg·mL-1、5.0 mg·mL-1、7.5 mg·mL-1、 10.0 mg·mL-1、15.0 mg·mL-1、20.0 mg·mL-1、25.0 mg·mL-1的菌丝体溶液。
1.9 活性成分含量测定
菌丝体中总皂苷测定采用浓硫酸-香草醛法[19],标准品为黄芪甲苷;总黄酮测定采用硼氢化钠-四氯苯醌法[20],标准品为槲皮素;总酚酸测定采用福林酚法[21],标准品为没食子酸;总多糖测定采用硫酸-苯酚法[22],标准品为葡萄糖。
1.10 黄芪水提物对白灵菇液体发酵产物抗氧化活性的测定
1.10.1 DPPH·清除能力的测定
配制所需浓度的菌丝体待测溶液。配制25.0 mg·L-1的DPPH溶液。按说明书指示添加试剂,摇匀,避光静置1.5 h,在517 nm处测定吸光度。DPPH·清除率(E1,%)计算公式为:

式中:As为加样品的吸光度值;Ar为未加DPPH溶液的吸光度值;A0为未加样品的吸光度值。
1.10.2 ·OH清除能力的测定
配制所需浓度的菌丝体待测溶液。配制9 mmol·L-1的 FeSO4溶液、9 mmol·L-1的水杨酸-乙醇溶液和 8.8 mmol·L-1的 H2O2(3%) 溶液。取 16支10 mL EP管,先在各管中加入1mL的FeSO4溶液和2 mL水杨酸-乙醇溶液,然后加入样品2 mL(以双蒸水作空白对照),混匀,再加入H2O2溶液2 mL,室温反应1 h,在510 nm处测其吸光度值。·OH清除率(E2,%) 计算公式为:

式中:A0为空白对照的吸光度值;As为待测样品的吸光度值。
1.10.3 还原力的测定
配制所需浓度的菌丝体待测溶液。配制0.2 mol·L-1磷酸缓冲液(pH 6.6)、1%铁氰化钾、10%三氯乙酸和0.1%氯化铁溶液。取21支2.5 mL EP管,在各管中加入0.2 mL菌丝体溶液(以双蒸水为空白对照),0.5 mL磷酸缓冲液和0.5 mL铁氰化钾溶液,50℃水浴20 min,加0.5 mL三氯乙酸溶液,静置反应20 min,再加入0.5 mL氯化铁溶液,静置10 min,测定在700 nm处吸光值。1.10.4 亚铁离子螯合能力的测定
配制所需浓度的菌丝体待测溶液。配制2 mmol·L-1的 FeCl2溶液和 5 mmol·L-1的亚铁嗪溶液。先在各管中加入0.5 mL样品(以双蒸水作空白对照) 和0.1 mL FeCl2溶液,混匀后反应5 min,然后再加入0.1 mL亚铁嗪溶液,静置10 min,测定562 nm处吸光度值。亚铁离子螯合率(E3,%)计算公式为:
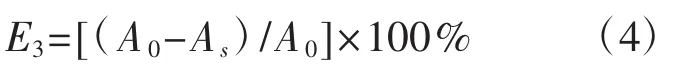
式中:A0为空白对照的吸光度值;As为待测样品的吸光度值。
1.11 统计学分析
试验结果表示为平均值±标准差;用SPSS Statistics 20软件进行数据处理和统计分析,用Duncan’s多重比较检验各个处理数据间的差异显著性。
2 结果与分析
2.1 黄芪水提物对白灵菇菌丝生长的影响
平板培养6 d或深层培养7 d后,黄芪水提物对白灵菇菌丝的生长产生不同程度的影响,见图1、图2。

图1 不同黄芪水提物浓度下白灵菇菌落生长状况Fig.1 Growth of Pleurotus tuoliensis mycelia colony cultivated with different concentrations of Astragalus membranaceus extract
图1中同一列平板表示同一浓度的3次重复,各处理白灵菇菌落近圆形,菌丝为白色丝状,添加黄芪水提物对菌丝颜色无影响。黄芪水提物浓度为2.5 mg·mL-1〜5.0 mg·mL-1时,菌落直径和生长速率随浓度的升高而增大,浓度为10.0 mg·mL-1〜30.0 mg·mL-1时,菌落直径和生长速率随浓度的升高而减小。黄芪水提物的添加提高了菌丝致密度,并呈现明显的量效关系。

图2 不同黄芪水提物浓度下白灵菇菌丝体生长状况Fig.2 Growth of Pleurotus tuoliensis mycelia cultivated with different concentrations of Astragalus membranaceus extract
由图2可见,深层培养7 d后黄芪水提物浓度在 2.5 mg·mL-1〜10.0 mg·mL-1范围内能显著促进白灵菇菌丝体生长,菌丝体干重与对照差异显著(P<0.01),在浓度为 15.0 mg·mL-1〜20.0 mg·mL-1时菌丝体干重与对照差异不显著(P>0.01),在浓度为30.0 mg·mL-1抑制了菌丝体生长,菌丝体干重显著低于对照(P<0.01)。白灵菇菌丝体干重在黄芪水提物添加量为5.0 mg·mL-1时最大,在添加量为10.0 mg·mL-1时次之。由此可见,黄芪水提物在低浓度水平促进白灵菇菌丝体生长,在高浓度水平则会抑制其生长。
试验结果表明,在黄芪水提物添加浓度为5.0 mg·mL-1时,白灵菇生长速率和菌丝体干重最大,因此本研究采用5.0 mg·mL-1作为后续白灵菇液体发酵基质中黄芪水提物的添加浓度。
2.2 白灵菇菌丝体的活性成分含量变化
添加黄芪水提物对白灵菇深层发酵菌丝体活性成分含量的影响见表1。

表1 白灵菇深层发酵菌丝体活性成分含量Tab.1 Contents of active compounds of Pleurotus tuoliensis mycelia in submerged fermentation
由表1可见,添加黄芪水提物深层发酵后,白灵菇菌丝体内各活性成分含量均有不同程度的提高。其中,总皂苷的增加最为明显,其次为总黄酮和胞外多糖,说明黄芪水提物对这些成分的影响较大。相比之下,添加黄芪水提物深层发酵后白灵菇胞内多糖和总酚酸的增加量较小。
2.3 黄芪水提物对深层培养白灵菇菌丝体的抗氧化活性的影响
黄芪水提物对深层培养白灵菇菌丝体DPPH·清除能力的影响见图3。
如图3所示,白灵菇菌丝体对DPPH·的清除率表现出明显的量效关系。常规深层发酵白灵菇菌丝体(B0)与添加黄芪水提物深层发酵的白灵菇菌丝体(B1),清除DPPH·的50%效应浓度(EC50)分别为 17.45 mg·mL-1和 14.69 mg·mL-1。在菌丝体浓度为 2.5 mg·mL-1〜7.5 mg·mL-1时,B1 与B0 的 DPPH·清除率无显著差异(P>0.05),在菌丝体浓度为12.5 mg·mL-1〜25.0 mg·mL-1时,二者DPPH·的清除率出现显著差异(P<0.05),其中在菌丝体浓度为25 mg·mL-1时差异最大,B1是对照B0的1.19倍,表明培养基中添加黄芪水提物发酵可显著促进白灵菇菌丝体DPPH·的清除能力。
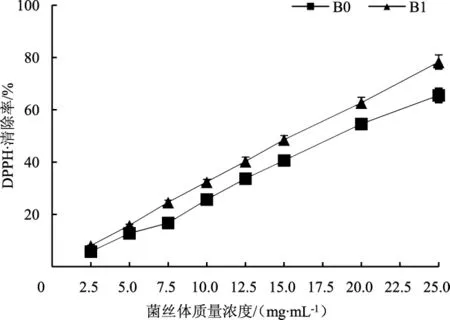
图3 添加黄芪水提物深层发酵后白灵菇菌丝体对DPPH·自由基的清除率Fig.3 DPPH·scavenging activity of Pleurotu stuoliensis mycelia cultivated with Astragalus membranaceus extract
黄芪水提物对深层培养白灵菇菌丝体·OH清除能力的影响见图4。
如图4所示,常规深层发酵白灵菇菌丝体(B0)和添加黄芪水提物深层发酵白灵菇子实体(B1) 均对·OH有一定的清除能力,其清除率随着浓度的增加而变大。B0和B1清除·OH的EC50值分别为9.27 mg·mL-1和 7.33 mg·mL-1。在菌丝体浓度为 10.0 mg·mL-1〜25.0 mg·mL-1时,B1对·OH的清除率与对照B0相比显著提高(P<0.05),在菌丝体浓度为12.5 mg·mL-1时差异最大,B1达到B0的1.26倍,说明黄芪提取物的添加可显著提高深层发酵白灵菇菌丝体对·OH的清除能力。

图4 添加黄芪水提物深层发酵后白灵菇菌丝体对·OH的清除率Fig.4 OH·scavenging activity of Pleurotu stuoliensis mycelia cultivated with Astragalus membranaceus extract
黄芪水提物对深层培养白灵菇菌丝体还原力的影响见图5。
从图5可见,随着菌丝体浓度的增加,还原反应体系吸光度值逐渐增加,呈一定的量效关系。吸光度值为0.5时,常规深层发酵白灵菇菌丝体(B0)和添加黄芪水提物深层发酵白灵菇子实体(B1) 的浓度分别为8.30 mg·mL-1和 6.24 mg·mL-1。在菌丝体浓度为 2.5 mg·mL-1〜15.0 mg·mL-1时,B1 与 B0 的还原力出现显著差异(P<0.05),其中在浓度为15.0 mg·mL-1时差异最大,B1的还原力达到B0的1.23倍。可见,黄芪提取物深层发酵可显著提高白灵菇菌丝体的还原力。
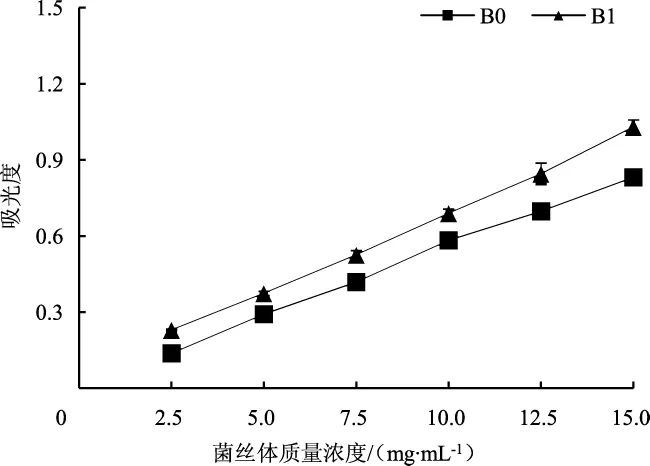
图5 添加黄芪水提物深层发酵后白灵菇菌丝体的还原力Fig.5 Deoxiding activity of Pleurotu stuoliensis mycelia cultivated with Astragalus membranaceus extract
黄芪水提物对深层培养白灵菇菌丝体亚铁离子螯合能力的影响见图6。
如图6所示,常规深层发酵白灵菇菌丝体(B0)和添加黄芪水提物深层发酵白灵菇子实体(B1)均具有较强的亚铁离子螯合能力,并表现出明显的量效关系。B0和B1的Fe2+螯合EC50值分别为4.84 mg·mL-1和3.13 mg·mL-1。试验菌丝体浓度范围内,黄芪提取物可显著提高白灵菇的亚铁离子螯合能力(P<0.05),其中在浓度为12.5 mg·mL-1时差异最大,B1达到B0的1.15倍,说明添加黄芪水提物可显著提高深层发酵白灵菇菌丝体亚铁离子的螯合能力。

图6 添加黄芪水提物深层发酵后白灵菇菌丝体的亚铁离子螯合率Fig.6 Ferrochelatation activity of Pleurotu stuoliensis mycelia cultivated with Astragalus membranaceus extract
3 讨论与结论
试验结果表明,黄芪水提物的添加可影响深层发酵白灵菇菌丝体的生长。在浓度为2.5 mg·mL-1〜15.0 mg·mL-1时,黄芪水提物对白灵菇菌丝体的生长有促进作用;在浓度升至30 mg·mL-1时,黄芪水提物对其菌丝体的生长有抑制作用。基于平板培养和深层发酵结果,黄芪水提物浓度为5 mg·mL-1时对白灵菇菌丝体的生长促进作用最强,这与张劲松等的结论一致[10]。孟丽等[9]的研究结果表明阿魏、防风、柴胡、前胡浸出液都能促进白灵菇菌丝的生长发育,并且中药浸出液的浓度不同,对菌丝生长发育的影响也不同,在低浓度时促进菌丝生长,本试验也得出类似结果。孟丽等[9]还发现,尽管随着浓度增加,中药浸出液对白灵菇菌丝生长的促进作用随之减弱,但未出现抑制作用。而本试验中,在浓度升至30.0 mg·mL-1时,黄芪水提物对白灵菇菌丝体的生长表现出显著的抑制作用,表现为菌落直径和菌丝体干重的减小。这种差异可能是由于试验采用的中药材种类和提取物制备方法的不同造成,也可能与白灵菇品种的不同有关。不同中药材在不同浓度对白灵菇菌丝生长发育的影响及其机理尚待进一步研究。
目前中药材对白灵菇深层发酵活性物质含量影响的报道较少,仅李赟等[11]研究了党参提取液对深层发酵白灵菇多糖含量的影响,结果表明党参水提取液的添加对白灵菇生物量及胞外多糖、胞内多糖含量均有促进作用,以党参水提取液浓度为50.0 mg·mL-1效果最显著。本试验发现,深层发酵培养基中黄芪水提物浓度为5.0 mg·mL-1时,白灵菇菌丝体中的活性成分含量显著增加,其胞外多糖、胞内多糖、总酚酸、总黄酮和总皂苷含量分别为对照的1.82倍、1.53倍、1.46倍、2.27倍和3.15倍。这些结果表明培养基质中添加中药材对深层发酵白灵菇活性物质的含量具有提升效果。
近年来对深层发酵冬生多孔菌、海鲜菇、香菇、茶树菇等食药用菌的抗氧化活性的研究方兴未艾[23-24],也有学者研究了白灵菇多糖和子实体的抗氧化作用[11,25],但中药材尤其是黄芪对深层发酵白灵菇菌丝抗氧化活性的影响目前未见报道。本研究中试验结果表明添加5 mg·mL-1黄芪水提物进行深层发酵后,白灵菇菌丝体的DPPH·清除率、·OH清除率、还原力和亚铁离子螯合率最高分别达到对照菌丝体的1.47倍、1.26倍、1.67倍和1.42倍,说明黄芪水提物的添加可显著提升白灵菇深层发酵菌丝体的抗氧化活性。
通过研究添加中药材黄芪对白灵菇深层发酵菌丝体生长的促进作用,以及对活性成分含量和抗氧化活性的提升效果,可推动白灵菇这一食药两用珍稀真菌的研究和新产品研发。
