综合回收废锰酸锂电池中有价成分的实验研究
2021-11-30李发闯郭战永郑泽宇张云娜吕潘良
李发闯,郭战永,张 倩,郑泽宇,张云娜,吕潘良
(1.河南工学院 材料科学与工程学院,河南 新乡 453003;2.河南省金属材料改性技术工程技术中心,河南 新乡 453003)
0 引言
随着新能源汽车的快速发展,锂离子电池市场规模快速增长。目前,中国已成为世界上最大的锂离子电池生产、消费和出口国。在锂离子电池正极材料中,尖晶石型锰酸锂具有三维锂离子通道的正极材料,并且具有价格低、环境友好、安全性能高、倍率性能好等优点[1],是理想的电池正极材料,一直受到国内外研究人员的极大关注。
然而,锂离子电池的寿命一般仅有3~5年,伴随锂电池市场保有量的持续增长,废旧锂离子电池数量也随之快速增加,产生大量的废旧锰酸锂电池[2]。废旧锂离子电池成分复杂,具有显著的污染性和资源性,随意丢弃可造成环境污染和资源的严重浪费,其中的有价成分锰、锂和石墨等,含量远高于自然矿产资源中的含量,因此综合回收废锰酸锂电池中有价成分具有重要的经济意义[3]。
现行的废旧电池处理方法以提取废旧锂离子电池中有价值元素为出发点,首先将LiMn2O4溶解,锂、锰以Li+、Mn2+的形式进入溶液,再通过化学沉淀法、电解法等湿法冶金法提取分离锂和锰等。各种工艺中,锂、锰浸出是前提,也是关键的一步。Yang Z[4]以废旧锂离子电池正极材料LiMn2O4为原料,通过选择性浸出锂离子,原位转化制备λ-MnO2。安洪力[5]研究了不同种类的酸对LiMn2O4溶解率的影响,研究发现向酸中加入H2O2影响尤为显著。Chen[6]和任晓川[7]采用柠檬酸和磷酸浸出锰酸锂,在常压条件下难以得到高效的浸出,但在高温高压水热条件下,锰的浸出率可达到99%。
目前,在废旧锂离子电池回收的研究中,重点关注的是正极材料,而对于负极石墨、铝箔和铜箔,综合考虑回收的研究较少。本文进行两个实验:针对废锰酸锂电池中有价成分特性,对锰酸锂和石墨混合粉体进行酸浸,获得较高纯度的石墨,进而对锰酸锂酸浸液进行电解,制备出二氧化锰;针对铝箔和铜箔混合体,通过碱浸实现铝箔和铜箔分离,进而制备出氢氧化铝和电解精铜,从而实现废锰酸锂电池中有价成分的综合利用。
1 实验介绍
1.1 实验材料
本实验中所用浓硫酸、双氧水、碳酸氢钠均为国产分析纯试剂。
废锰酸锂电池材料来自河南小威环境科技有限公司。首先将废锰酸锂电池通过破碎机破碎,然后将破碎后的混合物进行振动筛分,其中筛上为铜箔和铝箔混合物,筛下为废锰酸锂和石墨混合粉体(石墨粉体占比36.5%,废锰酸锂占比62.3%)。废锰酸锂和石墨粉体XRD 图谱如图1所示,废锰酸锂成分分析见表1;废铝屑和铜屑的元素分析见表2。

图1 废锰酸锂粉体XRD 图谱

表1 废锰酸锂成分分析 %

表2 废铝屑和铜屑元素分析 %
从图1中可以看出,废锰酸锂粉体中主要成分是锰酸锂和石墨,但从表1可知,废锰酸锂粉体中还存在少量的Fe、Co、Ni 和Cu 等少量杂质元素,由于杂质元素较少,杂质峰未有显现。由表2可知,废铝屑中铝的含量为92.50%,废铜屑中铜的含量为94.49%。
1.2 实验方法
实验有价成分回收工艺流程见图2,试验步骤如下所述。

图2 有价成分回收工艺流程图
1)准确称取一定量的废锰酸锂粉体,先后加入到一定量的H2SO4和H2O2溶液,在水浴中加热并磁力搅拌,反应一定时间,得到沉淀离心分离,用蒸馏水清洗以除去沉淀表面附着的H2SO4,70 ℃条件下干燥,获得残渣并收集滤液,然后采用钛阳极和石墨阴极,提取滤液中有价成分,隔膜电解制备二氧化锰。主要化学反应见式(1)~(2)。

2)废铜箔和铝箔分离并回收。铝箔碱浸生成偏铝酸钠与铜箔分离,并制备氢氧化铝。铝箔通过反应(3)生成NaAlO2,然后过滤出铜箔,再通过反应(4),添加碳酸氢钠沉淀出Al(OH)3。
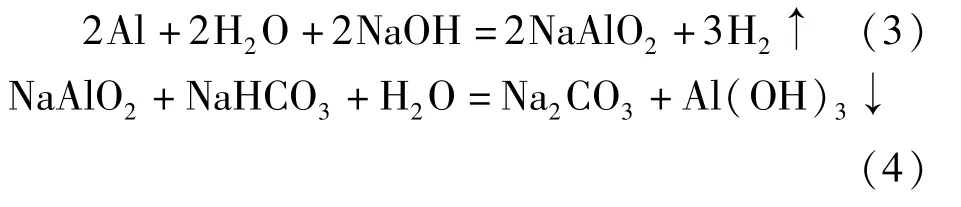
3)收集铜箔残渣,并压制成型,作为阳极,以不锈钢片为阴极,电解回收精铜。
1.3 检测方法
采用日本理学Rigaku 公司的Minflex 型的X 射线自动衍射仪(Cu Ka1,40 kV,300 mA,10°~80°)对试样进行物相(XRD)分析。采用荷兰帕纳科公司生产的Epsilon1 型X 射线荧光光谱仪(XRF)对试样进行元素分析测定。
1.4 试验计算方法
试验得到的数据需通过计算才能得到最终结果,废锰酸锂粉体浸出率计算公式见式(5),电解效率计算公式见式(6)。

式中:M0为试样的原始质量,g;M1为试样浸出反应后残渣的质量,g。

式中:η为电流效率,%;m为实际析出的电解产物质量,g;q为电解产物的电化学当量,MnO2电化学当量为1.621 6 g/A·h,铜的电化学当量1.186 g/A·h;I为电流密度,A/m2;t为电解时间,h。
2 结果与讨论
2.1 硫酸和双氧水用量对废锰酸锂粉体浸出率的影响
在反应温度75 ℃、固液比(g∶L)40∶1、反应时间60 min 条件下,考察硫酸浓度和双氧水用量对浸出率的影响,结果见图3。
由图3可知,随着硫酸浓度的增加,废锰酸锂材料的浸出率快速增大。在酸浸条件下,锰酸锂立方晶型被破坏,伴随着锂和锰浸出,根据固液多相反应动力学可知,溶液中H+向反应界面处扩散,有利于反应的进行。然而,当硫酸浓度高于0.375 mol/L时,浸出率增加缓慢,进入平台期。
由图3可知,随着双氧水浓度的增加,浸出率显著增大。

图3 硫酸和双氧水添加量对废锰酸锂粉体浸出率的影响
当浸出体系没有添加双氧水时,Mn—O 键的破坏非常困难,锰酸锂仅能自身发生氧化还原反应。锂离子溶解于酸液中,锰离子发生歧化反应,一部分以纯相λ-MnO2的形式析出[8],降低浸出体系的浸出率,主要化学反应见式(5)。

浸出体系添加双氧水后,LiMn2O4结构中Mn3+迅速被还原为Mn2+,进而扩散到溶液中,提高了LiMn2O4的浸出率。当双氧水添加量增大到6%时,锰酸锂废料的浸出率达到69.8%,结合残渣石墨中杂质元素含量,分析认为LiMn2O4基本上完全分解并浸出。
根据实验结果分析,确定浸出反应硫酸的浓度为0.5 mol/L,双氧水的浓度为6%。
2.2 酸浸回收石墨
在硫酸的浓度为0.5 mol/L、双氧水的浓度为6%的条件下,对预处理后的废锰酸锂粉体进行酸浸。对酸浸残渣进行了物相分析,分析结果见图4。由图4可知,酸浸产物为石墨,在2θ=26.5°处有衍射强度较高的石墨特征峰,对称性良好,没有明显的杂质峰,说明酸浸产物石墨层状结构完好,具有较高的回收再利用价值。

图4 废锰酸锂酸浸产物XRD 图谱
石墨中的杂质元素含量对其性能影响显著,为详细了解酸浸产物石墨中杂质元素是否有效去除,对产物进行XRF 测试,分析结果见表3。表3显示,经过酸浸处理,石墨中金属元素的含量大幅下降,杂质元素被有效脱除。石墨中含有少量的Si、S、Fe 和Co 等杂质成分,商用锂离子电池用石墨要求固定碳含量≥99.5%,与商用锂离子电池石墨材料相比,杂质元素含量仍然偏高。因此,后续工作需要对石墨产物进一步除杂处理,提高其附加值。

表3 酸浸产物石墨中的杂质元素分析 %
2.3 浸出液电解二氧化锰
以酸浸滤液为基础调配电解液,硫酸和硫酸锰浓度均为0.5 mol/L,硫酸锂浓度为0.125 mol/L。采用钛金属为阳极,石墨为阴极,在75 ℃和电流密度80 A/m2的条件下电解3 h,实际槽电压5.6 V,电解结束后剥离阳极板上产物,通过计算得到的电流效率为70.21%。由阳极反应可知,阳极发生析氧和二氧化锰沉积两种竞争反应,且两者的标准电位非常接近,因此,阳极产物电流效率偏低。
MnO2具有多变的晶型与晶体结构,常见的晶型有α-MnO2、γ-MnO2、β-MnO2和δ-MnO2等,通常是以混合晶型的形式存在,MnO2晶体结构对其电化学性能有着不可忽视的影响。
电解产物的XRD 图谱如图5所示。由图5可以看出,电解产物在2θ=37°、42°、56°和65°处出现γ-MnO2的特征衍射峰,且γ-MnO2在各种晶型中活性最佳。但衍射图谱中存在较宽的不定形态的漫射峰,说明电解产物结晶度低,含有较多的非晶成分,电解二氧化锰结晶度低可能与电解温度偏低有关[9]。电解二氧化锰产物元素分析见表4,电解产物中二氧化锰占比98.41%,少量杂质元素为Si、P和S 等。

图5 电解二氧化锰XRD 图谱

表4 电解产物MnO2成分分析 %
2.4 回收废铝箔制备氢氧化铝
将铜箔和铝箔混合废料浸入浓度为1 mol/L 的氢氧化钠溶液中,铝溶于碱中生成偏铝酸钠,而铜不与碱反应,进而过滤分离铜和铝。收集含有NaAlO2的滤液,在滤液中添加碳酸氢钠生成Al(OH)3沉淀,过滤并烘干,制备产物的XRD 图谱见图6。

图6 回收产物氢氧化铝XRD 图谱
Al(OH)3属两性氢氧化物,是用量最大和应用最广的无机阻燃添加剂。由图6可知,沉淀产物为Al(OH)3,其衍射峰与标准峰一一对应,且衍射强度较高,而且没有明显的杂质峰。元素分析显示见表5,所制备的Al(OH)3纯度为95.14%。

表5 氢氧化铝成分分析 %
2.5 电解铜箔
将收集的废铜箔压制成片作为阳极,不锈钢片作为阴极,采用H2SO4-CuSO4体系电解精炼铜,在Cu2+45 g/L、H2SO4浓度185 g/L、反应温度50 ℃、电解时间2 h、极间距3 cm 的反应条件下,考察不同电流密度对电解情况的影响。不同电流密度下电解铜晶面取向及XRD 图谱见图7。
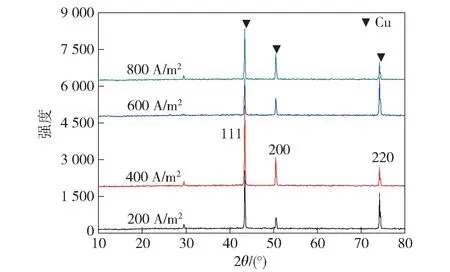
图7 不同电流密度下铜箔的XRD 图谱
从图7可看出,电积铜为立方晶系(65-9743),而且无杂质衍射峰出现,品质较好。电流密度对结晶取向产生一定的影响,电积铜在(111)晶面择优取向生长,同时还存在(200)、(220)择优晶面[10]。
不同电流密度条件下的电流效率和槽电压见表6。随着电流密度的增大,槽电压逐渐升高,同时电流效率出现下降。结合生产效率和成本考虑,选择电流密度为400 A/m2,在此条件下,电解电流效率为96.2%。在Cu2+45 g/L、H2SO4浓度185 g/L、反应温度50 ℃、电解时间2 h、极间距3 cm、电流密度400 A/m2的反应条件下,电解精铜的纯度较高,达到98.96%(表7)。
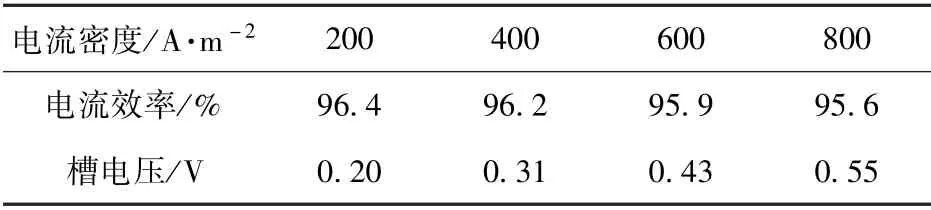
表6 不同电解条件下的电流效率和槽电压

表7 电解铜箔元素分析 %
3 结论
本文对废锰酸锂电池进行了回收试验,试验先对废锰酸锂电池进行预处理,并破碎筛分分为两部分,一部分为铜箔和铝箔混合体,另一部分为锰酸锂和石墨混合粉体,针对两部分的特性差异,系统回收其中的石墨、锰、铝和铜,得到如下结论。
1)对锰酸锂和石墨混合粉体进行酸浸,随着硫酸和双氧水含量的增加,废锰酸锂粉体的浸出率快速增大,当硫酸的浓度为0.5 mol/L、双氧水的浓度为6%时,LiMn2O4基本上完全分解并浸出,浸出渣为较高纯的石墨。
2)对锰酸锂酸浸液进行电解,制备出纯度为98.41%的MnO2,但电解产物结晶度低,含有较多的非晶成分。
3)通过碱浸对铜箔和铝箔混合体实现分离,收集含有NaAlO2的滤液,制备出纯度为95.14%的Al(OH)3;将废铜箔压制成片作为阳极,在Cu2+45 g/L、H2SO4浓度185 g/L、反应温度50 ℃、电解时间2 h、极间距3 cm、电流密度400 A/m2的条件下进行电解精炼,电流效率为96.2%,电解精铜的纯度达到98.96%。
本文研究为后续废旧电极材料的处理提供了切实可行的途径,对实现资源的回收和循环再利用具有重要的意义。
