白血病患者T淋巴细胞及免疫球蛋白检测价值评价
2021-11-30叶筱颖朱瑜王子峰
叶筱颖,朱瑜,王子峰
(1.江西省上饶市人民医院血液科,江西 上饶 334000;2.江西省上饶市人民医院检验科,江西 上饶 334000)
白血病患者机体内部克隆性白血病细胞大量分化繁殖导致机体的造血组织出现大量表达而产生的血液系统疾病,可同时累及多种器官,贫血和出血是白血病患者主要临床现象,据调查显示,我国每10万例中就有3~4例为白血病患者,儿童占比较高,目前在恶性肿瘤中排名靠前[1-2]。白血病包括急慢性白血病、淋巴性白血病等,但白血病的具体发病原因尚未明确[3]。有文献表明,白血病疾病发展过程与机体免疫功能发生变化有关,人体免疫功能状态与白血病发展过程互相影响,与病情发展具有此消彼长的趋势[4],T淋巴细胞是在人胸腺传出的特殊标志细胞,能够分泌Th1和Th2细胞因子在自身及体液免疫疾病中发挥抵抗感染作用,并发现多种肿瘤实体的发生与T淋巴亚群及Th1和Th2细胞因子有关。淋巴细胞亚群中各类细胞发挥的作用有较大的区别,CD3+代表亚群数量,CD4+是主要细胞能增强细胞的免疫能力,CD8+细胞具有毒细胞作用,表达升高时具有抑制CD4+细胞表达的作用[5-6]。CD4+CD8+保持在一定范围内具有平衡免疫细胞功能的作用,但是在白血病这种非实体肿瘤疾病的患者的体内水平表达如何,相关文献较少,本研究对多例白血病患者和健康人Th1及Th2、CD4+CD25+及免疫球蛋白进行检测,探讨期临床意义价值,现报道如下。
1 资料与方法
1.1 临床资料 选取2015年1月至2019年1月在本院收治的45例初诊和12例化疗后缓解的急性白血病患者作为白血病组,初诊患者男28例,女17例;平均年龄(45.36±7.45)岁;病情缓解者男7例,女5例;平均年龄(46.16±7.65)岁。另选取同期健康体检者60名,男34名,女26名;平均年龄(45.38±8.69)岁。本研究经过医院伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:所有患者均符合2006年NCCN中关于急性白血病中的诊断标准,患者及家属均签署知情同意书。排除标准:治疗后再次感染而入院治疗者;临床资料不完整者。
1.3 方法
1.3.1 血液标本 入院第2天清晨,抽取两组患者静脉血5 mL,2 mL静脉血离心20 min,保留上清液,剩余3 mL放在EDTA无菌抗凝中备用。
1.3.2 Th1和Th2细胞因子检测 采取ELISE试剂盒(江苏宝莱生物)检测患者血清中白介素-2(IL-2)、干扰素(IFN-γ)及白介素-4(IL-4)、白介素-10(IL-10)表达,具体操作按照试剂盒说明书进行。
1.3.3 免疫球蛋白检测 采用免疫散射比浊法试剂盒(德沃生物科技)检测患者血清中的免疫球蛋白(IgA、IgG、IgM)的表达。
1.3.4 T淋巴细胞亚群检测 抗凝的血样2 h内采用PBS稀释1∶1,在DMEM培养基中将淋巴细胞浓度调整为2×106个,30 min加入CD3+、CD4+、CD8+抗体,静止20 min,离心后PBS缓冲液2次,采用流式细胞仪(美国,贝克曼库尔特Navios)分析。
1.3.5 CD4+CD25+T细胞检测方法 选择两只无菌FACS试管,加入20μCD4-FIIC、MouseIGgI-PE试管中,另一只试管中加入20μCD4-FIIC、CD25-PE。加入少量FACS溶血素,离心弃去上清液,PBS摇匀,4℃保存1 h,采用流式细胞仪检测,结果采用CD4+CD25+T细胞、CD4+CD25+highT细胞占CD4+T细胞的比例。
1.3.6 乳酸托氢酶(LDH)检测 血清中LDH采用日历—7150型全自动生化分析仪(日本)测定。
1.4 观察指标 健康组和白血病组患者在初诊时及完全缓解时的白血病患者Th1及Th2、CD4+CD25+及免疫球蛋白和LDH因子表达。
1.5 统计学方法 采用SPSS 22.0统计学软件进行数据分析,计量资料以“”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组Th1及Th2细胞因子水平比较 白血病组患者Th1细胞中IL-2、IFN-γ表达低于健康组,缓解时白血病患者Th1细胞中IL-2、IFN-γ表达高于初诊时,白血病组Th2细胞中IL-4、IL-10水平高于健康组(P<0.05),缓解时白血病患者Th2细胞中IL-4、IL-10表达低于初诊时(P<0.05),见表1。
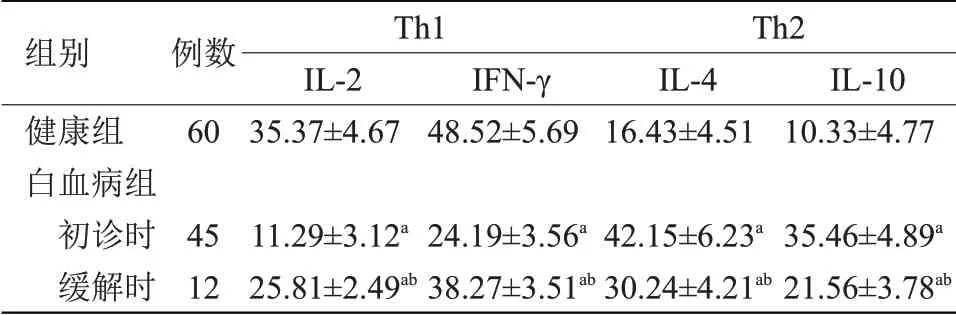
表1 两组Th1及Th2细胞因子水平比较Table 1 Comparison of Th1 and Th2 cytokine levels between two groups
2.2 两组免疫球蛋白水平比较 初诊时白血病患者的免疫球蛋白IgA、IgM高于健康组,IgG低于健康组(P<0.05),缓解时白血病患者免疫球蛋白IgG、IgM水平与健康组水平比较差异无统计学意义,IgA高于健康组(P<0.05),见表2。
表2 两组免疫球蛋白水平比较(±s,g/L)Table 2 Comparison of immunoglobulin level between two groups(±s,g/L)

表2 两组免疫球蛋白水平比较(±s,g/L)Table 2 Comparison of immunoglobulin level between two groups(±s,g/L)
注:IgA,免疫球蛋白A;IgG,免疫球蛋白G;IgM,免疫球蛋白M。与健康组比较,a P<0.05;与初诊时比较,b P<0.05
组别健康组白血病组初诊时缓解时例数60 45 12 IgA 1.34±0.79 7.74±0.53a 2.59±0.69ab IgG 9.25±1.97 8.43±1.34a 9.45±1.76b IgM 1.54±0.37 1.79±0.23a 1.47±0.26b
2.3 两组T淋巴细胞亚群水平比较 白血病组患者在初诊时T淋巴细胞CD3+、CD4+、CD4+/CD8+低于健康组,CD8+高于健康组(P<0.05),与初诊时比较,缓解时白血病患者T淋巴细胞CD3+、CD4+、CD4+/CD8+上升,CD8+下降(P<0.05),见表3。初诊时比较,bP<0.05
表3 两组T细胞亚群水平比较(±s,%)Table 3 Comparison of T cell subpopulation level between two groups(±s,%)

表3 两组T细胞亚群水平比较(±s,%)Table 3 Comparison of T cell subpopulation level between two groups(±s,%)
注:CD3+,成熟T淋巴细胞;CD4+,诱导性T细胞/辅助性T细胞;CD8+,抑制性T细胞/细胞毒性T细胞。与健康组比较,a P<0.05;与
组别健康组白血病组初诊时缓解时例数60 45 12 CD3+75.69±6.54 60.89±5.26a 69.32±3.27ab CD4+48.31±7.74 31.47±4.98a 39.77±3.64ab CD8+27.76±5.09 45.17±4.29a 36.26±3.89ab CD4+/CD8+1.84±0.23 1.02±0.18a 1.51±0.26ab
2.4 两组患者外周血CD4+CD25+表达比较 白血病组患者外周血CD4+CD25+、CD4+CD25+high高于健康组(P<0.05),缓解时,患者外周血CD4+CD25+、CD4+CD25+high低于初诊时(P<0.05),见表4。
表4 两组CD4+CD25+表达水平比较(±s)Table 4 Comparison of CD4+CD25+expression level between two groups(±s)

表4 两组CD4+CD25+表达水平比较(±s)Table 4 Comparison of CD4+CD25+expression level between two groups(±s)
注:与健康组比较,a P<0.05;与初诊时比较,b P<0.05
组别健康组白血病组初诊时缓解时例数60 45 12 CD4+CD25+11.46±4.34 16.69±5.15a 14.26±3.48ab CD4+CD25+high 1.86±0.84 4.09±0.98a 2.89±0.93ab
2.5 乳酸托氢酶(LDH)检测 白血病患者初诊时乳酸托氢酶(LDH)水平高于健康组(P<0.05),缓解时LDH水平低于初诊时(P<0.05),见图1。
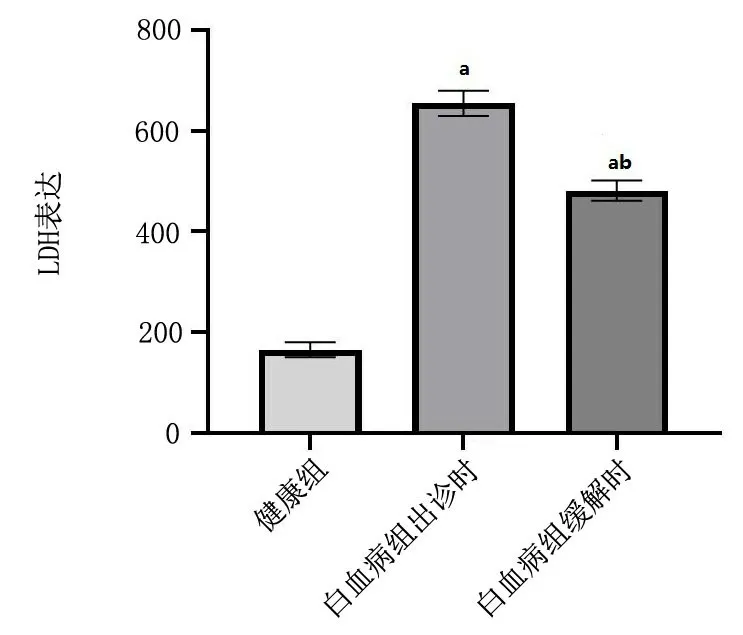
图1 LDH水平Figure 1 LDH level
3 讨论
急性白血病属于非实性恶性肿瘤疾病,与机体内免疫活性细胞的产生、分化和增殖有关,免疫细胞异常会导致肿瘤细胞逃避宿主的免疫监视,使外周淋巴细胞发生质与量的改变,从而形成肿瘤产生。机体内出现肿瘤细胞免与免疫细胞密丢失不可分[7-8]。CD4+能活化T细胞和B细胞,而当T细胞和B细胞活化时会释放大量的细胞因子能够促进CD8+T细胞表达增强,B细胞抗体受到影响,多角度多方面增强抗肿瘤细胞的能力。CD8+常在免疫应答后期发挥作用,在靶细胞过程产生细胞毒性外,还可以促进免疫抑制因子增加,削弱免疫应答能力,并在过程中能阻断CD4+作用。CD4+/CD8+在一定范围内能帮助维持免疫环境稳定的功能,反映出免疫反应的调节能力,但免疫平衡遭到破坏时,可产生继发性免疫缺陷。
本研究结果显示,白血病组患者Th1细胞中IL-2、IFNγ表达低于健康组,Th2细胞中IL-4、IL-10水平高于健康组(P<0.05)。细胞因子具有直接杀死肿瘤细胞及抵抗肿瘤效应细胞并间接起到抗病毒作用,是人体常见的抵抗肿瘤细胞的组成之一[9]。机体的细胞免疫主要是由Th1细胞因子中的IL-2及IFN-γ参与作用的,机体的体液免疫主要通过Th2细胞因子IL-4、IL-10发挥作用[10]。杨志刚等[11-12]研究发现,Th1/Th2细胞因子异常是导致肿瘤细胞逃避的主要原因,并发现急性白血病患者免疫平衡向Th2漂移,使机体内出现肿瘤,但抑制作用无效的主要原因。因此,治疗时可纠正Th1/Th2失衡,增强Th1细胞因子的能力,能抑制肿瘤细胞免疫逃窜,与刘晓等[13-14]研究结果一致。
白血病组患者在初诊时免疫球蛋白低于健康组(P<0.05),白血病机体免疫防御系统的组成部分包含Ig,并在抵抗肿瘤逃逸方面发挥重要作用[15]。本研究发现白血病患者体内的IgA、IgG和IgM表达低于健康人。伍香玲[16]发现在急性白血病患者体内发现Ig水平异常减少而导致患者的免疫功能减退有关,现在国内外对白血病患者Ig血症尚无统一定论,但多数认为于B细胞功能失调有关。
本研究结果显示,白血病组患者在初诊时T淋巴细胞CD3+、CD4+、CD4+/CD8+低于健康组,CD8+高于健康组(P<0.05),缓解时与初诊时相比T淋巴细胞CD3+、CD4+、CD4+/CD8+上升,CD8+下降(P<0.05)。这个现象说明急性白血病机体确实存在机体免疫功能紊乱现象,CD8+占比相对增加而导致机体免疫抑制状态在急性白血病发病过程中存在重要意义。研究发现急性白血病患者CD4+细胞占比降低,表示患者机体细胞免疫功能下降,CD8+细胞分化增多会使机体收到免疫反应抑制,减少了抵抗白血病细胞的能力,使白血病细胞生长更加长久。
本研究发现在白血病患者体内CD4+CD25+表达显著高于健康人,提示急性白血病患者体内可能存在某种促进、CD4+CD25+Treg生成的产物,能促进机体免疫抑制[17]。Sixi[18]发现过表达CD4+CD25+Treg时,白血病患者机体内的免疫功能收到抑制,抵抗白血病细胞的能力减退,白血病细胞出现免疫逃逸,从而延长病程。另外,本研究发现LDH水平在白血病患者初诊时水平远远高于缓解时和健康人的水平。在白血病初诊时表达升高与机体周围血幼稚细胞数量呈正比,LDH表达升高主要源于白血病细胞,可代表白血病细胞负荷的物质之一,与张娜等[19]研究结果一致。梁永生等[20]研究表明,在白血病患者细胞中LDH会在濒临死亡的细胞中渗出,表达活跃,并在白血病发展过程中发挥重要作用。
综上所述,急性白血病患者免疫球蛋白表达异常,T淋巴细胞变化在急性白血病患者的治疗指导具有临床意义。
