苦荞麸皮黄酮提取物及有效成分的抑菌活性
2021-11-30吴萌萌王松涛沈才洪
吴萌萌, 刘 怡, 严 馨, 张 娜, 李 姝,, 王松涛, 沈才洪, 赵 建*
(1.四川大学 生命科学学院/资源微生物学及生物技术教育部重点实验室 四川 成都610064;2.泸州品创科技有限公司,四川 泸州646000)
苦荞麦俗称苦荞,学名鞑靼荞麦(Fagopyrum tataricum),是一年生或多年生宿根植物,起源于中国西南部,生长范围遍布亚洲、欧洲和北美洲[1]。苦荞麦属于药食两用作物,富含碳水化合物、蛋白质、脂肪、维生素及各种矿质营养元素,具有极高的营养价值[2-3];同时与其他粮食作物相比,其富含黄酮类化合物,具有抗氧化、抗炎、抑菌、降血糖、抗肿瘤等生理功能[4-9]。
大肠杆菌、金黄色葡萄球菌、沙门氏菌是常见的引起食物中毒的食源性致病菌,粪肠球菌是人畜共患病原菌且耐药性严重;志贺氏菌是细菌性痢疾最为常见的病原菌,藤黄微球菌会引起脑膜炎、肺炎等[10-11]。随着抗生素在人类和动物疾病治疗及农业生产中的大量使用,耐药性问题日益严重,天然植物源抑菌剂以其天然、安全、高效等特性已成为研究热点[12]。已有研究表明,黄酮类化合物对许多病原微生物具有广谱抑菌特性[13],鉴于其不易产生耐药性的优势,深入研究含有黄酮类的天然植物源活性成分对于天然抑菌剂及抗菌药物的研发具有至关重要的作用。有研究表明苦荞麸皮中含有大量黄酮类化合物,其黄酮含量约为苦荞粉的5倍,但由于其口感粗糙、食味苦涩且不易消化,所以在苦荞制品加工过程中多被丢弃,加工利用率低[14]。
目前,对苦荞麸皮黄酮类化合物的研究多涉及苦荞麸皮黄酮提取工艺的优化及苦荞麸皮黄酮含量的检测,对苦荞麸皮黄酮类的抗菌活性研究较少。为探究苦荞麸皮黄酮类化合物对常见病原菌的抗菌活性,提高苦荞麸皮资源的利用效率,作者选取了大肠杆菌、志贺氏杆菌、沙门氏菌、金黄色葡萄球菌、藤黄微球菌、肠球菌等6株病原菌作为供试菌,采用平板打孔法及二倍稀释法检测苦荞麸皮黄酮粗品和精品的抗菌性能,通过高效液相色谱法分析粗品与精品黄酮类化合物的成分及含量区别,并在测定黄酮单体抗菌活性的基础上,讨论了其主要成分的构效关系,以期为苦荞麸皮的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
苦荞麸皮原料:四川环太生物科技股份有限公司产品;芦丁标准品、山奈酚标准品(纯度均 ≥98%):上海麦克林生化科技有限公司产品;山奈酚-3-O-芸香糖苷标准品、异槲皮苷标准品(纯度均≥98%):成都普思生物科技股份有限公司产品;槲皮素标准品(纯度≥98%):Sigma公司产品;LB肉汤培养基、LB琼脂培养基:青岛高科技工业园海博生物科技有限公司产品;琼脂:Biofroxx公司产品。
供试菌种:金黄色葡萄球菌(Staphylococus aureus,ATCC25922); 藤 黄 微 球 菌(Micrococcus luteus,CMCC28001); 耐 久 肠 球 菌(Enterococcus durans);大 肠 杆 菌(Escherichia coli,ATCC25922);志 贺 氏 菌 (Shigella castellani);肠 炎 沙 门 氏 菌(Salmonella enteritidis,CVCC3377)。上述指示菌株均为作者所在实验室保藏菌种。
HZK-FA210型电子天平:福州华志科学仪器有限公司产品;SL502N型分析天平:上海民桥精密仪器科技有限公司产品;YLD-2000型电热恒温鼓风干燥箱:上海琅玕实验设备有限公司产品;YRE-301旋转蒸发器:巩义市予华仪器有限责任公司产品;净品级ADS-7型大孔吸附树脂:天津浩聚树脂科技有限公司产品;LC-16型高效液相色谱仪:日本岛津公司产品;PS-06A型超声波清洗机:东莞市洁康超声波设备有限公司产品;UV-2600型紫外可见分光光度计:日本岛津公司产品;LDZX-30KB型立式蒸汽压力灭菌锅:上海申安医疗器械厂产品;1389型生物安全柜:美国Thermo公司产品;SKY-211C型恒温摇床:美谷分子仪器有限公司产品;DZKW-D-4恒温水浴锅:上海苏坤实业有限公司产品;HPS-250型恒温培养箱:哈尔滨市东明医疗器械厂产品。
1.2 实验方法
1.2.1 苦荞麸皮总黄酮制备方法取苦荞麸皮适量,参照文献[15]提取工艺条件:料液质量体积比1 g∶10 mL,乙醇体积分数70%,提取温度60℃热回流提取3 h,重复提取3次,合并提取液并减压浓缩至干,即得苦荞麸皮黄酮粗品。以苦荞麸皮黄酮粗品加适量水样品制成上样液,通过ADS-7型大孔吸附树脂进行动态吸附,用体积分数90%乙醇作为洗脱剂进行洗脱,收集洗脱液减压浓缩至干,即得苦荞麸皮黄酮精品。
1.2.2 抑菌活性测定
1)总黄酮样品的制备 用二甲基亚砜(DMSO)作为溶剂,称取苦荞麸皮黄酮粗品及精品各5 g,加入5 mL DMSO,超声辅助溶解,经0.22μm微孔滤膜过滤,配成质量浓度1 g/mL药液。
2)制备指示菌平板 将供试细菌接种于LB琼脂培养基上,置于37℃恒温培养箱中培养18~24 h。取对数生长期的供试细菌,接种于LB液体培养基中,37℃、150 r/min条件下培养过夜。取活化好的供试菌种,用无菌生理盐水调整菌液澄清度,将菌液浓度调至0.5麦氏单位,约1×108CFU/mL。参照谭才邓等[16]的方法,使用预加菌液倾注平板法制备试验平板。向20 mL冷却至50℃左右的LB固体培养基中接种1 mL菌悬液,混合均匀后倒入无菌培养皿中,水平静置。
3)打孔法测定抑菌活性 通过平板打孔法[16-17]测定抑菌圈直径。待指示菌平板冷却凝固后,用外径为8 mm的打孔器打孔(孔间距不少于25 mm,孔中心距平皿边缘不少于15 mm),用无菌针头小心挑去培养基小块,孔中滴加少量体积分数0.5%琼脂封底。向各孔中分别加入苦荞麸皮黄酮粗品(质量浓度1 g/mL)、苦荞麸皮黄酮精品(质量浓度1 g/mL)、DMSO各80μL,对应做好标记,置于37℃的培养箱中培养24 h。采用十字交叉法测定抑菌圈直径,每组实验重复3次。
1.2.3 最低抑菌浓度(MIC)和最小杀菌浓度(MBC)测定
1)样品的制备 将苦荞麸皮黄酮精品及粗品用DMSO溶液配制成质量浓度200 mg/mL的溶液,0.22μm微孔滤膜过滤,用液体培养基依次倍比稀释成质量浓度100、50、25、12.5、6.25、3.13、1.56 mg/mL;4种黄酮单体分别用DMSO溶液配制成质量浓度50 mg/mL的溶液,0.22μm微孔滤膜过滤,用液体培养基依次倍比稀释成质量浓度25、12.5、6.25、3.13、1.56、0.78、0.39 mg/mL。
2)菌悬液制备 将供试细菌接种于LB琼脂培养基上,置于37℃恒温培养箱中培养18~24 h。取对数生长期的供试细菌,接种于LB液体培养基中,37℃、150 r/min条件下培养过夜。取活化好的供试菌种,用无菌生理盐水调整菌液澄清度,将菌液浓度调至0.5麦氏单位,约1×108CFU/mL。
3)MIC及MBC测定 采用二倍稀释法[17]进行最低抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定。分别吸取100μL母液及梯度稀释样品于96孔板的2~9孔内,每个孔中分别加入100μL稀释至1×108CFU/mL的菌悬液。第10孔加200μL液体培养基作为阴性空白对照,第11孔加100μL菌液和100μL液体培养基为阳性空白对照。将96孔板置于培养箱中37℃培养24 h后,通过肉眼比对发现微孔内液体澄清透明经震荡后仍无沉淀产生,则此微孔对应的药液浓度即为此样品对供试细菌的最低抑菌浓度(MIC)。将无细菌生长的微孔中液体吹打混匀后取100μL涂布于无菌培养基平板,于37℃继续培养24 h,仍无菌落生长的最低药物浓度为样品的最小杀菌浓度(MBC)。
1.2.4 高效液相色谱法测定
1)标准品溶液制备 称取芦丁、异槲皮苷、山奈酚-3-O-芸香糖苷、槲皮素、山奈酚标品粉末适量于EP管中,甲醇充分溶解,再各管吸取适量标准品溶液进行混合,0.22μm微孔滤膜过滤。
2)样品溶液制备 精密称取苦荞麸皮黄酮粗品及精品10 mg,10 mL甲醇充分溶解,0.22μm微孔滤膜过滤。
3)色谱条件 参照文献[15]方法进行改进。Intersustain C18色谱柱(4.6 mm×250 mm,5μm);流动相为乙腈(A)-0.2%磷酸(B),梯度洗脱(0~25 min,15%~25%A;25~35 min,25%~50%A;35~45 min,50%~90%A;45~55 min,90%A);体积流量1.0 mL/min;柱温35℃;检测波长360 nm;进样量20 μL。检测后与混合标准品进行对比。
1.2.5 数据处理实验数据均为3次重复实验的均值,数据用SPSS 24.0软件进行统计分析,计算其均值与标准差。
2 结果与分析
2.1 苦荞麸皮黄酮粗品与精品的抑菌效果比较
2.1.1 抑菌圈测定打孔法测定苦荞麸皮黄酮粗品与精品对试验所选6种常见致病菌的抑制效果,结果见图1和表1。由实验结果可知,苦荞麸皮黄酮提取物对供试菌均有一定抗菌活性,且对不同供试菌抑菌作用的大小具有显著差异,其对革兰氏阳性菌的抑菌活性强于对革兰氏阴性菌的抑菌活性。苦荞麸皮黄酮粗品对藤黄微球菌具有最强抑菌作用,其次为金黄色葡萄球菌和肠球菌,对大肠杆菌及沙门氏菌的抑制较弱。而相同浓度的精品对这5种供试菌的抑菌活性显著强于粗品,且对志贺氏菌也表现出一定的抑制作用。以上结果表明苦荞麸皮黄酮精品对供试菌的抑菌活性显著强于苦荞麸皮黄酮粗品。
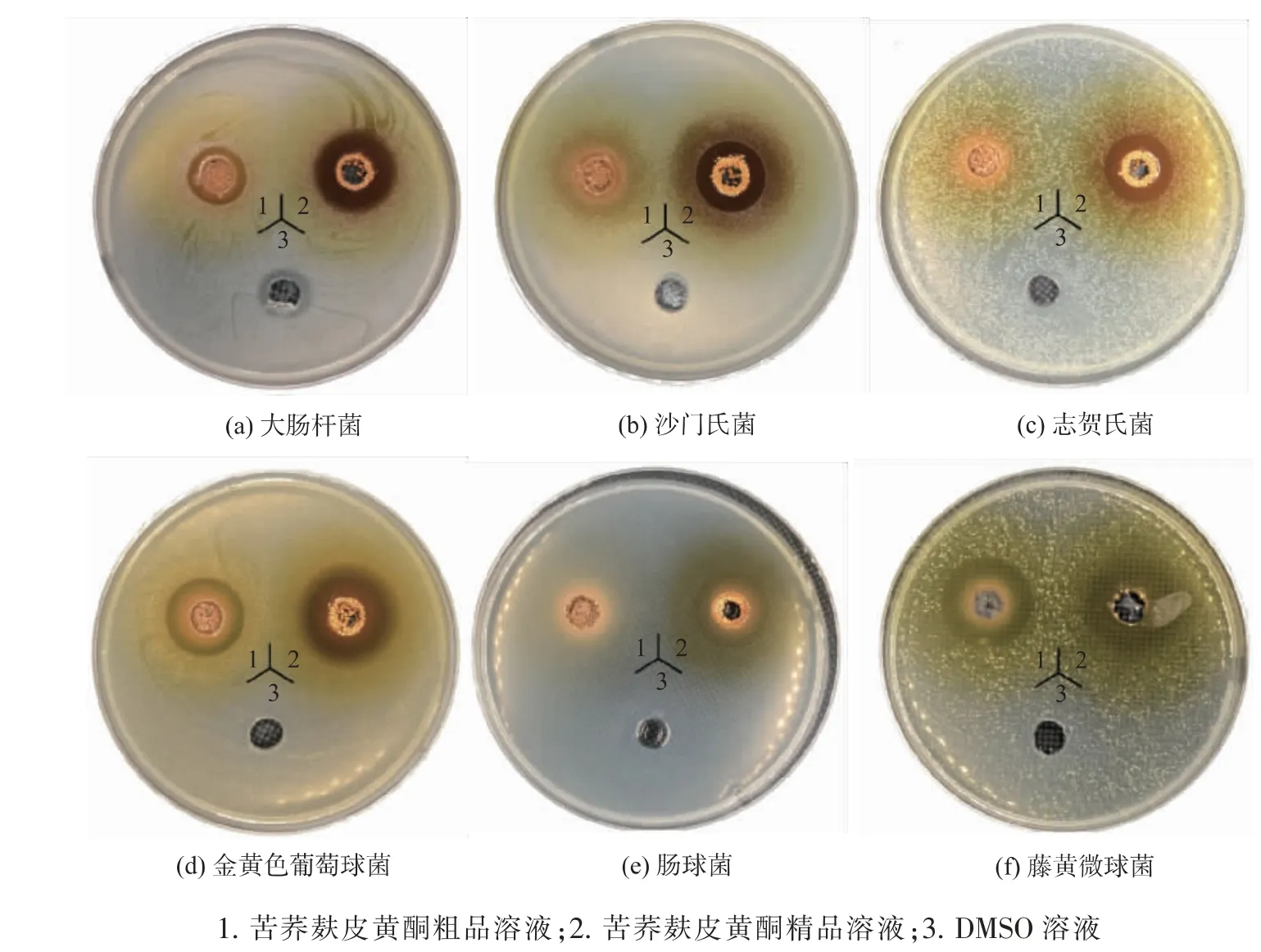
图1 苦荞麸皮粗品与精品抑菌圈Fig.1 Inhibition zone of crude and refined flavonoids from tartary buckwheat bran
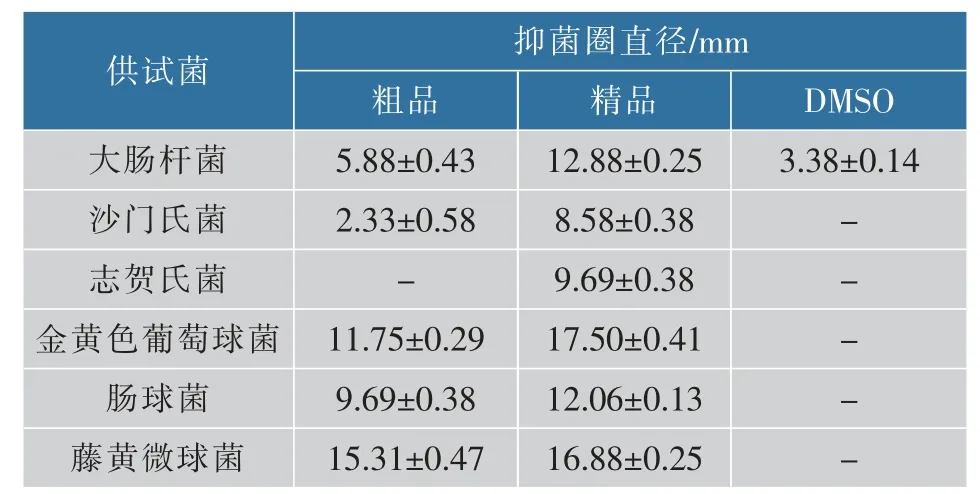
表1 苦荞麸皮黄酮粗品与精品的抑菌圈直径Table 1 Diameter of inhibition zone of crude and refined flavonoids from tartary buckwheat bran
2.1.2 MIC及MBC测定结果表2结果可知,苦荞麸皮黄酮粗品对3种革兰氏阳性菌的MIC值均为25 mg/mL,而在实验最大质量浓度100 mg/mL下,对志贺氏菌仍未能起抑制作用。而精品对这6种供试菌均具有较好的抑制作用,抑菌效果优于粗品,且对于革兰氏阳性菌的抑制作用强于革兰氏阴性菌。从最小杀菌浓度结果可知,苦荞麸皮黄酮粗品对于大肠杆菌、金黄色葡萄球菌、肠球菌、藤黄微球菌的MBC值均在50 mg/mL,精品对革兰氏阳性菌的杀菌效果比粗品好,其对金黄色葡萄球菌、肠球菌、藤黄微球菌的MBC值为25 mg/mL。
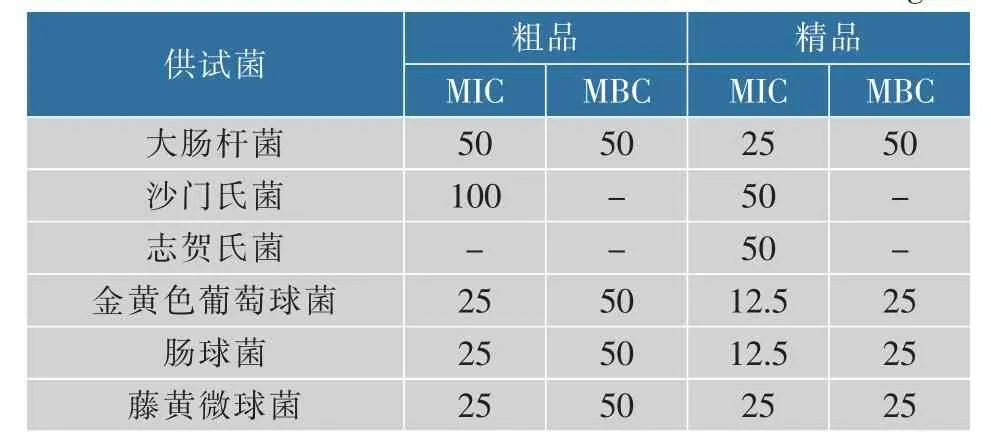
表2 苦荞麸皮黄酮粗品与精品对6种供试菌的MIC值及MBC值Table 2 The MIC and MBC values of crude and refined tartary buckwheat bran flavone mg/mL
2.2 苦荞麸皮黄酮粗品与精品单体成分分析
2.2.1 HPLC定性检测为明确苦荞麸皮黄酮粗品及精品的抑菌效果差异,采用HPLC对苦荞黄酮粗品和精品进行了成分分析。由图2可知,标准品芦丁、山奈酚-3-O-芸香糖苷、槲皮素、山奈酚的保留时 间 分 别 为17.108、21.693、35.328、38.586 min,将粗品与精品的出峰保留时间与标准品的出峰保留时间进行对比,可以看出粗品与精品中均有4个峰与标准品芦丁、山奈酚-3-O-芸香糖苷、槲皮素、山奈酚的出峰时间一致,初步表明苦荞黄酮粗品和精品的主要黄酮成分均为芦丁、山奈酚-3-O-芸香糖苷、槲皮素和山奈酚。
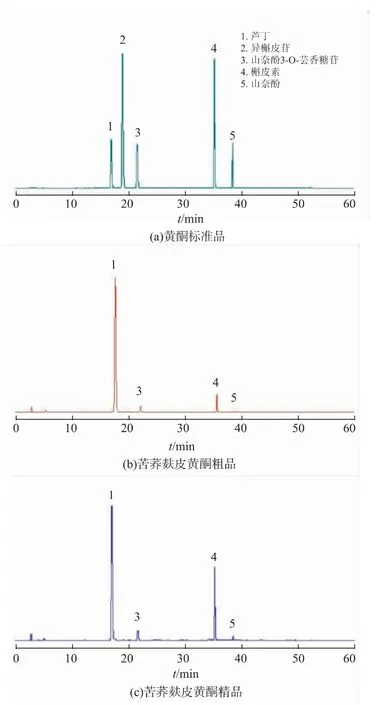
图2 黄酮标准品、苦荞麸皮黄酮粗品、苦荞麸皮黄酮精品色谱图Fig.2 HPLC chromatograms of flavonoids,crude tartary buckwheat bran flavone and refined tartary buckwheat bran flavone
2.2.2 HPLC定量检测前期实验结果表明,苦荞麸皮黄酮精品抑菌效果优于粗品,而两者主要黄酮成分相同,因此对粗品及精品中芦丁、山奈酚-3-O-芸香糖苷、槲皮素和山奈酚4种黄酮单体进行定量分析。由表3可知,经大孔树脂富集精制后,苦荞黄酮精品中芦丁、山奈酚-3-O-芸香糖苷和槲皮素的含量均有所增加,精品的总黄酮含量可达79.50%,精制倍数可达2.84倍。
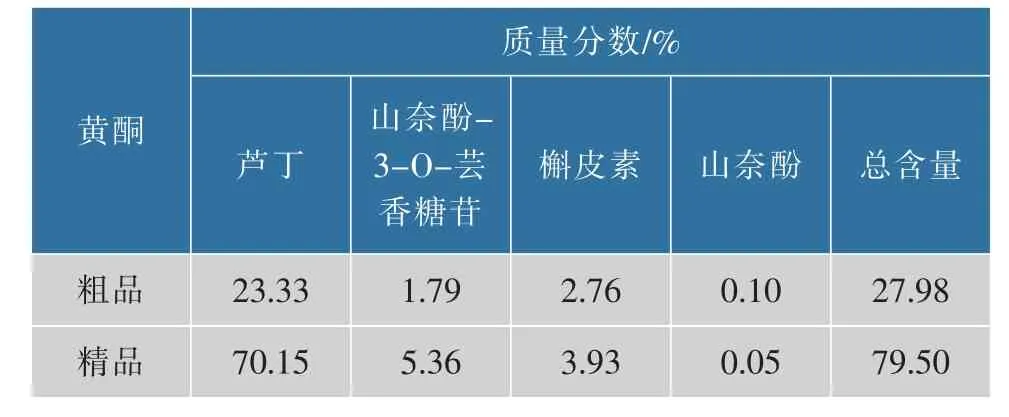
表3 苦荞黄酮粗品与精品主要成分对比Table 3 The components and content of crude and refined flavonoids in tartary buckwheat bran
2.3 4种黄酮成分的抑菌活性研究
为明确4种黄酮成分在抑菌中的作用,测定了4种单体的抑菌活性,4种黄酮单体对6种供试菌的抑制作用具有选择性和差异性。表4结果可知,槲皮素的抑菌活性最强,对5种供试菌的MIC值均为12.5 mg/mL;其次是山奈酚和山奈酚-3-O-芸香糖苷,对6种供试菌的MIC值均在25 mg/mL及以下;芦丁的抑菌活性较差,且无杀菌效果。
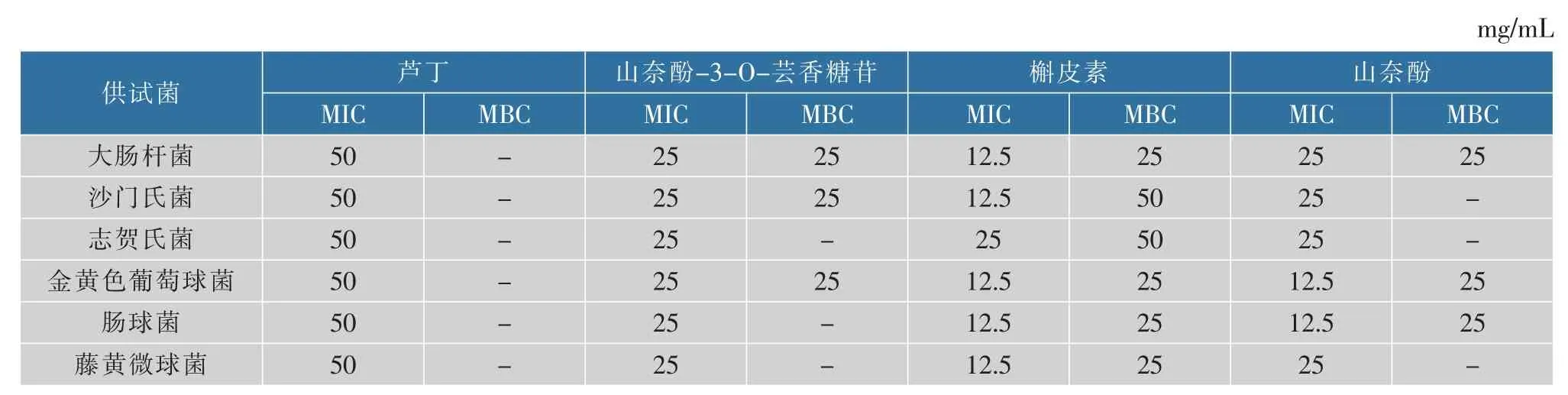
表4 4种黄酮单体对6种供试菌的MIC值及MBC值Table 4 MIC and MBC values of four flavonoid glycosides
3 结 语
苦荞作为常见的药食两用作物,在食品加工中广泛应用,而其麸皮多被丢弃,作者探究了苦荞麸皮黄酮类化合物对常见病原菌的抗菌活性,以期为苦荞麸皮的开发利用提供理论依据。采用平板打孔法及二倍稀释法对苦荞麸皮粗品及精品的抑菌活性进行研究,结果表明苦荞麸皮黄酮粗品及精品对大肠杆菌、志贺氏杆菌、沙门氏菌、金黄色葡萄球菌、藤黄微球菌、肠球菌6种常见致病菌均有一定抑制作用,尤其是对金黄色葡萄球菌的抑制作用最强。王丽娟等研究表明黑苦荞中的黄酮类化合物对金黄色葡萄球菌和大肠杆菌均有较好的抑菌作用,这与本研究结果相一致[18]。
大孔树脂富集后苦荞麸皮黄酮的抑菌活性明显优于富集前,抑菌活性的强弱可能与黄酮含量存在量效关系或与其黄酮成分相关。通过HPLC对苦荞麸皮黄酮粗品与精品黄酮类化合物的成分及含量进行分析,大孔树脂富集前后成分无变化,主要黄酮成分均为芦丁、山奈酚-3-O-芸香糖苷、槲皮素和山奈酚,但精品中芦丁、山奈酚-3-O-芸香糖苷和槲皮素的含量均有所增加,精品的总黄酮含量可达79.50%,精制倍数可达2.84倍。测定了4种黄酮单体的抑菌活性,研究表明含量最多的芦丁的抑菌活性不佳,槲皮素的抑菌活性更强。槲皮素是黄酮醇的典型代表,它已被证实具有很强的抗菌活性,Wang等[19]研究发现革兰氏阳性细菌对槲皮素高度敏感,且研究表明[20]槲皮素与氨苄西林、头孢拉定等抗生素联合使用对耐甲氧西林金黄色葡萄球菌能够有效降低耐药性,提高其抗菌活性。赵晓頔等[21]对从高良姜中分离得到的山奈酚的体外抗菌实验表明山奈酚对革兰氏阳性菌金黄色葡萄球菌、枯草芽孢杆菌具有较强抗菌活性。槲皮素与山奈酚对革兰氏阳性菌的抑菌效果更强。
国内外对山奈酚-3-O-芸香糖苷抑菌活性的研究较少,本研究发现,山奈酚-3-O-芸香糖苷对于常见食源性微生物显示出一定抑菌效果。天然存在的黄酮类化合物大多以甙类形式存在,并在两个芳环上常有—OH或—OCH取代基,其抗菌活性取决于其母体上羟基的取代程度。有研究表明黄酮分子中C4=O和C5—OH、C7—OH是抗菌活性的首要基团,其次为C3—OH基团,C3’—OH、C4’—OH也具备一定的抗菌活性,且类黄酮苷元比其相应的糖苷具有更高的抗菌活性[22-23]。芦丁和山奈酚-3-O-芸香糖苷分别是槲皮素和山奈酚对应的糖苷,它们的差异在C3位置,上述发现支持本研究中单体抑菌活性实验的结果。此外,尽管芦丁的抑菌活性弱,但有研究表明芦丁可以增强黄酮类化合物的抗菌活性[24-25]。Muha-mmad等发现芦丁与桑黄素单独无活性,但联合使用对供试细菌有活性[20],且槲皮素与芦丁、桑黄素三者联合使用对供试菌的抑制作用比单独作用有进一步增强。这提示芦丁可能通过增强其他3种黄酮化合物的抑菌活性,使苦荞麸皮黄酮精品的抑菌活性优于粗品。
通过对苦荞麸皮总黄酮及其有效成分的抑菌活性的分析,发现苦荞麸皮黄酮在抗菌方面具有广泛的应用潜力。使用大孔树脂纯化后可以有效提升其抑菌活性,苦荞麸皮黄酮的抗菌活性成分芦丁、山奈酚-3-O-芸香糖苷、槲皮素和山奈酚的抑菌能力大小具有一定的构效关系,但4种黄酮单体的协同抑菌机理及苦荞麸皮黄酮的体内抗菌活性有待进一步研究。本研究表明苦荞麸皮通过浸提、浓缩、精制等技术手段,能很大提高其抑菌功能活性,提升其附加值,是一种有深度开发价值的天然抑菌资源。
