模拟胃肠道消化对玉米低聚肽抗氧化作用的影响
2021-11-30张江涛张铭皓高丽辉冯晓文谷瑞增李国明刘文颖
张江涛, 张铭皓, 高丽辉, 冯晓文, 谷瑞增, 李国明, 刘文颖*
(1.中国食品发酵工业研究院有限公司/北京市蛋白功能肽工程技术研究中心,北京100015;2.北京林业大学 生物科学与技术学院,北京100083;3.北京农学院 食品科学与工程学院,北京102206)
玉米缺乏赖氨酸等人体必需氨基酸,主要作为养殖业和畜牧业的饲料,只有少部分用于食用。玉米蛋白粉、玉米粕、玉米皮和玉米黄粉等均为玉米加工的副产物,深度加工可提高玉米加工副产物的营养价值,促进玉米产业的可持续发展[1-3]。
玉米蛋白粉因为水溶性较差,目前主要用于生产饲料。玉米蛋白粉中蛋白质含量很高,质量分数达65%,此外还含有大量的类胡萝卜素和黄色素,具有较强的抗氧化能力等多种生理活性。人体内具有特殊的寡肽吸收系统,其吸收效率高于氨基酸和蛋白质,可减轻小肠负担,有益于人体健康。将玉米蛋白粉经过特定的酶解工序处理,得到玉米低聚肽。玉米低聚肽具有抗氧化、抗疲劳等生理活性[4-5],若作为食品添加剂添加于食品中或者作为原料做成肽类食品,具有广阔的应用前景。
氧化应激与人体密切相关,当人体收到外源或者内源因素刺激时,会使人体抗氧化体系失衡,导致氧化应激,引发细胞凋亡、氧化损伤和线粒体损伤等,对人体健康产生影响[6]。玉米低聚肽具有较强的抗氧化活性,但经人体肠道吸收后是否仍影响玉米低聚肽的抗氧化活性的研究鲜有报道,本研究旨在探索体外模拟胃肠道消化对玉米低聚肽抗氧化活性的影响,为玉米蛋白粉的高效持续利用提供可行性依据。
1 材料与方法
1.1 材料与仪器
玉米蛋白粉:北京中食海氏公司产品;JS-1细胞:上海冠导生物工程公司产品;2’,7’-二氢二氯荧光黄双乙酸钠(DCFH-DA)、Fluorescein(荧光指示剂)、Trolox(水溶性维生素E)、偶氮二异丁脒盐酸盐(AAPH)、1,1-二苯基-2-三硝基苯肼(DPPH)、相对分子质量标准品(色谱纯):美国MCE公司产品;乙腈(色谱纯):上海麦克林生化科技有限公司产品;ABTS自由基清除能力检测试剂盒:碧云天生物技术研究所产品;DMEM培养基,胎牛血清:Hyclon公司产品;碱性蛋白酶、中性蛋白酶,胃蛋白酶,胰蛋白酶:南宁东恒华道生物科技有限责任公司产品。
YCP-200 CO2培养箱:长沙华曦电子科技有限公司产品;Spectra MR多功能酶标仪:北京宏昌信科技有限公司产品;FACSCalibur流式细胞仪:美国BD公司产品;SpectraMax i3x多功能酶标仪:美国MD公司产品;LC-20A高效液相色谱仪:日本Shimadzu公司产品;HH-501型超级恒温水浴锅:常州国宇仪器制造有限公司产品;9140A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司产品。
1.2 实验方法
1.2.1 玉米低聚肽的制备参照马勇等[7]的制备方法,详细工艺流程为:取从北京中食海氏公司购买的玉米蛋白粉100 g,加入碱性蛋白酶(2 500 U/g)酶解,在50℃,pH为8.5条件下作用2 h;随后中性蛋白酶(3 000 U/g)酶解,在50℃,pH为6条件下作用2 h。得到的水解物经6 000 g离心后,上清液通过陶瓷膜和超滤膜分离纯化,经过低温浓缩、脱色、净化、喷雾干燥等一系列步骤获得玉米低聚肽粉状样品。
1.2.2 玉米低聚肽体外模拟消化体外模拟胃环境消化试验:将5.0 g玉米低聚肽和0.2 g NaCl于超纯水中混合,pH计调节pH值=2.0,水浴温度为37℃,随后加入0.05 g胃蛋白酶在37℃下边搅拌边反应120 min,高温条件下灭酶,待冷却至27℃,调节pH值为7.5,容量瓶定容至100 mL。空白组除不加胃蛋白酶,其余操作工序不变[8-9]。
体外模拟肠环境消化试验:将5.0 g玉米低聚肽和0.68 g KH2PO4于超纯水中混合,pH值为7.5,设定水浴温度37℃,立即加入0.05 g胰蛋白酶处理4 h,高温灭酶,待冷却至27℃后继续加超纯水到100 mL。空白组除不加胰蛋白酶外,其余条件不变[8,10]。
1.2.3 相对分子质量分布的测定使用高效液相色谱(HPLC)系统测定玉米低聚肽的相对分子质量,该系统配有TSKgel G2000SWXL色谱柱。流动相为体积分数0.1%三氟乙酸、45%乙腈和55%水溶液,流量为1.0 mL/min,柱温为30℃,进样量为10μL,紫外检测波长为220 nm。用相对分子质量189(乙氨酰乙氨酰乙氨酸)、451(乙氨酰乙氨酰酪氨酰精氨酸)、12 400(细胞色素c)、40 000(过氧化物酶)的标准物质建立标准曲线。最后通过氨基酸分析仪分析玉米低聚肽的相对分子质量分布[11-13]。
1.2.4 DPPH自由基清除率测定用无水乙醇配制浓度为0.1 mmol/L DPPH无水乙醇溶液,用去离子水 将 样 品 稀 释 为1.0、2.0、4.0、6.0、8.0、10.0、15.0、20.0 mg/mL,在96孔板中依次加入0.1 mL样品与0.1 mL DPPH无水乙醇溶液,此为样品组Ac;依次加入0.1 mL样品与无水乙醇溶液,此为空白组A0;依次加入0.1 mL蒸馏水与0.1 mL DPPH无水乙醇溶液,此为对照组A1。混匀,遮光处理,27℃反应0.5 h,517 nm处测定吸光值[14]。
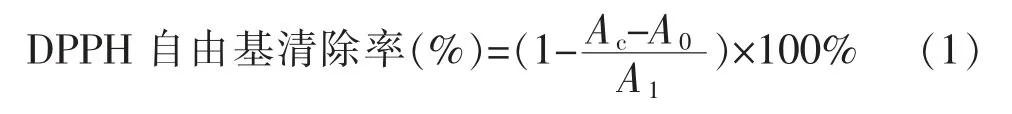
1.2.5 羟基自由基清除率测定用去离子水配制1.0、2.0、4.0、6.0、8.0、10.0、15.0、20.0 mg/mL的 样 品溶液,配制5 mmol/L水杨酸乙醇溶液,5 mmol/L FeSO4溶液和0.1 mL 5.6 mmol/L H2O2溶液。将0.1 mL各浓度的样品溶液与0.2 mL水杨酸乙醇溶液,0.2 mL FeSO4溶液混匀,以0.1 mL H2O2溶液启动反应,此为样品组Ab;空白组(A0)以0.1 mL蒸馏水启动反应;对照组(A1)将0.1 mL样品溶液更改为0.1 mL蒸馏水。晃匀后,37℃水浴反应1 h,然后取各组反应液0.1~0.2 mL于96孔板中,测定510 nm处A值[15]。
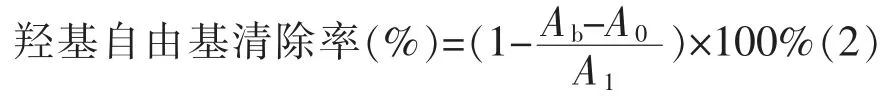
1.2.6 ABTS自由基清除率测定ABTS测定采用Lin等[16]的方法进行,但略有修改。将7 mmol/L ABTS储备液与2.45 mmol/L过硫酸钾溶液混合。让混合物在室温下黑暗中静置12~16 h以产生ABTS·+。然后用0.1 mol/L磷酸盐缓冲液(pH 7.4)稀释ABTS·+溶液。样品也用相应的缓冲液稀释。在96孔微孔板中加入200μL工作液和10μL样品后,在734 nm处测定吸光度,用等体积0.1 mol/L磷酸盐缓冲液代替样品作为空白。ABTS·+用磷酸盐缓冲液稀释,在波长为734 nm时,吸光值为0.70±0.02。以Trolox为标准抗氧化剂。计算ABTS自由基清除活性,并绘制Trolox浓度图,以获得标准曲线。最终样品的抗氧化能力以mmol/g表示[17]。
1.2.7 ORAC值测定氧自由基吸收能力(ORAC)测定基于Coscueta等[18]提出的方法。反应在37℃下在75 mmol/L磷酸盐缓冲液(pH 7.4)中进行,最终的分析混合物(200μL)含有100μL荧光素(0.8 μmol/L)、75μL AAPH(150 mmol/L)和25μL标准品或25μL样品或25μL 75 mmol/L磷酸盐缓冲液(pH 7.4)。在120 min内记录荧光(5 min/次,共24个循环)。使用激发波长485 nm,发射波长530 nm的酶标仪,黑色聚苯乙烯96孔微孔板。所有反应混合物制备重复3次。最终ORAC值表示为μmol/g Trolox[19]。
1.2.8 玉米低聚肽对HSC增殖影响测定对HSC细胞进行传代培养,待细胞生长至试验所需量,通过消化、离心、稀释得到所需的细胞浓度1×105个/mL,每孔移取接种0.2 mL细胞悬液于96孔板中。细胞培养箱中培养约1 d。用完全培养基配制50、100、200、400μg/mL的样品,加入到细胞培养液中,空白对照孔不加样品。细胞培养箱中持续孵育1 d后,收集培养液。各孔加入0.02 mL质量浓度为5 mg/mL的噻唑蓝,继续在培养箱中反应约4 h,加入二甲基亚砜,震荡0.5 h后,570 nm处测定吸光值[20]。

式中:X1为细胞增殖比;AX为样品组吸光值;A0为空白对照组吸光值。
1.2.9 HSC细胞ROS测定将HSC细胞于6孔板培养,6个孔分别标记为空白组、模型组、胃(胰)蛋白酶对照组、胃(胰)蛋白酶消化组。2 d后除空白组以外,将100、400μg/mL的样品加入到6孔板中继续培养。1 d后向6孔板中加入1.0 mL DCFH-DA,于细胞培养箱反应0.5 h后加入1.0 mL AAPH,过20 min后用流式细胞仪测定细胞荧光强度的变化[21]。

式中:X2为荧光强度比;AX为样品组吸光值;A0为空白对照组吸光值。
1.2.10 数据分析每组数据平行测定3次,使用Origin Pro 8.5软件(OriginLab Corp.,Northampton,MA,USA)处理数据。试验数据以平均值±标准偏差表示。
2 结果与分析
2.1 消化前后玉米低聚肽相对分子质量分布
玉米低聚肽的相对分子质量主要集中在150~1 000,总比例占90%以上,表明其水溶性好、易吸收[4]。胃蛋白酶和胰蛋白酶消化后,玉米低聚肽的相对分子质量分布变化幅度不大,重均相对分子量分别下降1.47%、0.05%,与未消化组比较,均无显著性变化(P>0.05)(表1)。由此看出,玉米低聚肽对胃蛋白酶和胰蛋白酶消化均具有稳定性,小肽尤其是具有抗氧化活性的短肽基本受蛋白酶作用的影响非常小。因此,玉米低聚肽是一种潜在的可能在消化后保持一定抗氧化活性的肽类物质。
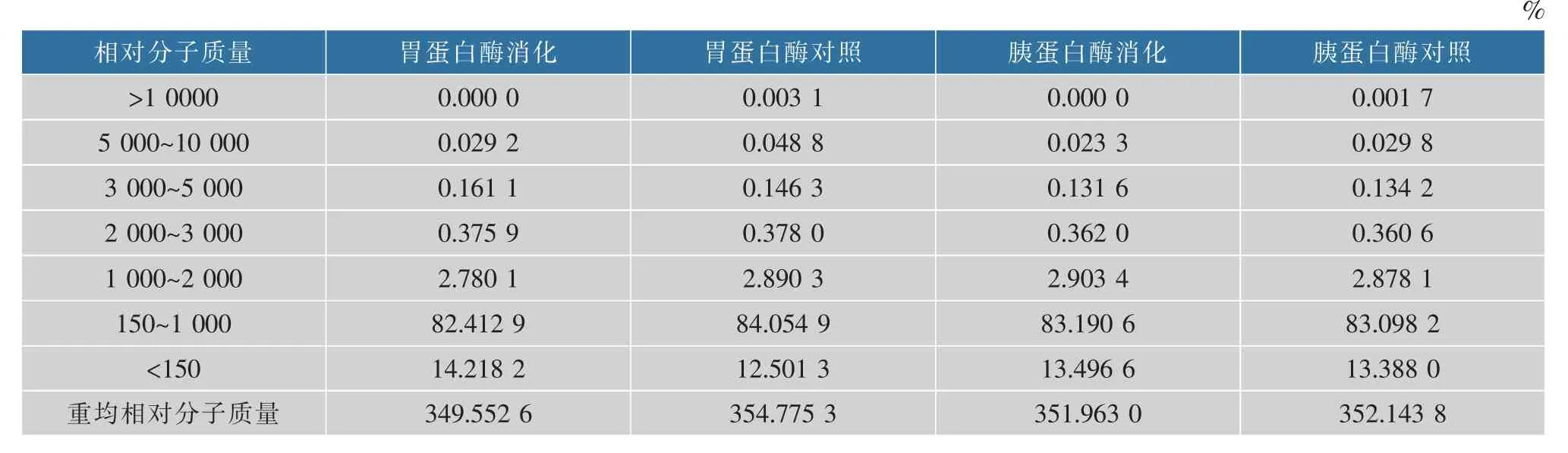
表1 不同处理的玉米低聚肽相对分子质量分布Table 1 Relative molecular weight distribution of corn oligopeptides with different treatments
2.2 消化前后玉米低聚肽的DPPH自由基清除能力
DPPH自由基清除能力是利用电子转移和电荷中和原理,其非常稳定,被广泛用于测定抗氧化剂的功效[22]。当DPPH自由基含量逐渐变少时,溶液的颜色会由紫色逐渐变为浅黄色[23]。图1显示了胃蛋白酶和胰蛋白酶消化前后对玉米低聚肽的DPPH自由基清除能力的变化。玉米低聚肽的DPPH自由基清除能力与浓度呈明显的量效关系。模拟消化对玉米低聚肽DPPH自由基清除能力无显著性影响(P>0.05),在质量浓度为20 mg/mL时清除率都达到75%~85%,模拟胃环境消化前后IC50值分别约为1.41、1.50 mg/mL,模拟肠环境消化前后IC50值分别约为1.39、1.48 mg/mL,说明玉米低聚肽具有较高的DPPH自由基清除能力和消化稳定性。王贝贝等[24]以羊皮胶原肽为试验原料,研究了模拟胃肠消化对羊皮胶原肽抗氧化活性的影响,其DPPH自由基清除能力变化趋势与本研究一致。
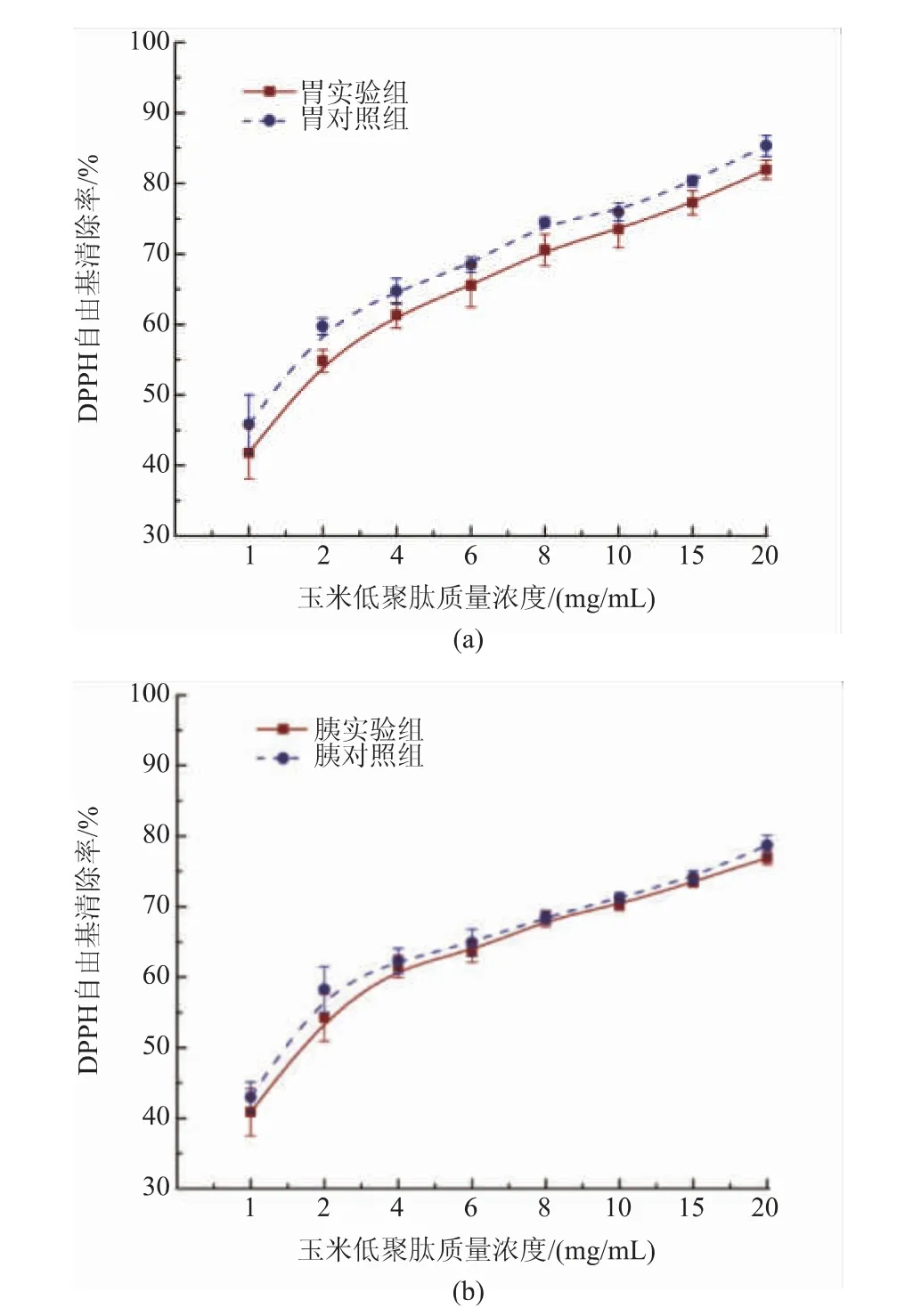
图1 不同处理的玉米低聚肽对DPPH自由基清除作用Fig.1 DPPH free radical scavenging effect of corn oligopeptides with different treatments
2.3 消化前后玉米低聚肽的羟基自由基清除能力
羟基自由基作为氧自由基中最活泼的一种,可以对几乎所有邻近的生物分子造成严重损害。图2为玉米低聚肽经模拟胃环境和模拟肠环境消化前后的羟基自由基清除能力变化。玉米低聚肽的羟基自由基清除能力在试验浓度范围内与浓度呈正相关。经模拟消化处理后,其羟基自由基清除能力与空白对照组相比,仅有轻微下降,无显著性变化(P>0.05)。玉米低聚肽在模拟胃环境消化前后IC50值分别约为10.3、12.3 mg/mL,模拟肠环境消化前后IC50值分别约为8.1、9.5 mg/mL,因此,模拟胃肠消化对玉米低聚肽羟基自由基清除能力影响很小,消化后仍具有较高的羟基自由基清除能力。可能是由于玉米低聚肽中存在很少的能被消化酶特异性水解的结构,使得玉米低聚肽水解物羟基自由基清除能力仍保持稳定[25]。
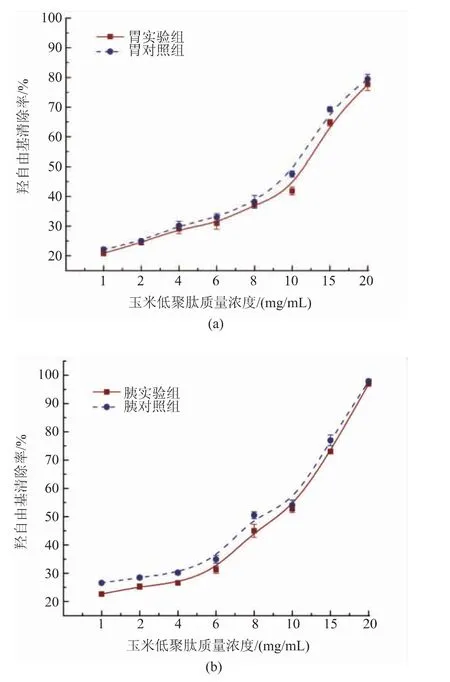
图2 不同处理的玉米低聚肽对羟基自由基清除作用Fig.2 Hydroxyl free radical scavenging effect of corn oligopeptides with different treatments
2.4 消化前后玉米低聚肽的ABTS自由基清除能力
该方法以ABTS为显色引发剂,加入抗氧化性物质后ABTS自由基的电荷被中和,颜色变浅,吸光值降低,根据下降趋势可表征出所检测物质抗氧化活性的强弱[26]。图3为根据Trolox标准品绘制的ABTS标准曲线。表2为消化酶处理前后玉米低聚肽的ABTS自由基清除能力。可以看出模拟胃环境消化处理提高了玉米低聚肽的ABTS自由基的清除能力,提高幅度为25.47%;同时模拟肠环境消化处理也提高了玉米低聚肽的ABTS自由基的清除能力,提高幅度为1.39%。毛小雨[27]以芸豆蛋白为研究对象,结果表明胃肠道消化提高了芸豆蛋白ABTS自由基的清除能力。产生这种现象的原因可能是胃、胰蛋白酶处理使得玉米低聚肽的不同肽段中的抗氧化氨基酸残基更加充分暴露而使总抗氧化活性有了较大幅度提升。
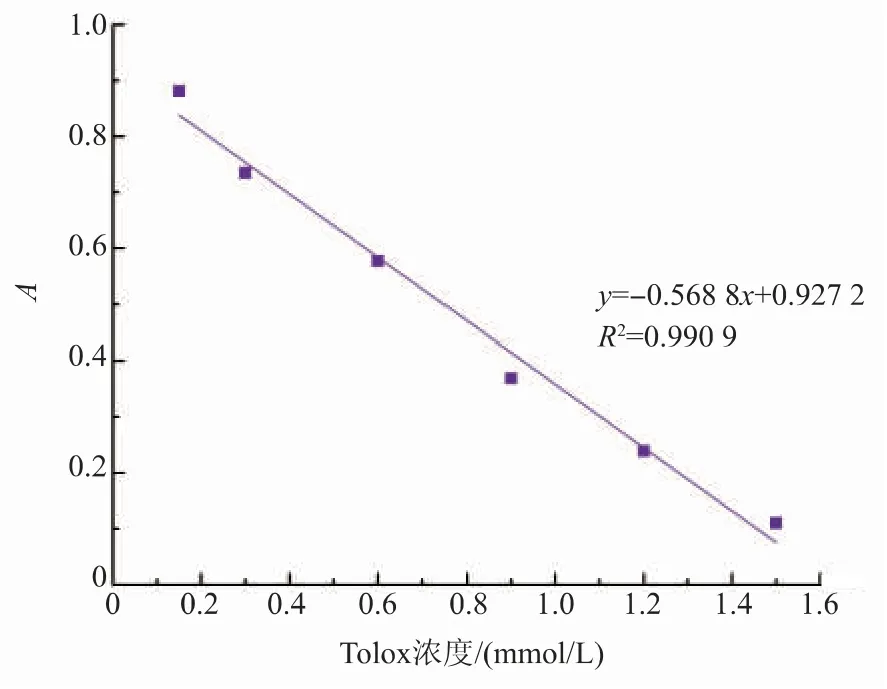
图3 ABTS标准曲线Fig.3 ABTSstandard curve
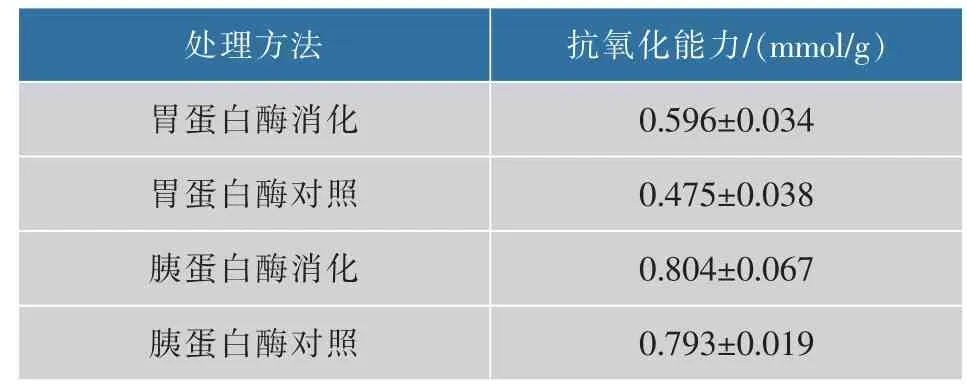
表2 不同处理的玉米低聚肽对ABTS自由基清除作用Table 2 ABTS free radical scavenging effect of corn oligopeptides with different treatments
2.5 消化前后玉米低聚肽的ORAC值
ORAC法被译为抗氧化能力指数或氧自由基清除能力,是基于氢原子转移的评价方法,采用荧光定量,灵敏度高。不同浓度Trolox标准品的动态荧光衰减曲线见图4,绘制的标准曲线如图5所示,玉米低聚肽消化前后ORAC值的变化结果如表3所示。模拟胃肠消化使得玉米低聚肽的ORAC值降低了10.4%;而胰蛋白酶消化使得玉米低聚肽的ORAC值提高了1.4%。这与豌豆低聚肽经模拟胃肠消化后的变化规律一致[20]。可能是由于胃蛋白酶特异性酶解了部分具有高活性的肽段,使得低聚肽的氧自由基清除能力有一定的降低。在模拟肠道消化条件下,一些肽段被胰蛋白酶特异性酶解成如二肽或三肽以及氨基酸,某些相对分子质量越小的肽段抗氧化活性越强,从而提高ORAC值[28]。
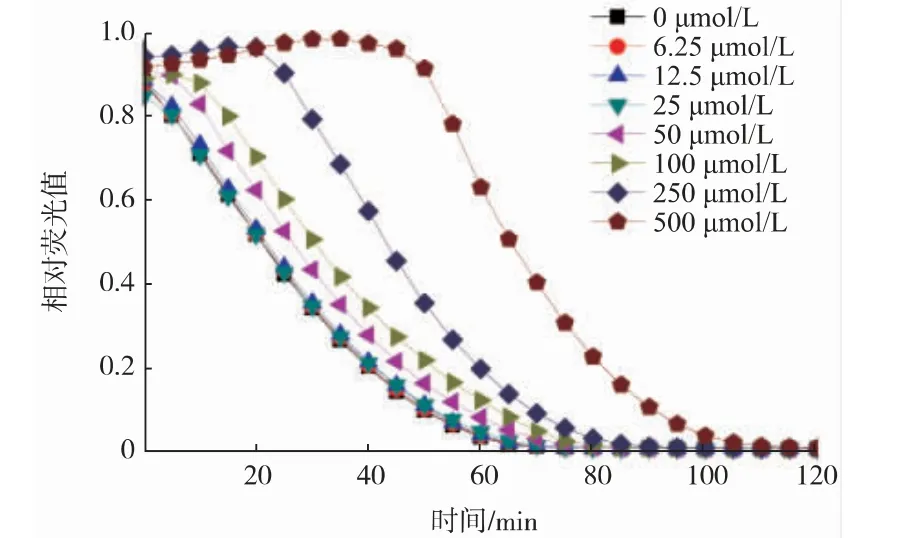
图4 不同浓度Trolox的动态荧光衰减曲线Fig.4 Dynamic fluorescence attenuation curve of Trolox at different concentrations
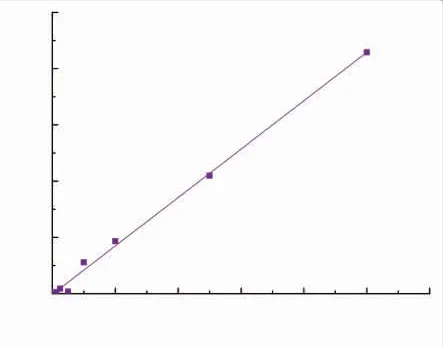
图5 Trolox标准曲线Fig.5 Trolox standard curve
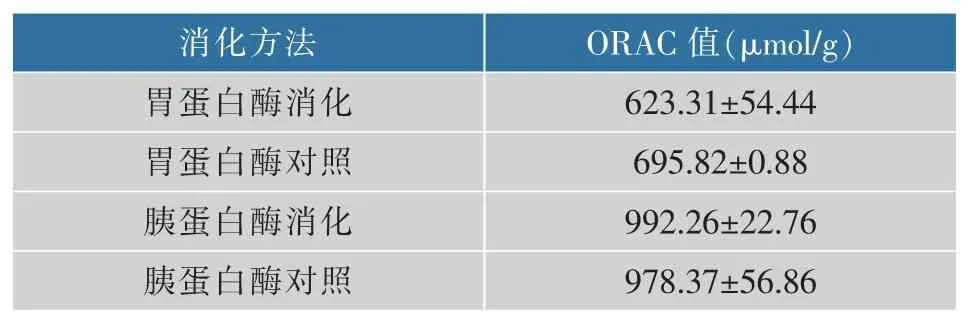
表3 不同处理的玉米低聚肽的ORAC值Table 3 ORAC values of corn oligopeptides with different treatments
2.6 消化前后玉米低聚肽对HSC增殖的影响
以未加入玉米低聚肽的HSC为空白对照,经数据处理分析得到结果如图6所示。在细胞生长过程中加入不同消化处理、不同质量浓度(50、100、200、400μg/mL)的玉米低聚肽,均能使得HSC细胞增殖速度加快,但量效关系不明显,且与空白对照组增殖速度相比差别不明显(P>0.05)。说明玉米低聚肽在试验浓度范围内均不会影响HSC的正常生长。综合细胞增殖实验结果,选择100、400μg/mL作为测定消化前后玉米低聚肽对细胞ROS清除能力的质量浓度。

图6 玉米低聚肽对HSC增殖的影响Fig.6 Effect of corn oligopeptides on HSC proliferation
2.7 消化前后玉米低聚肽对HSC中ROS生成的影响
ROS是生物体中内源性和外源性氧自由基的总称,当机体机能正常时,机体内自由基生成和清除能力相平衡;当受到紫外线、金属离子刺激及体内炎症反应发生时,将引起细胞内ROS水平的升高,过量的ROS会进攻细胞的脂质膜、DNA等,进而诱发相关疾病[29-30]。由图7可知,相对于空白组,阳性模型组细胞内ROS含量显著提高约40%~60%(P<0.05),表明ROS阳性模型建立成功。玉米低聚肽作用后对细胞内ROS具有明显的清除能力,相对于阳性模型组,降低了约20%~30%(P<0.05)。模拟胃环境消化后,100μg/mL和400μg/mL玉米低聚肽的ROS清除能力增强了,分别增强了1.42%、16.78%,模拟肠环境消化后降低了100μg/mL玉米低聚肽的ROS清除能力,降低了1.71%,而400μg/mL玉米低聚肽对ROS清除能力提高了2.61%,但模拟胃肠液消化后对其ROS清除能力均没有显著性影响(P>0.05)。由此可见,不同质量浓度的玉米低聚肽经胃肠消化后对ROS清除能力不同,经模拟胃环境和模拟肠环境消化后玉米低聚肽的抗氧化活性有所不同,可能是因为两种酶的作用位点和作用机理不同,使得肽水解成不同的肽段,从而造成抗氧化作用的不同。
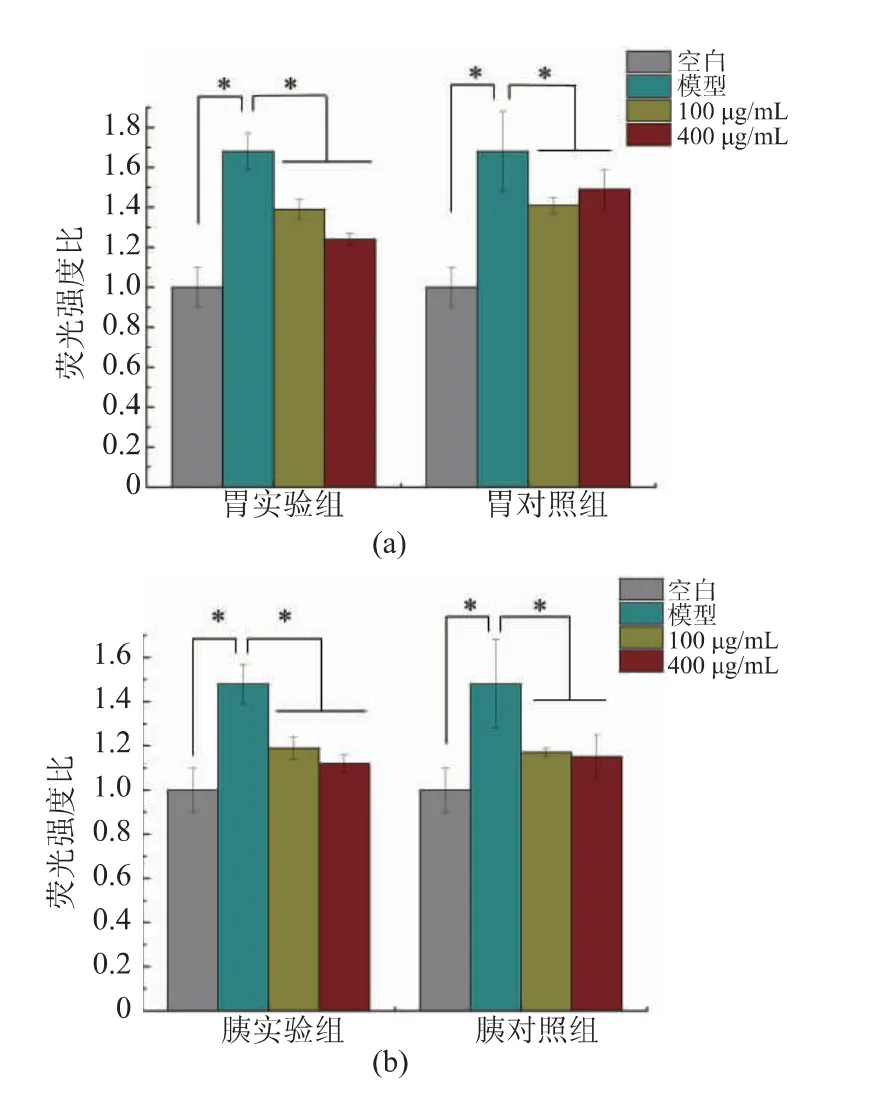
图7 玉米低聚肽对HSC中ROS生成的影响Fig.7 Effect of corn oligopeptides on ROS generation in HSC
3 结 语
以两步酶解法工序加工玉米蛋白粉制备得到玉米低聚肽,通过测定相对分子质量分布、DPPH自由基清除能力、羟基自由基清除能力、ABTS自由基清除能力、ORAC值以及ROS试验,研究了模拟胃肠消化对玉米低聚肽抗氧化作用的影响。结果表明,玉米低聚肽的主要成分为相对分子质量低于1 000的短肽,模拟胃环境、模拟肠环境消化后重均相对分子质量分别降低1.47%、0.05%。模拟胃环境消化前后,DPPH自由基清除能力IC50值分别约为1.41、1.50 mg/mL,模拟肠环境消化前后,IC50值分别约为1.39、1.48 mg/mL;模拟胃环境消化前后,羟基自由基清除能力IC50值分别约为10.3、12.3 mg/mL,模拟肠环境消化前后,IC50值分别约为8.1、9.5 mg/mL;模拟胃环境和肠环境消化后,ABTS自由基清除能力分别增加了25.47%、1.39%;模拟胃环境消化后ORAC值降低了10.4%,模拟肠环境消化后ORAC值增加了1.4%;模拟胃环境消化后,100μg/mL和400μg/mL玉米低聚肽对ROS清除能力分别提高1.42%、16.78%,模拟肠环境消化后,100μg/mL玉米低聚肽对ROS清除能力降低1.71%,而400μg/mL玉米低聚肽对ROS清除能力提高2.61%。本试验证明玉米低聚肽在经模拟胃肠液消化后仍具有较强的抗氧化活性。
