人SNRPN基因在果蝇S2细胞中的功能研究*
2021-11-27武云浩李志然付杨博
于 骏,武云浩,何 辉,李志然,付杨博,陈 霞,2
(1南通大学医学院,江苏 226001;2南通大学第二附属医院妇产科)
在真核生物中RNA剪接体可以去除绝大多数前体mRNA内含子,并调控mRNA加工过程[1-2]。RNA剪接体参与多种疾病的发生,对细胞存活发挥至关重要的作用[3-5]。精子发生过程在果蝇和人类中高度保守[6-8],可以利用果蝇模型研究男性不育症。本实验拟采用UAS-Gal4系统构建人—果蝇模型,在果蝇S2细胞中实现人SNRPN(small nuclear ribonucleoprotein polypeptide N)基因过表达,观察人SNRPN基因对果蝇S2细胞RNA剪接体的影响,为构建人-果蝇相结合的研究模型奠定重要基础。
1 材料与方法
1.1 pUAS-HA-hSNRPN质粒构建利用Vector NTI软件设计引物,引物序列:F:5’-ATAAGAAT GCGGCCGCTATGACTGTTGGCAAGAGTAGCA-3’,R:5’-CTAGTCTAGACTAAGGTCTTGGTGGACGCAT-3’。PCR扩增hSNRPN片段,产物进行琼脂糖电泳,割胶回收电泳产物,采用胶回收试剂盒(AP-GX-50,美国Axygen公司)纯化PCR产物。用NotI和XbaI对纯化产物和pUAS-attB-HA空载质粒进行双酶切,并以T4连接酶连接,利用感受态细胞(DH5)对连接产物进行转化,涂布于含有氨苄(Ampicillin)抗性的LB固体培养基上,37℃培养过夜。挑选阳性菌落,采用质粒小量DNA提取试剂盒(AP-MN-P-250,美国Axygen公司)提取质粒,并对提取的质粒进行双酶切验证,并送测序比对。
1.2 S2细胞培养及转染果蝇S2细胞在含10%胎牛血清(04-001-1ACS,以色列Bioind公司)的果蝇Schneider培养基中培养。将S2细胞接种在6孔板上,待细胞生长至密度达到约80%时进行转染。使用Effectene Transfection Reagent进行转染,每孔转染0.8μg质粒,将待转染的质粒与6.4μL Enhancer混合,buffer EC补足至100μL,振荡混匀,静置5 min。然后加入20μL Effectene Transfection Reagent混匀。最后加入600μL Opti-MEM,吹打混匀后加入细胞中,培养48 h后进行后续实验。
1.3 Western blot检测果蝇S2细胞转染48 h后收样,加细胞裂解液PIPA,冰上静置15 min,12 000 g,4℃离心15 min,取上清测定蛋白浓度。10%SDSPAGE凝胶电泳分离蛋白,然后300 mA恒流2 h进行转膜,5%脱脂牛奶室温封闭1 h。分别用HA抗体(1∶1 000)和Tubulin抗体(1∶3 000)4℃孵育过夜,TBST洗膜3次,二抗室温孵育1 h,再洗膜3次后进行显影。
1.4 免疫荧光染色果蝇S2细胞转染24 h后,接种于置有圆形玻璃爬片的24孔板内,继续培养24 h后进行免疫荧光染色。4%多聚甲醛固定20 min,PBS洗涤3次。5%牛血清白蛋白(BSA)封闭30 min,加入U2A抗体(1∶1 000)室温孵育1 h,PBS洗涤3次。然后荧光二抗室温避光孵育1 h,Hoechst33342染核10 min。将圆形玻片置于普通载玻片上,加入抗荧光淬灭封片剂封片。通过荧光显微镜采集S2细胞免疫荧光图片,图片处理采用Adobe Photoshop CS5。
1.5 荧光定量PCR果蝇S2细胞转染48 h后,采用TRIzol法提取RNA。采用Prime Script RT Reagent Kit(RR037A,日本Takara公司)进行逆转录合成cDNA。反应条件:95℃预变性2 min,95℃变性15 s,60℃延伸20 s,共40个循环。每个基因的相对表达量按照内参的表达量进行标准化处理。GAPDH上游引物序列为5’-GTGGTGAACGGCCAGAAGAT-3’;下游引物序列为5’-GCCTTGTCAATGGTGGTGAA-3’。U2A上游引物序列为5’-GAGCTGAGCGACTTAGAGCC-3’;下游引物序列为5’-TACCGGGTTGATAAGCAGGC-3’。SmD3上游引物序列为5’-CGAGGCGGAGGACAACATGAAC-3’;下游引物序列为5’-GGCAGTATAAGGAATCGGATCTTGGAG-3’。SmB上游引物序列为5’-CATGAACTTGATCCTCGGCGACTG-3’;下游引物序列为5’-CCTCTGGCGGCGGTGGTC-3’。
1.6 统计学处理采用GraphPad Prism 5统计学软件进行数据分析处理。计量资料以±s表示,组间比较采用t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 构建pUAS-HA-hSNRPN质粒通过PCR扩增hSNRPN CDS片段,利用NotI和XbaI酶切位点连入pUAS-attB-HA载体。通过双酶切验证和测序验证确认已经成功构建了pUAS-HA-hSNRPN质粒。
2.2 Western blot检测HA-hSNRPN融合蛋白在果蝇S2细胞中利用Ub-Gal4驱动pUAS-HAhSNRPN质粒的表达。本实验设置3组,分别为Control组、Ub-GAL4组、Ub+UAS-HA-hSNRPN组。Western blot检测发现Control组、Ub-GAL4组不表达HA-hSNRPN融合蛋白,而在Ub+UAS-HAhSNRPN组中可以检测到HA-hSNRPN融合蛋白(图1)。

图1 Western blot检测HA-hSNRPN融合蛋白
2.3 免疫荧光染色检测HA-hSNRPN融合蛋白为了验证Ub-Gal4是否成功驱动pUAS-HA-hSNRPN质粒的表达,本实验通过免疫荧光染色方法检测HA-hSNRPN融合蛋白在果蝇S2细胞中的表达情况。结果显示,Control组中未观察到HA阳性细胞,而在Ub+UAS-HA-hSNRPN组中可见较多HA阳性细胞,提示HA-hSNRPN融合蛋白在果蝇S2细胞中成功表达(图2,见封二)。

图2 免疫荧光染色检测HA-hSNRPN融合蛋白的表达情况
2.4 异位表达hSNRPN对RNA剪接体关键蛋白U2A的影响为了验证hSNRPN基因对RNA剪接体关键蛋白U2A的影响,在果蝇S2细胞中转染Ub-Gal4和pUAS-HA-hSNRPN质粒实现人SNRPN基因的异位表达。免疫荧光染色检测显示,与Control组相比,异位表达hSNRPN组U2A蛋白表达水平显著降低,提示人SNRPN基因可以影响果蝇RNA剪接体关键因子U2A的表达水平(图3,见封二)。
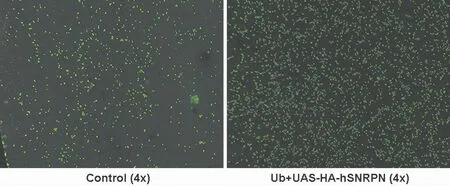
图3 免疫荧光染色检测U2A蛋白的表达水平
2.5 hSNRPN基因对果蝇RNA剪接体关键亚基表达水平的影响为了进一步验证hSNRPN对果蝇RNA剪接体的影响,异位表达hSNRPN后检测了果蝇RNA剪接体关键亚基mRNA的相对表达水平。qRT-PCR结果显示,与Control组相比,异位表达hSNRPN组U2A、SmD3、SmB mRNA相对表达水平明显降低,差异均具有统计学意义(P<0.001)(图4),提示异位表达hSNRPN降低RNA剪接体关键亚基的表达水平。

图4 RNA剪接体关键亚基表达水平
3 讨 论
RNA剪接体是高度保守的剪接复合体,主要由5个小核糖核蛋白颗粒(SnRNP)复合物(U1、U2、U4、U5和U6)和150种以上的相关蛋白组成[9]。许多RNA剪接体的核心组分被证实参与调控果蝇生殖干细胞的自我更新和分化[10-12]。有研究表明,Sm复合体核心亚基SmD3以及剪接体-核糖体关联蛋白Srlp可以通过RNA剪接体影响生殖干细胞的自我更新和分化过程[11-12]。有趣的是,RNA剪接体核心组分U2A在果蝇睾丸中影响精原细胞的分化过程,并可调控Mei-p26 mRNA的剪接[13]。SNRPA1既是U2A的人同源基因,也是人非梗阻性无精子症研究中鉴定到的候选相关基因[13]。在果蝇睾丸中异位表达SNRPA1突变体导致果蝇睾丸精原细胞分化障碍,提示RNA剪接体在人和果蝇睾丸精原细胞分化过程中高度保守。
SNRPN基因是果蝇SmD3的同源基因,主要在前体mRNA加工过程中发挥重要作用,并可能参与调控组织特异的选择性剪接[14]。有研究表明,SNRPN基因中CpG位点的甲基化模式可能与男性不育症相关[15]。MTHFR和SNRPN启动子区域的甲基化水平参与调控精子活力和精子形态,并可能介导男性不育的发生[16]。体外实验表明,下调SNRPN基因可显著抑制髓母细胞瘤的细胞生长能力,并诱导细胞G2/M期阻滞[17]。
本研究在果蝇S2细胞中构建了RNA剪接体相关人同源基因的异位表达模型,并发现人SNRPN基因在果蝇和人类中高度保守,可以直接调控果蝇S2细胞RNA剪接体的功能,为深入理解功能保守性基因提供了新的研究模型。同时,我们也发现人SNRPN基因在果蝇S2细胞中与果蝇RNA剪接体核心组分存在相互竞争作用,为RNA剪接体在精子发生障碍中的作用机制研究提供新的线索和思路。
