基于质谱流式细胞技术揭示TP53突变型乙型肝炎病毒相关性肝细胞癌的免疫微环境特征
2021-11-26詹国华胡嘉欣潘立鑫王秋雁向邦德
詹国华 胡嘉欣 潘立鑫 王秋雁 向邦德
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要组织学类型,占肝癌诊断和死亡的绝大多数[1]。长期以来,乙型肝炎病毒(hepatitis B virus,HBV)慢性感染一直被认为是HCC发生和发展的主要危险因素,其中全球超过一半的HCC病例均为HBV相关[2]。手术切除是HCC主要的治疗手段,而目前相比传统的手术切除,肿瘤的免疫疗法也成为研究的热点之一[3]。近年来,随着研究的不断深入,免疫疗法在HCC的临床应用中显示了巨大潜力[4]。肿瘤免疫微环境是一个复杂的生态系统,在疾病进展中发挥着关键作用。既往已有研究报道了HBV相关性HCC的肿瘤免疫微环境特征,这为开发HBV相关性HCC的免疫疗法提供了参考[5]。TP53是人类癌症中最常发生改变的基因之一,大约50%的侵袭性肿瘤存在该突变[6]。在HCC中,TP53突变也是最常见的突变,且深刻影响着HCC的发生、发展及预后。已有研究报道,TP53突变可导致HCC中的免疫反应下调,从而影响HCC表型[7]。但关于TP53突变的HBV相关性HCC的免疫微环境特点鲜有报道。本研究使用质谱流式细胞术(CyTOF)描绘TP53突变的HBV相关性HCC的免疫图谱,以期进一步了解其免疫微环境特征,为HCC的免疫治疗提出新见解。
1 材料与方法
1.1 标本收集及随访
收集2018—2019年于广西医科大学附属肿瘤医院肝胆胰脾外科接受肝切除术的38例患者的活体组织标本。纳入标准:术后病理均证实为HCC;以手术切除为初始治疗;既往未接受放疗、化疗等抗肿瘤治疗;无其他恶性肿瘤病史。本研究经广西医科大学医学伦理委员会批准。
本研究以门诊和电话形式对38例患者进行出院后随访,每隔6个月随访1次,随访内容包括肿瘤复发及其时间,术后辅助性治疗情况及治疗方案,患者死亡时间及原因。随访截至2021年6月11日,其中死亡10例(TP53突变组8例,TP53未突变组2例),失访3例。总生存期(overall survival,OS)定义为手术日至因HCC引起死亡或末次随访的时间。
1.2 主要仪器及试剂
细胞混旋仪、组织处理器购自德国美天旎生物技术有限公司,TD25⁃WS台式低速离心机购自湖南湘仪实验室仪器开发有限公司,Helios 2 CyTOF质谱流式细胞仪、DNA嵌入仪均购自Fluidigm公司。1.6%甲醛溶液购自Thermo Fisher公司,Fc受体阻滞剂、镧系金属、MaxPar X8抗体标记试剂盒、MaxPar PBS、Maxpar Cell Staining Buffer、顺铂、QTMFour Element Calibration Beads等均购自Fluidigm公司。
1.3 基因突变分析
本研究根据文献查阅并确定常见的TP53突变位点,并主要关注热点区域。首先,将提取的肝脏DNA标本送至上海翼和应用生物技术有限公司测序,后续过程包括文库构建,数据质控,序列比对,SNP calling,变异检测及过滤,变异注释等。其中,测序使用IlluminaX⁃10测序平台,测序模式为Paired⁃end,测序读长2×150 bp。变异筛选标准:⑴变异处测序总深度大于30;⑵变异在该处的总深度比例大于1%;⑶变异位点的质量值Q=-10lgP>10。对测序后的数据进行基因突变信息统计,并将发生TP53特异位点突变的样本定义为TP53突变组。
1.4 GyTOF标志物的标记与检测
按照文献[8]报道方法,解离组织,制备单细胞悬液,完成后将细胞悬液保存在液氮中。根据说明书,使用MaxPar X8抗体标记试剂盒并将选定的抗体连接到同位素标签上。从每个样本中提取100万个活细胞,用MaxPar PBS配制顺铂(比例为1∶10 000),并将细胞染色,以确定细胞存活率。细胞悬液用人Fc受体阻断剂室温孵育10 min,再用表面抗体孵育1 h,然后洗涤。接着用核抗原染色缓冲液(25℃)孵育30 min,用细胞内抗体孵育1 h,洗涤后在室温下用1.6%多聚甲醛新鲜溶液孵育10 min,然后用DNA嵌入仪于4°C孵育过夜。上机检测前,用10%的EQTM四元素校准小球再悬浮细胞,然后用Helios 2 CyTOF质谱流式细胞仪以小于500个事件/秒的速率分析标记样本。CyTOF的实验操作流程见图1。
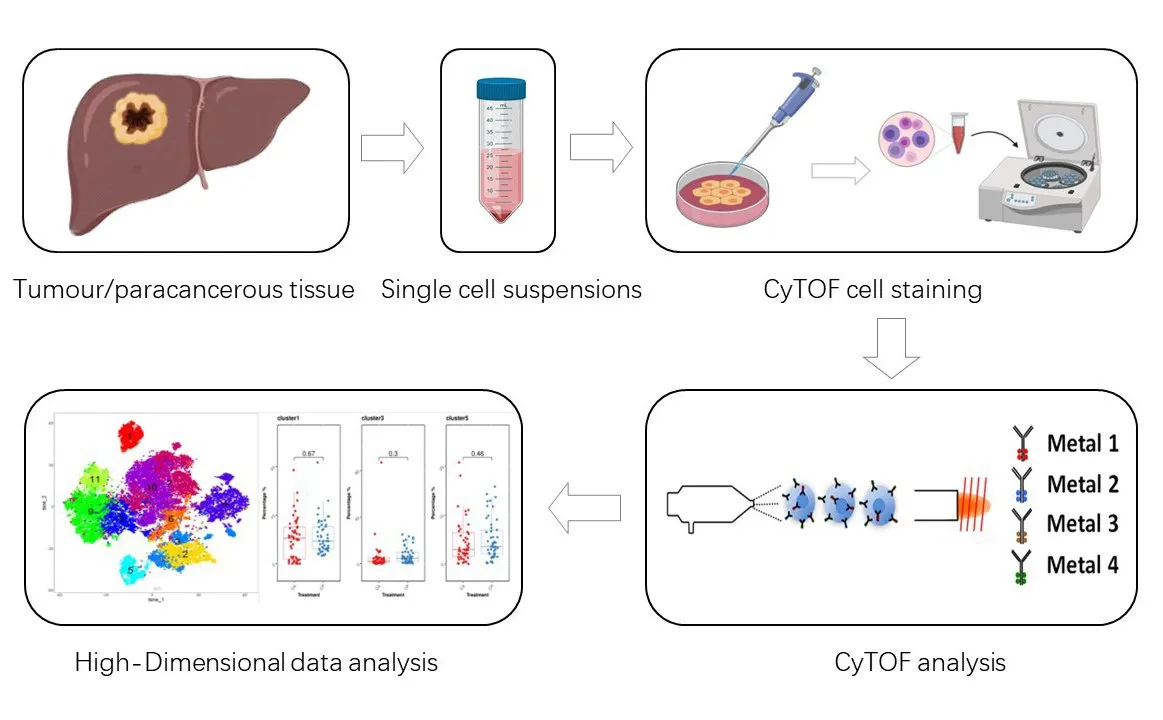
图1 质谱流式细胞术的实验操作流程Fig.1 Experimental process of mass cytometry
1.5 CyTOF的数据分析
CyTOF应用单细胞理论,使用金属同位素标记的抗体,允许在单个细胞中同时检测多达40个参数。CyTOF克服了传统流式通道之间发射光谱信号重叠的影响,能精确分析细胞亚群[9]。在Helios 2 CyTOF质谱流式细胞仪上进行检测分析,检测速度每秒小于500个细胞。本研究采集样本数据后,统一使用CyTOF软件v6.7对FCS数据文件进行标准化合并处理。使用在线网站Cytobank(https://www.cytobank.org/)R 语言包(cytofkit、Rtsne、FlowSOM、cytofexplorer、ggplots等)分析FCS数据文件。
1.6 统计学方法
采用SPSS 17.0和R 4.1.0软件对数据进行分析。临床基线资料之间的对比采用Fisher确切概率法;TP53突变组与TP53未突变组的OS比较采用R 4.1.0软件中的survival包绘制生存曲线,采用Log⁃rank检验评估两组生存曲线的差异;TP53突变组(TP53未突变组)癌组织和癌旁组织的细胞亚群比例差异比较采用配对t检验,TP53突变组与TP53未突变组癌组织细胞亚群比例差异比较采用独立样本t检验;采用R 4.1.0中的heatmap包绘制热图。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
根据纳入标准,本研究共收集了38例HBV相关性HCC患者癌组织及其相对应癌旁组织标本,其中TP53突变⁃HBV相关性HCC(TP53突变组)19例,TP53未突变⁃HBV相关性HCC(TP53未突变组)19例,TP53突变组与TP53未突变组患者的年龄、性别等临床基线资料分布,差异均无统计学意义均(P>0.05),见表1。
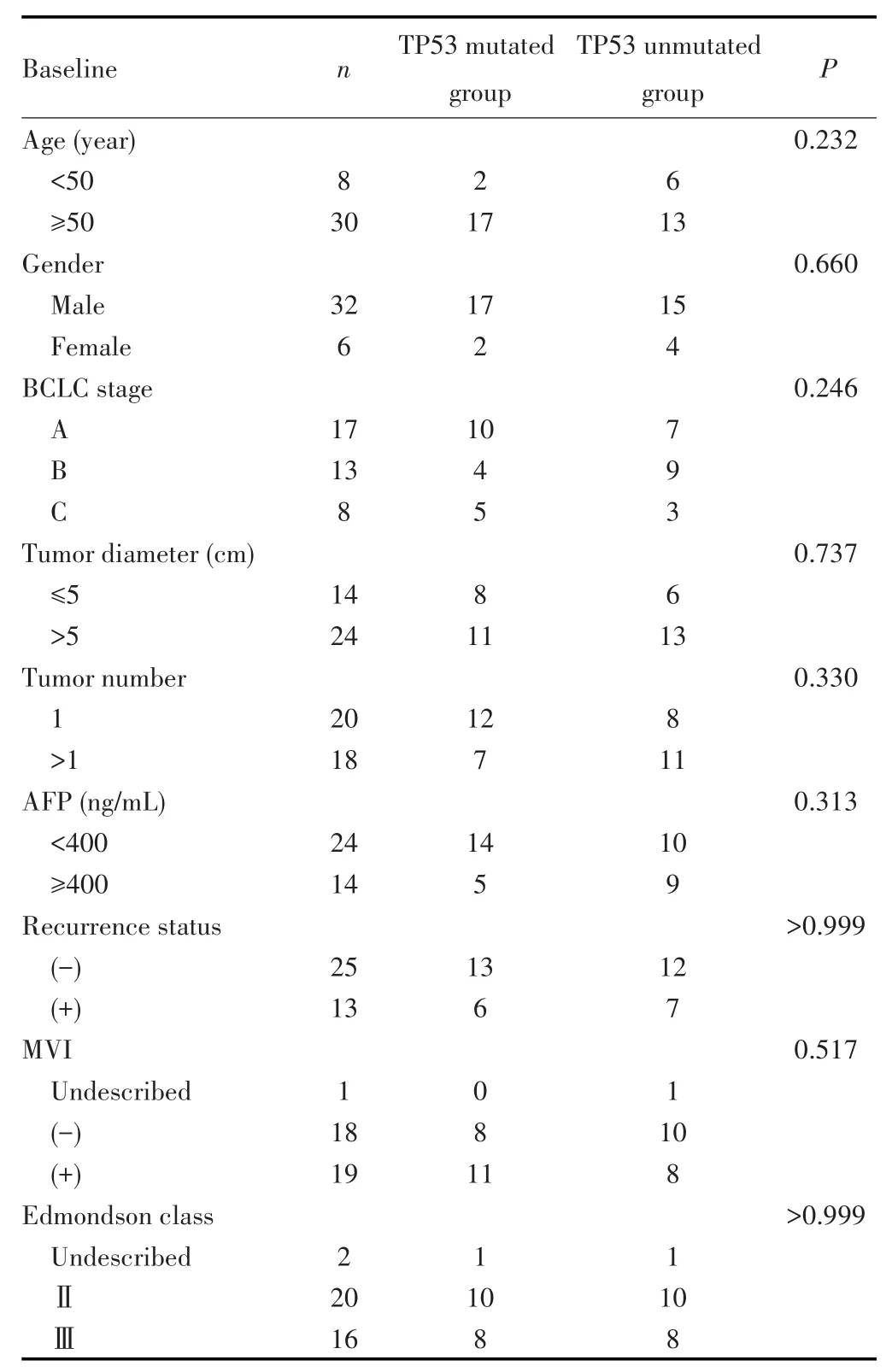
表1 TP53突变组和TP53未突变组患者的临床基线资料Tab.1 Clinical baseline information of cases in the TP53 mutated group compared to the TP53 unmutated group
2.2 预后分析
生存分析结果显示,TP53突变组与TP53未突变组的1年生存率分别为68.42%和93.75%,TP53突变组和TP53未突变组的生存曲线比较差异无统计学意义(P=0.24),见图2。
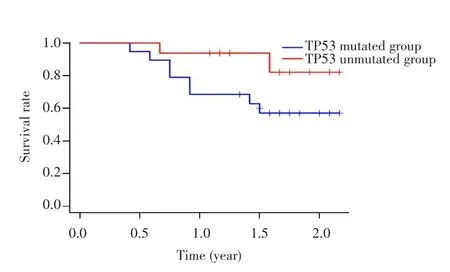
图2 TP53突变组和TP53未突变组的生存曲线Fig.2 Survival curves of TP53 mutated group and TP53 unmutated group
2.3 CyTOF鉴定细胞亚群
采用CyTOF鉴定TP53突变组和TP53未突变组的所有免疫细胞,结果鉴定为22个细胞亚群,其中包括3个CD4+T细胞亚群(细胞亚群1、8、14)、9个CD8+T细胞亚群(细胞亚群2、4、5、6、7、9、10、19、21)、1个B细胞亚群(细胞亚群20)、1个树突(dendritic cells,DC)细胞亚群(细胞亚群3)、3个自然杀伤(natural killer cell,NK)细胞亚群(细胞亚群11、15、16)、2个NKT细胞亚群(细胞亚群12、13)、1个粒细胞亚群(细胞亚群22)和2个未知细胞群,见图3~4。
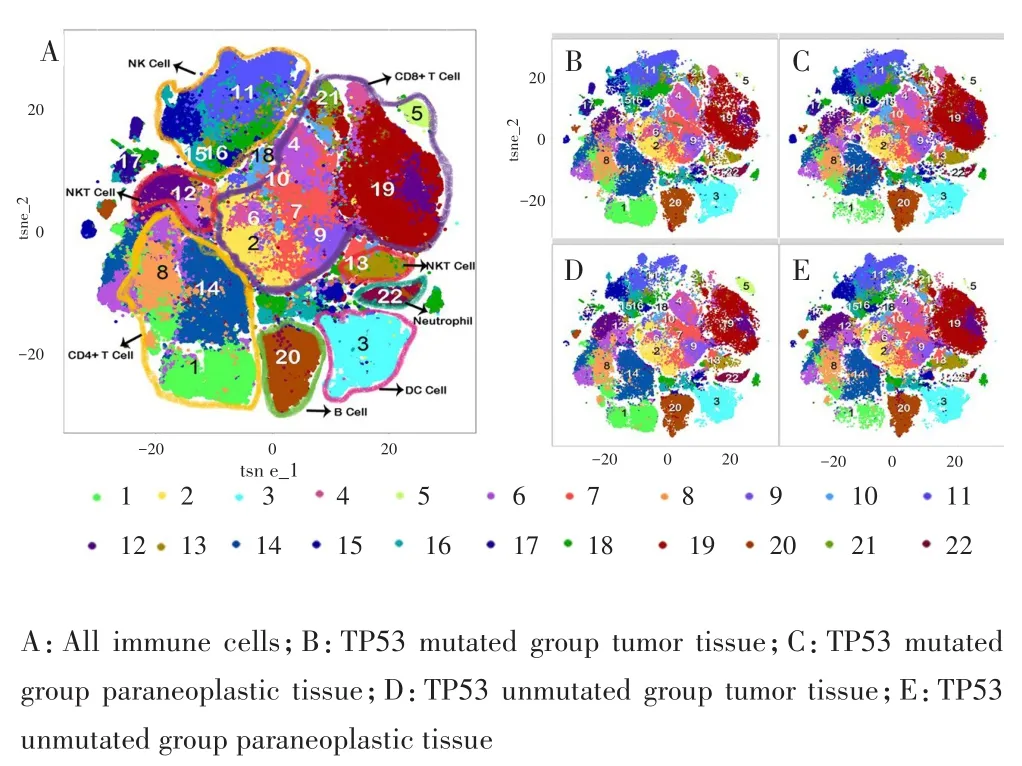
图3 TP53突变组和TP53未突变组的细胞亚群分布Fig.3 Distribution of cell subsets in TP53 mutated group and TP53 unmutated group
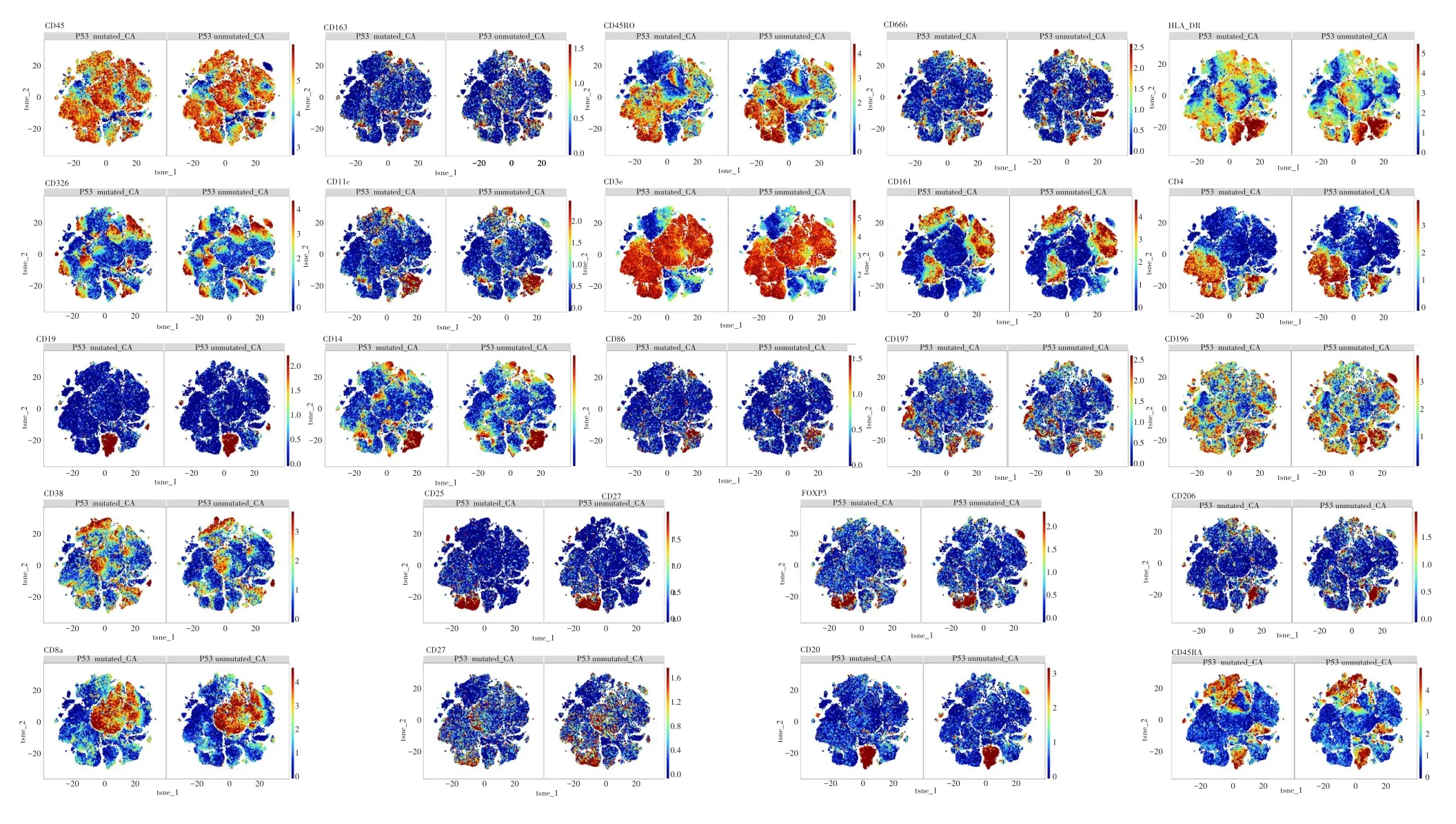
图4 TP53突变组和TP53未突变组癌组织中免疫标志物的表达情况Fig.4 Expreesion of immunomarker of tumor tissues between TP53 mutated group and TP53 unmutated group
2.4 TP53突变组和TP53未突变组的免疫微环境特征比较
对各组所含有细胞亚群的比例进行比较,TP53突变组的各细胞亚群比例箱式图和火山图显示,癌组织中CD4+T细胞(细胞亚群1、14)比例较高(P<0.05),而CD8+T细胞(细胞亚群10、19)、NK细胞(细胞亚群11)及NKT细胞(细胞亚群13)比例低于癌旁组(P<0.05),见图5。TP53未突变组也显示,癌组织中CD4+T细胞(细胞亚群1、14)比例较高(P<0.05),而CD8+T细胞(细胞亚群7、9、10、19)、NK细胞(细胞亚群11)和NKT细胞(细胞亚群13)比例低于癌旁组(P<0.05),见图6。在TP53突变组和TP53未突变组癌组织各细胞簇比例箱式图中,TP53突变组中CD8+T细胞(细胞亚群10)和CD4+T细胞(细胞亚群8)的比例均较TP53未突变组高(2.26%vs0.47%,P=0.028;7.53%vs3.55%,P=0.046),见图7。
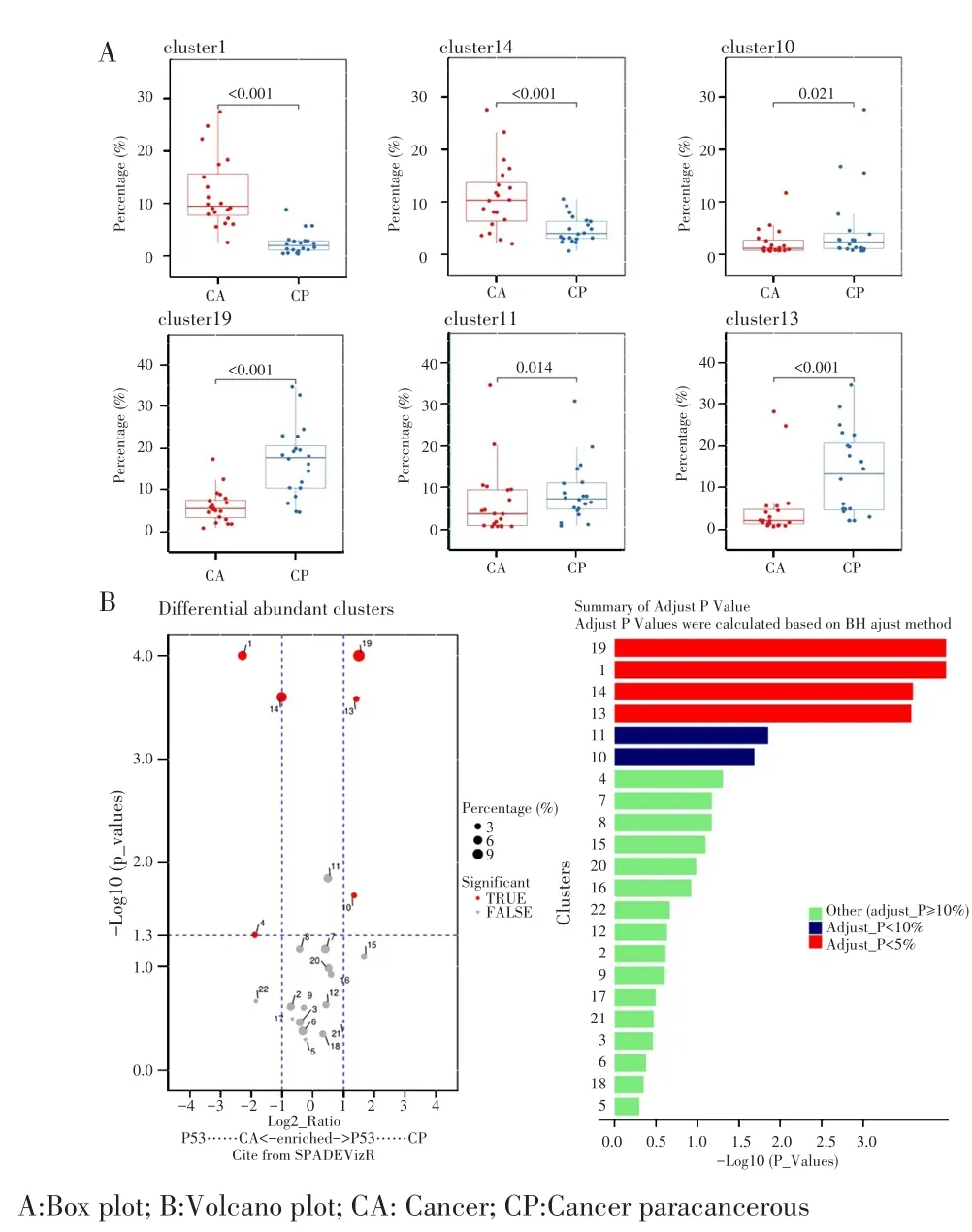
图5 TP53突变组癌组织和癌旁组织的各细胞群比例Fig.5 Proportion of cell population in tumor and paraneoplastic tissues of the TP53 mutated group

图6 TP53未突变组癌组织和癌旁组织的各细胞群比例Fig.6 Proportion of cell population in tumor and paraneoplastic tissues of the TP53 unmutated group
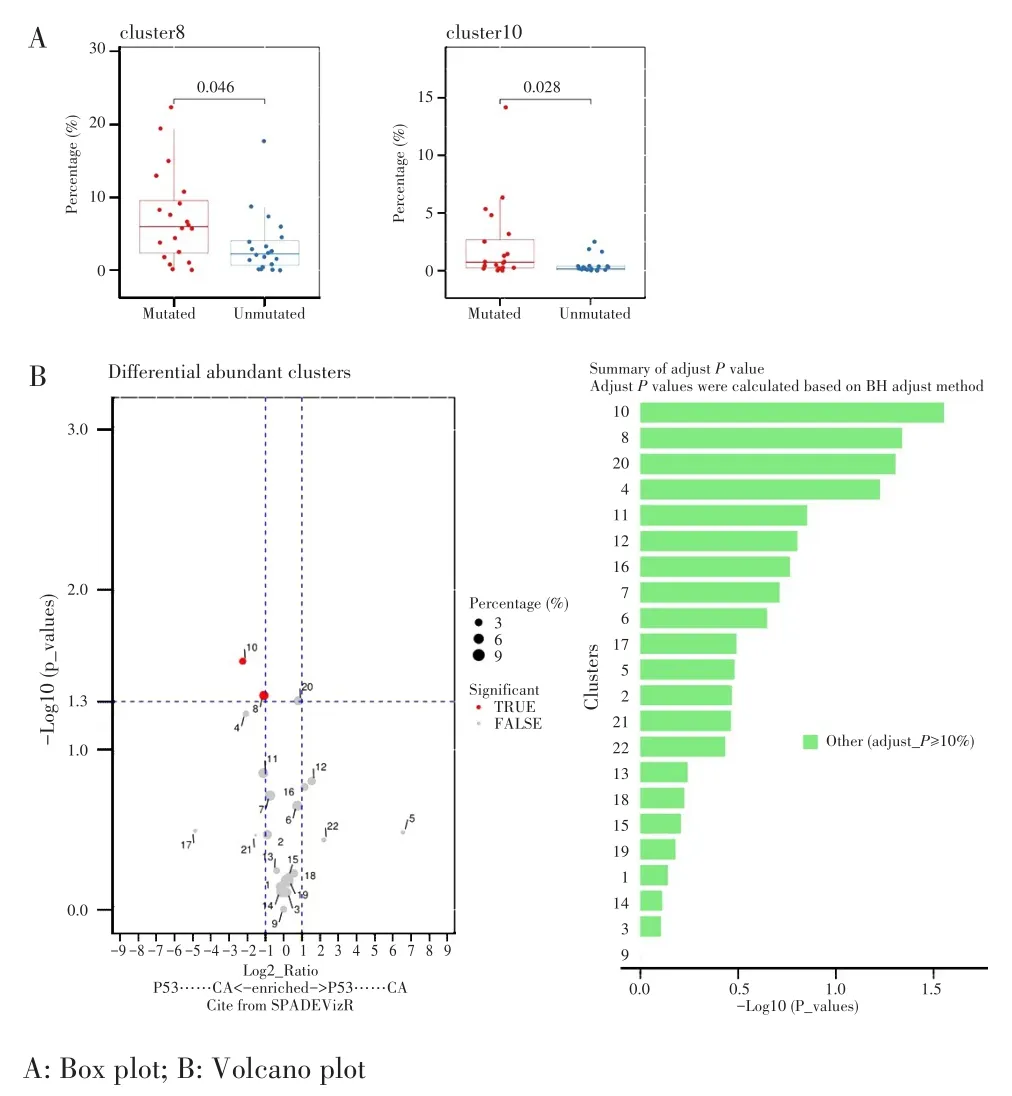
图7 TP53突变组和TP53未突变组癌组织的各细胞群比例Fig.7 Proportion of cell population in tumor tissues of the TP53 mutated group and TP53 unmutated group
2.5 TP53突变组和未突变组癌组织免疫细胞亚群的标志物表达
基于对上述TP53突变组中CD8+T细胞和CD4+T细胞比例较高这一结果,进一步分析突变组和未突变组癌组织中各免疫细胞亚群相关标志物表达情况。细胞亚群免疫标志物的表达情况的热图显示,突变组与未突变组癌组织差异表达的CD8+T细胞亚群表达活化细胞标志分子CD45RA,细胞凋亡信号通路分子GranzymeB和激活分子HLA⁃DR,而CD4+T细胞亚群则表达CD45RO和HLA⁃DR,见图8。
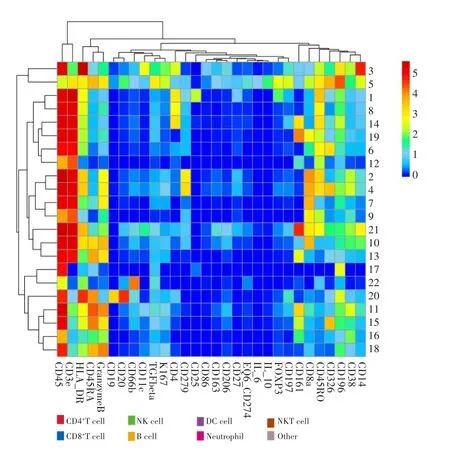
图8 各细胞亚群免疫标志物表达情况的热图Fig.8 Heatmap of immune marker expression by cell subtype
3 讨论
既往多项研究对癌症免疫治疗反应相关分子特征进行鉴定,如肿瘤细胞中的肿瘤突变负荷、错配修复、新抗原等[10⁃11]。癌症中抑癌基因蛋白 TP53突变经常发生,且与癌症不良预后相关[12]。有研究表明,TP53通过促进细胞周期阻滞和细胞凋亡,在抑制肿瘤发展中发挥重要作用[13],且与肿瘤免疫调节有关[14⁃15],如TP53激活可增强抗肿瘤免疫[16]。然而,当TP53突变时,抗肿瘤效应的丧失会导致细胞增殖异常并促进癌症发生[17]。在肺癌研究中发现TP53突变与其治疗耐药性增加及预后较差有关[18]。TP53突变也是HCC中最常见的突变之一[19],有研究发现TP53突变状态与肿瘤微环境有关[20]。也有研究表明,TP53突变的免疫原性是由复杂的动力学驱动,可能包括人类白细胞抗原(human leukocyte antigen,HLA)在肿瘤或抗原提呈细胞(antigen presenting cell,APC)上的表达、T细胞抗原受体(T cell receptor,TCR)的亲和性、T细胞向肿瘤微环境的转运等[21]。因此推测,TP53突变可能对HBV相关性HCC患者免疫微环境具有一定影响。CyTOF是利用质谱原理对单细胞进行多参数检测的流式技术,可用于鉴定表达特定蛋白的细胞的大规模细胞计数方法。这种技术能够在单细胞水平同时分析超过50种细胞参数,包括蛋白质、核酸甚至小分子,从而实现对细胞的精细分群,深入细胞内部对信号通路、细胞增殖、细胞周期等进行精细分析。目前,CyTOF已在肾癌[22]、乳腺癌[23]等多种实体瘤分析中发挥重要作用。为阐明TP53突变状态下HBV相关性HCC的免疫微环境特征,本研究利用CyTOF对TP53突变组和TP53未突变组进行免疫微环境研究。首先应用CyTOF鉴定两组的所有免疫细胞,结果将两组的所有免疫细胞分为22个细胞亚群,从各细胞亚群比例箱式图观察到TP53突变组癌组织中CD4+T细胞比例较高,而癌旁组织中CD8+T细胞、NK细胞和NKT细胞比例较高。同样地,在TP53未突变组也出现上述情况。但是在TP53突变组与TP53未突变组癌组织比较中,TP53突变组主要以CD4+T细胞、CD8+T细胞和NK细胞为主,TP53未突变组则以CD8+T细胞、B细胞、DC细胞NKT细胞为主。有文献报道,在TP53突变的乳腺浸润性癌和肺癌中CD8+T细胞、NK细胞和免疫溶细胞活性具有更高的富集水平[24],与本研究结果一致。此外,有研究显示,肝癌中的免疫细胞亚型也会影响患者预后[25],但是遗憾的是,本研究中所鉴定的22个细胞亚群,并未发现与预后相关的免疫细胞亚群,考虑原因可能与本研究病例数较少、随访时间较短有关,这一方面值得深入探究。
根据肿瘤免疫编辑假说,肿瘤发展过程中,具有免疫原性的癌细胞较少,因此规避了抗肿瘤的免疫反应[26]。而这也可能导致免疫抑制细胞(如调节性T细胞和肿瘤相关巨噬细胞)增加,免疫反应细胞(如T细胞滤泡性辅助细胞)减少[7]。例如,在TP53高危肺鳞状细胞癌患者中单核细胞和M1巨噬细胞浸润率普遍高于低危患者,高危患者的辅助性CD8+T细胞和T细胞比例更低[27]。本研究观察到TP53突变组中CD8+T细胞(细胞亚群10)和CD4+T细胞(细胞亚群8)比例较高,根据各免疫标志物表达情况得出该CD8+T细胞亚群表达活化细胞标记分子CD45RA,以及参与调控细胞凋亡的信号通路分子GranzymeB和激活分子HLA⁃DR,表明该细胞群为初始性CD8+T细胞;而CD4+T细胞亚群则表达CD45RO和HLA⁃DR,可能为记忆性CD4+T细胞。类似地,有研究发现在小鼠突变的TP53肉瘤细胞生长过程中,也产生了针对新抗原的CD8+T和CD4+T细胞[28]。由此可见,当TP53突变体被有效地处理和呈现免疫原性,可能产生癌症特异性免疫反应。综上所述,在HBV相关性HCC中,相对TP53未突变的HBV相关性HCC,TP53突变下的HBV相关性HCC中主要富集初始性CD8+T细胞和记忆性CD4+T细胞,且与肿瘤微环境的免疫作用有关,具有免疫异质性,但这2个细胞亚群中是否还存在其他产生影响的免疫分子,仍需进一步研究。
