环状RNA circUGGT2对结直肠癌细胞增殖、迁移和侵袭的影响
2021-11-26赖家骏周新栋胡志伟何盛泉李定云翁伟明曾德强朱晓峰张涛龙飞
赖家骏 周新栋 胡志伟 何盛泉 李定云 翁伟明 曾德强 朱晓峰 张涛 龙飞
结直肠癌(colorectal cancer,CRC)是全球第三大常见癌症,也是第二大癌症相关死亡原因[1]。据估计,我国2015年CRC的发病例数约为38.8万例,死亡约为18.7万例,均居全部恶性肿瘤前列[2]。因此,深入探讨CRC发生发展的分子机制,寻找CRC早期诊断和复发转移靶点具有重要意义。环状RNAs(circular RNAs,circRNAs)是一类不具有5′末端帽子和3′末端多聚A尾巴,并以共价键形成环状结构的非编码RNAs分子。circRNAs是一类新的内源性RNAs,大量研究[3⁃5]显示,circRNAs与肿瘤发生发展密切相关,其在CRC中的作用也日益受到关注。本课题组前期从GEO数据库的CRC circRNA芯片数据(GSE126094)[6]筛选出了237个在CRC组织中显著上调的circRNAs(log2FC≥2,P<0.05),其中包括circUGGT2(circBase ID为hsa_circ_0008274)。但是,circUGGT2对CRC生物学行为的影响尚未知。本研究在CRC组织和细胞系中检测circUGGT2的表达,并探讨其对CRC细胞增殖、迁移和侵袭的影响,以期为CRC诊断和治疗寻找新的靶点。
1 材料和方法
1.1 组织标本、细胞系及主要试剂
收集2018年9月至2019年3月在粤北人民医院胃肠外科接受手术治疗的45例CRC患者的CRC组织和癌旁组织(距癌灶边缘5 cm以上的结直肠黏膜组织)标本。所有患者术前均未接受化疗、放疗等抗肿瘤治疗。本研究通过粤北人民医院伦理委员会审批,患者知情同意。
人正常结肠上皮细胞株NCM460和4种CRC细胞株HT29、HCT116、SW480、SW620均购自南京凯基生物技术股份有限公司。胎牛血清购自以色列Biologi⁃cal Industries公司;RPMI⁃1640培养基、McCoy′s 5A培养基、L15培养基均购自美国Gibco公司;TRIzol试剂、LipofectamineTM3000试剂均购自美国Invitrogen公司;核酶(RNase R)购自广州吉赛生物科技股份有限公司;放线菌素D(Act.D)购自美国Sigma公司;Transwell小室购自美国Corning公司;引物均由北京擎科生物科技有限公司(长沙合成部)设计合成;特异性的小干扰RNA(si⁃circUGGT2)和相应的阴性对照(si⁃NC)均由苏州吉玛基因股份有限公司设计并合成。
1.2 细胞培养及转染
NCM460细胞在含10%胎牛血清和1%青链霉素混合液的RPMI⁃1640培养基中培养;HT29和HCT116细胞在含10%胎牛血清和1%青链霉素混合液的McCoy′s 5A培养基中培养;SW480和SW620细胞在含10%胎牛血清和1%青链霉素混合液的L15培养基中培养。上述细胞均经过STR鉴定,并置于37℃、5% CO2的细胞培养箱中培养。
选取处于对数生长期的SW480细胞接种于6孔板中,转染前予以正常换液,保证细胞状态良好。待细胞密度约为70%时,按照LipofectamineTM3000试剂说明书的操作步骤,将si⁃circUGGT2和si⁃NC分别转染到SW480细胞,孵育48 h后进行敲减效率验证和后续的功能实验。
1.3 qRT⁃PCR检测circUGGT2和UGGT2mRNA的表达
使用TRIzol试剂提取组织和细胞中的总RNA,按照ReverTra Ace qPCR RT Master Mix with gDNA Re⁃mover试剂说明书的操作步骤将RNA逆转录为cDNA后,再按照KOD SYBR®qPCR Mix试剂说明书的操作步骤进行qRT⁃PCR扩增。 PCR反应体系(20 μL/孔):KOD SYBR®qPCR Mix 10 μL,正向引物和反向引物各 1 μL,ddH2O 6 μL,cDNA 模板 2 μL。PCR 反应条件:98℃预变性2 min;98℃变性10 s;60℃退火10 s;68℃延伸30 s,共40个循环。以GAPDH为内参,采用“相对定量法(2-△Ct)”计算相对表达量,采用2-△△Ct法计算倍数变化值(fold change,FC)。引物序列见表1。

表1 引物序列Tab.1 The sequences of the primers
1.4 核酶消化实验和放线菌素D实验
用3 U/μg的核酶处理SW480细胞的RNA,于37℃孵育15 min后等体积逆转录,再采用qRT⁃PCR分别检测circUGGT2和UGGT2 mRNA的相对表达量。另将 SW480细胞接种在含放线菌素 D(5 μg/mL)的L15培养基中,分别培养0 h、4 h、8 h、12 h或24 h以抑制RNA的生成,然后在各个时间点分别提取细胞中的总RNA,采用qRT⁃PCR检测circUGGT2和UGGT2 mRNA的相对剩余量(%)。qRT⁃PCR扩增方法同步骤1.3。
1.5 CCK⁃8实验检测细胞的增殖能力
将SW480细胞接种至96孔板中常规培养,每组设置5个复孔。分别于培养0 h、24 h、48 h、72 h时,向每孔加入浓度为10%的CCK⁃8试剂,于37℃培养箱中孵育2 h后,使用多功能酶标仪检测450 nm波长处的光密度(OD)值。
1.6 平板克隆形成实验检测细胞的增殖能力
将SW480细胞接种至6孔板(约1 000/孔)中,每组设置3个生物学重复。加入2 mL新鲜完全培养基,置于37℃、含5% CO2的细胞培养箱中培养,每隔3~4 d更换1次新鲜培养基。培养10~12 d后,当孔中出现肉眼可见的细胞克隆球时,终止培养。弃去培养基,用PBS清洗2遍,4%多聚甲醛固定30 min,0.1%结晶紫染色15 min,再用ddH2O洗去染色液,室温下自然干燥。拍照并计数各孔中的克隆球(>50细胞)数目。
1.7 划痕实验检测细胞的迁移能力
将SW480细胞接种至6孔板(约7×105/孔)中,培养过夜。待其融合密度达到90%~100%时,用10 μL枪头在细胞表面划痕,保证每条划痕粗细均匀一致。用PBS清洗3次,去除脱落的细胞,加入不含血清的培养基继续培养。分别于0 h、24 h和48 h进行拍照,观察划痕愈合的情况。
1.8 Transwell小室实验检测细胞的迁移和侵袭能力
使用Transwell小室进行细胞迁移和侵袭实验。对于侵袭实验,预先在Transwell小室上室铺被基质胶。将SW480细胞接种至Transwell小室上室(约1×105/孔),培养基体积为200 μL,不含血清;下室加入600 μL含有20%胎牛血清的培养基。37℃孵育36 h后取出小室,用4%多聚甲醛固定30 min,用0.1%结晶紫染色15 min,再用湿棉签轻轻拭去小室内表面细胞。在Olymbus倒置显微镜下观察并计算5个随机视野中的迁移或侵袭细胞数。
1.9 统计学方法
采用SPSS 20.0统计软件进行数据分析,Graph⁃Pad Prism 8.0软件进行绘图。计量资料采用均数±标准差表示;癌组织与癌旁组织中circUGGT2表达水平的比较采用配对样本t检验,非配对设计两组间均数比较则采用独立样本t检验;多组间比较采用单因素方差分析,若组间差异有统计学意义,则采用Dunnett′s检验进行多重比较;重复测量数据采用重复测量方差分析;分类资料比较采用χ2检验。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 circUGGT2的鉴定
采用qRT⁃PCR对circUGGT2进行成环验证和稳定性检测。从SW480细胞中提取其基因组DNA(gDNA)后,分别用circUGGT2的特异性扩增环状RNA引物(divergent primers)和特异性扩增线性RNA引物(convergent primers)进行扩增,结果只有convergent primers能扩增出特异性产物,表明circUGGT2可能是UGGT2基因转录后通过反向剪接生成的circRNA,见图1A。核酶消化实验和放线菌素D实验结果显示,circUGGT2很耐核酶消化,而UGGT2 mRNA则几乎被完全降解,见图1B;且circUGGT2的降解速度明显慢于UGGT2 mRNA(F=2133.00,P<0.001),见图1C。以上实验结果表明,circUGGT2是一个典型的circRNA,且具有高度的稳定性。
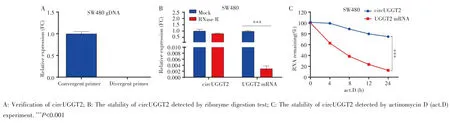
图1 circUGGT2的鉴定Fig.1 Identification of circUGGT2
2.2 circUGGT2在CRC组织中的表达及其诊断效能
用qRT⁃PCR检测45对CRC组织和癌旁组织中circUGGT2的表达水平,结果发现circUGGT2在CRC组织中的表达水平明显高于癌旁组织(t=4.13,P<0.001),见图2A。临床病理分析结果显示,circUGGT2的表达水平与CRC患者的肿瘤大小(χ2=5.15,P=0.023)、浸润深度(χ2=4.08,P=0.044)和TNM分期(χ2=6.42,P=0.011)均有关,见表2。根据circUGGT2在45对CRC组织和癌旁组织中的检测数据绘制ROC曲线,AUC为0.702(95%CI:0.595~0.809,P=0.001),提示circUGGT2具有较好的诊断效能,见图2B。
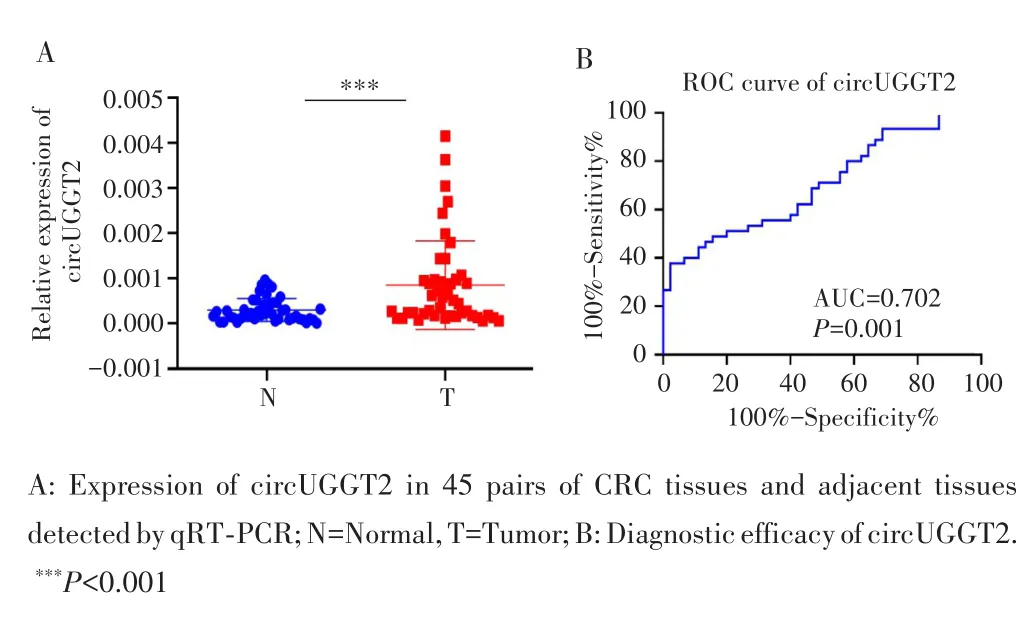
图2 circUGGT2在45对CRC组织及癌旁组织中的表达差异和诊断效能Fig.2 The expression differences and diagnostic efficiency of circUGGT2 in 45 pairs of CRC tissues and corresponding paracancerous tissues
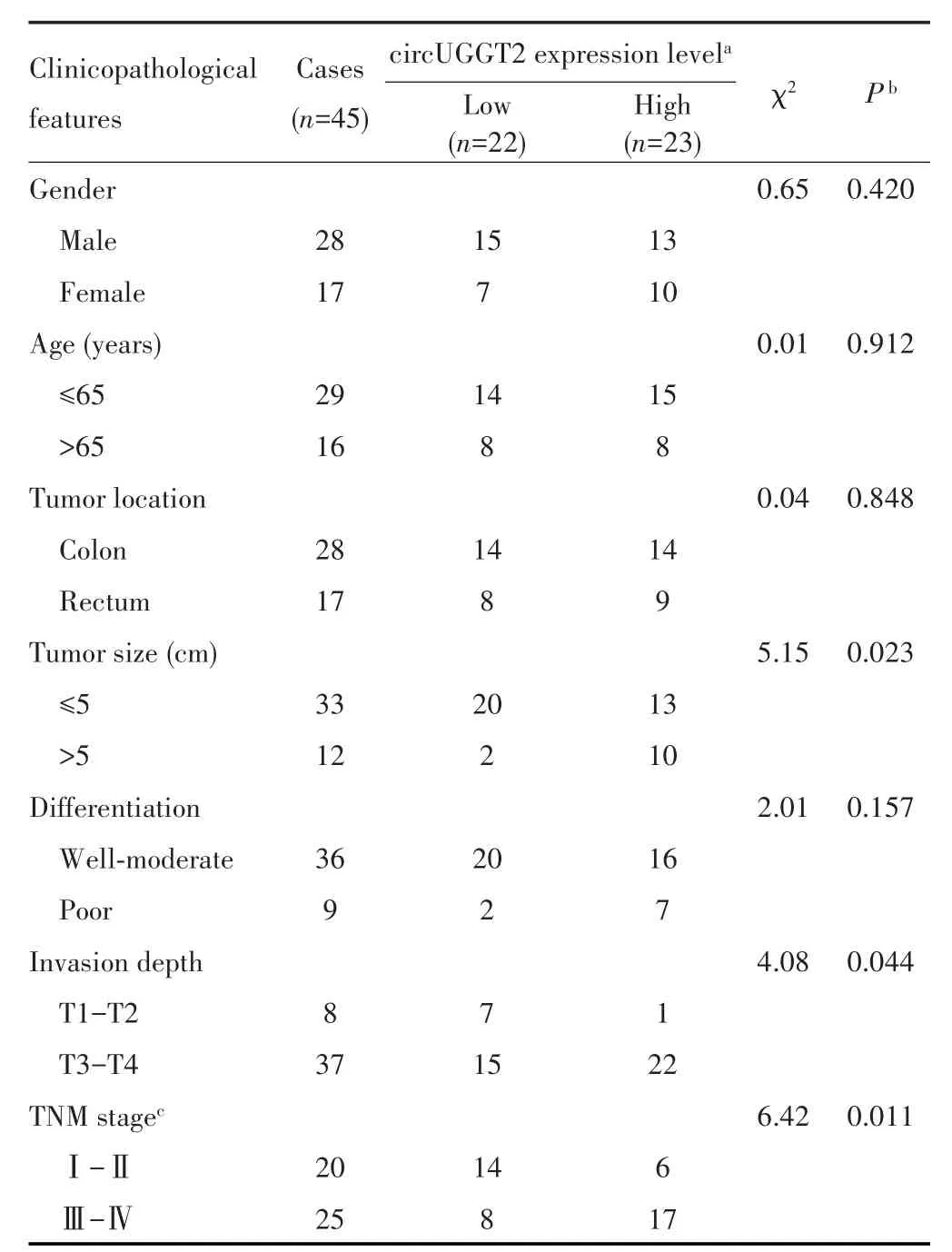
表2 circUGGT2表达与CRC患者临床病理特征的相关性分析Tab.2 Correlation analysis of circUGGT2 expression and clinico⁃pathological characteristics of CRC patients
2.3 沉默circUGGT2对CRC细胞增殖、迁移和侵袭的影响
用qRT⁃PCR检测circUGGT2在人正常结肠上皮细胞株NCM460和4种CRC细胞HT29、HCT116、SW480、SW620中的表达水平,结果发现circUGGT2在4种CRC细胞中的表达水平均高于NCM460细胞(t=32.63,P<0.001;t=8.09,P<0.001;t=67.61,P<0.001;t=45.88,P<0.001),尤其在SW480细胞中的表达水平最高,因此选择SW480细胞进行后续的缺失功能实验,见图3A。
qRT⁃PCR检测结果显示,转染si⁃circUGGT2后,SW480细胞中circUGGT2的表达水平低于si⁃NC组(t=14.70,P<0.001),提示circUGGT2敲减成功,见图3B。CCK⁃8和平板克隆形成实验结果显示,沉默circUGGT2后SW480细胞增殖速率明显降低(t24h=5.48,P<0.001;t48h=8.98,P<0.001;t72h=15.56,P<0.001),平板克隆形成数目也明显减少(t=9.72,P<0.001),提示沉默circUGGT2可抑制CRC细胞增殖,见图3C~D。划痕实验显示,沉默circUGGT2后SW480细胞的划痕愈合速率明显降低(t24h=9.38,P<0.001;t48h=8.24,P=0.001),见图3E。Transwell小室实验也显示,沉默circUGGT2后SW480细胞的迁移细胞数和侵袭细胞数均明显减少(t=23.07,P<0.001;t=7.57,P=0.002),提示沉默circUGGT2抑制了CRC细胞的迁移和侵袭,见图3F。
3 讨论
通过高通量RNA测序或circRNA芯片检测,同时结合生物信息学分析,研究者们筛选出成百上千个在CRC中异常表达的circRNAs,其中一些已经被证实参与了CRC的发生发展[7⁃12]。例如,circRNA_001569在CRC组织中显著上调,且可通过抑制miR⁃145上调E2F5、BAG4和FMNL2的表达,进而增强CRC细胞的增殖能力和侵袭能力[13];hsa_circ_0020397能促进miR⁃138的靶基因TERT和PD⁃L1的表达,进而调节CRC细胞的活力、凋亡和侵袭[14]。根据circBase数据库可知,circUGGT2属于外显子来源的circRNA,由UGGT2 mRNA的37和38号外显子通过反向剪接生成,长度为244 bp。本研究采用qRT⁃PCR对circUGGT2进行成环验证和稳定性检测,进一步证实circUGGT2是一个典型的circRNA,且具有高度的稳定性。YE等[15]利用circRNA芯片筛选发现circUGGT2在CRC患者血浆中显著上调。但目前circUGGT2在CRC中的作用尚未见报道。
circUGGT2与肿瘤作用的研究最先在甲状腺乳头状癌(papillary thyroid carcinoma,PTC)[16]中被报道。该研究发现circUGGT2在PTC组织中显著上调,且与PTC患者的TNM分期与淋巴转移显著相关;同时细胞功能实验发现circUGGT2可通过激活AMPK/mTOR信号通路促进PTC细胞的增殖和侵袭。MA等[17]也发现circUGGT2在PTC中呈高表达,且与PTC患者的不良预后密切相关;circUGGT2可通过吸附miR⁃154⁃3p促进SLC7A11的表达,进而增强PTC细胞的恶性表型和皮下成瘤能力。此外,KONG等[18]发现circUGGT2在肝细胞癌中也呈高表达,并可通过调控miR⁃526b⁃5p/RAB1A轴促进肝细胞癌的发展。LIANG等[19]发现circUGGT2在肺腺癌中呈低表达,同时还在肺腺癌中构建了基于circUGGT2的circRNA⁃miRNA⁃mRNA调控网络。可见,circUGGT2的表达和功能可能具有肿瘤异质性。本研究通过对CRC的circRNA芯片数据(GSE126094)中的10对CRC组织及其癌旁组织中circRNAs的表达谱进行分析,发现circUGGT2在CRC组织中显著上调,临床组织样本和体外细胞实验亦证实circUGGT2在CRC中高表达,且高表达circUGGT2的CRC患者肿瘤更大、浸润更深、TNM分期更晚;同时,circUGGT2对CRC还具有较好的诊断效能,可能是CRC潜在的诊断和治疗新靶点。为研究circUGGT2在CRC中的作用,本研究进一步构建沉默circUGGT2的CRC细胞模型,探讨circUGGT2对CRC恶性生物学行为的影响,结果发现沉默circUGGT2可抑制CRC细胞增殖、迁移和侵袭,提示circUGGT2可能在CRC中发挥促癌作用。
综上所述,本研究结果表明circUGGT2在CRC中高表达,沉默circUGGT2可抑制CRC细胞增殖、迁移和侵袭,有望成为CRC潜在的诊断和治疗新靶点。但circUGGT2在正常组织、癌前病变和CRC组织,以及健康者血清、CRC患者术前和术后血清中的表达水平变化仍需扩大样本进行验证,同时circUGGT2在CRC中发挥生物学功能的分子机制也有待深入研究。
