短串联重复序列分型鉴定肝癌肝移植术后超晚期复发肿瘤起源的可行性研究
2021-11-26郭德镇黄傲张势域成剑文王宇鹏闫加艳黄晓武樊嘉杨欣荣周俭
郭德镇 黄傲 张势域 成剑文 王宇鹏 闫加艳 黄晓武 樊嘉 杨欣荣 周俭
肝癌是世界范围内最常见的癌症之一,作为构成全球癌症相关死亡的第二大因素[1⁃2],肝癌的总体5年生存率低于20%,在乙型病毒性肝炎流行的地区,5年生存率甚至仅为7%~9%[3]。尽管目前肝癌的诊断和监测能力逐步提升,但仍然只有不到30%的初诊患者有机会接受根治性手术切除。肝癌的根治性手术切除主要包括肝切除术和同种异体原位肝移植术。理论上,肝移植术是治疗有肝硬化背景肝癌患者更彻底、更有效的手段,不仅能完全切除肿瘤和病变肝脏,还能有效治疗潜在的肝硬化等基础肝病。此外,肝移植术相比肝切除术还显著降低了肿瘤的复发风险,并改善患者的总体预后[4⁃5]。然而,尽管肝移植术显著降低了复发风险,但即使按照最为严格的米兰标准,也有4.3%的肝移植患者在5年内复发[6]。随着肝癌肝移植标准的放宽,术后肿瘤复发率进一步升高,达20.0%~57.8%[7],这使患者在肝移植术后的长期生存受到限制[8]。肝移植术后的肿瘤复发可能起源于潜伏在体内的原发灶肿瘤细胞,也可能来源于移植肝的新生肿瘤,鉴别复发肿瘤的来源能更好地指导后续治疗选择。
短串联重复序列(short tandem repeat,STR),也被称为微卫星或简单重复序列,是由2~6个碱基构成的核心序列经串联重复排列形成的一个核苷酸序列。STR广泛存在于包括人类在内的原核生物和真核生物中。在人类基因组中,大约有70万个STR位点,约占整个基因组的3%,其中大多数位于非编码区,只有约8%位于编码区[9⁃10]。由于核心序列的重复数目不同,STR在不同种族、不同人群之间的分布具有很大差异性。基于此产生的遗传多态性,使STR分析被广泛应用于亲子鉴定、细胞鉴定及法医学鉴定等领域中[11]。本研究应用STR分型鉴定技术,对1例肝癌肝移植术后超晚期复发的患者原发及复发肿瘤进行检测,以评估STR分型在鉴定肝癌肝移植术后复发肿瘤来源中的价值。
1 资料与方法
1.1 主要试剂与仪器
QIAampDNA FFPE Tissue Kit试剂盒购自德国QIAGEN公司、GlobalFiler™ PCR扩增试剂盒、9700型聚合酶链反应扩增仪及3500XL型测序仪均购自美国AB公司、NanoDrop 1000微量紫外分光光度计购自美国Nanodrop公司。
1.2 样本处理及DNA提取
组织样本来自复旦大学附属中山医院行同种异体原位肝移植术的肝细胞癌合并乙肝肝硬化的1例患者,移植术后11年发现肝脏右后叶膈顶复发病灶并行手术切除。原发灶和复发灶的福尔马林固定⁃石蜡包埋(formalin⁃fixed paraffin⁃embedded,FFPE)组织均取自复旦大学附属中山医院病理科保存的病理蜡块,切片厚度为5 μm。每组取2片样品置于离心管中,各加入1 mL二甲苯振荡混匀30 min,离心后弃上清液。然后再加入1mL无水乙醇后振荡混匀,离心后弃去上清液。重复上述无水乙醇洗涤步骤1次。将沉淀置于室温中挥发备用。
采用QIAGEN法提取样本DNA,提取步骤严格按照产品操作手册进行。所获得的DNA样品经过NanoDrop 1000微量紫外分光光度计进行定量及纯度分析。将浓度过高的样品DNA进行稀释并测量稀释后的浓度。
1.3 STR基因座检测及分析
使用GlobalFilerTMPCR扩增试剂盒对获得的DNA进行扩增,参照试剂盒说明书配置反应体系,在9700型聚合酶链反应扩增仪上进行多重PCR扩增。扩增产物用3500XL型测序仪进行毛细管电泳。用GeneMapperID⁃X软件对电泳结果进行分析。所检测的基因座包括21个常染色体STR基因座(D3S1358、vWA、CSF1PO、TPOX、D8S1179、D21S11、D18S51、D2S441、D19S433、TH01、FGA、D22S1045、D5S818、D13S317、D7S820、SE33、D10S1248、D1S1656、D12S391、D2S1338、D16S539)和1个Y染色体STR基因座(DYS391)。
2 结果
2.1 患者病史摘要
患者,男性,68岁,1975年患急性乙型病毒性肝炎,对症治疗后病情好转,丙氨酸转氨酶和天冬氨酸转氨酶恢复正常。患者规律随访至1992年,超声提示肝占位,同时甲胎蛋白(alpha⁃fetoprotein,AFP)水平升高至219.0 ng/mL;CT检查发现肝右叶两处占位,直径分别为2 cm和3 cm。结合病史考虑“原发性肝癌”,于1992年12月行肝右叶部分切除术,病理证实为中分化肝细胞癌。术后定期随访至2003年后发现肿瘤复发,行6次经导管动脉化疗栓塞术(transarterial chemoembolization,TACE)控制肿瘤,并于2004年10月接受同种异体原位肝移植术,术后病理示肝细胞癌。
肝移植术后口服他克莫司抗排异,采用拉米夫定联合乙肝免疫球蛋白抗病毒,并行数次系统化疗预防肿瘤复发。2014年12月,常规随访发现AFP异常升高(30.6 ng/mL)、肝功能正常,CT和MRI检查未发现肝占位病灶(图1A)。4个月后随访AFP升高至82.0 ng/mL,肝功能仍然正常,胃镜和肠镜检查未见异常;MRI检查提示肝右叶包膜下有一结节病灶(图1B)。为了鉴别该病灶的良恶性,同时寻找其他潜在病灶,进一步行PET⁃CT,病灶未出现氟脱氧葡萄糖(F⁃deoxyglucose,FDG)浓聚,其余肝脏和肝外器官也未发现FDG异常浓聚。基于此建议患者行腹腔镜下肝部分切除术,但患者选择继续随访观察。2个月后,患者AFP升高至141.6 ng/mL,肝内病灶较前增大(图1C),遂接受手术治疗,术中探查肿瘤位于右膈肌与肝包膜间,包膜完整,大小约2 cm×1.5 cm×1.5 cm,术后病理证实为肝细胞癌。术后2周复查发现AFP水平明显下降(26.1 ng/mL),术后1个月复查AFP水平为2.9 ng/mL,其余所有实验室检查和影像学检查结果均正常(图1D)。患者随访至今,未发现AFP异常升高或其他复发迹象。考虑患者发现肝外转移时肝内未见明显肿瘤病灶,因此认为该转移灶来源于移植肝新发病灶的可能性较小,同时病理形态也证实与2004年肝移植术后的病理组织形态相符,因此考虑该转移灶来源于原发肿瘤播散定植的肿瘤细胞。
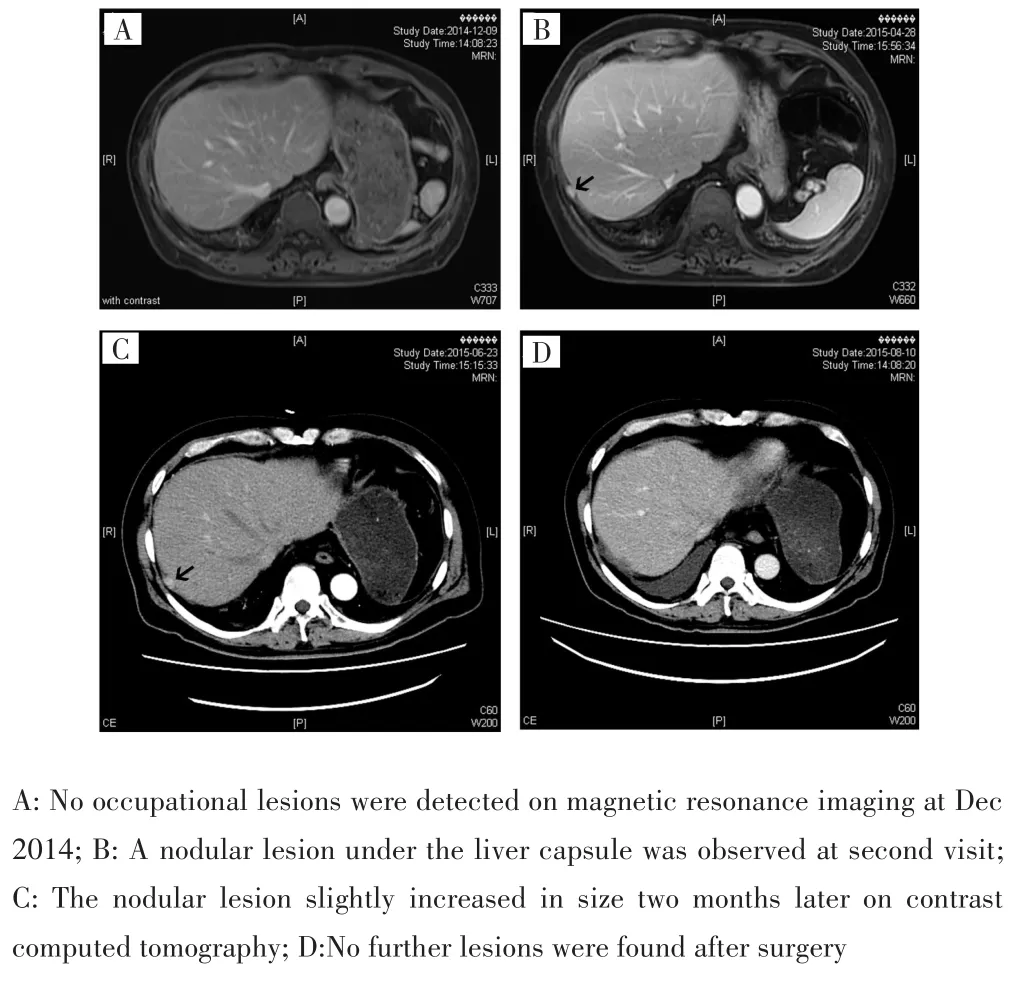
图1 患者不同时期的上腹部影像学表现Fig.1 Imaging findings at different stages of disease course
2.2 原发灶和复发灶的STR分型对比
本例患者的特征虽然极大程度上排除了复发灶源自移植物新发(de novo)肿瘤的可能性,但是原发肿瘤播散出去的肿瘤细胞在休眠11年后再次复发也较为罕见。为了确定该复发病灶的来源,本研究进一步对复发灶和原发灶的肿瘤组织进行DNA提取和STR基因座分型检测。对前述STR基因座进行检测,分型图谱上1个位点显示1个峰时,表示该基因座为纯合子基因型;若显示2个峰,表示该基因座为杂合子基因型。
原发灶和复发灶的STR分型结果显示,两者检出的15个染色体 STR 基因座(D3S1358、vWA、D8S1179、D21S11、D18S51、D2S441、D19S433、TH01、FGA、D22S1045、D5S818、D13S317、D10S1248、D1S1656、D12S391)的基因型均完全一致(表1、图2)。另有7个STR基因座出现丢失,可能由FFPE样本的DNA降解所致。由此计算出2例样本为同一来源的似然率为2.28×1018。依据该结果,支持原发灶和复发灶为同一人来源,即该复发灶来源于原发灶的播散肿瘤细胞,而不是起源于移植肝的新发病灶。STR分型的结果与临床推断结论相一致,提示STR分型或可作为临床中鉴别肝移植术后复发转移肿瘤起源的有效方法。
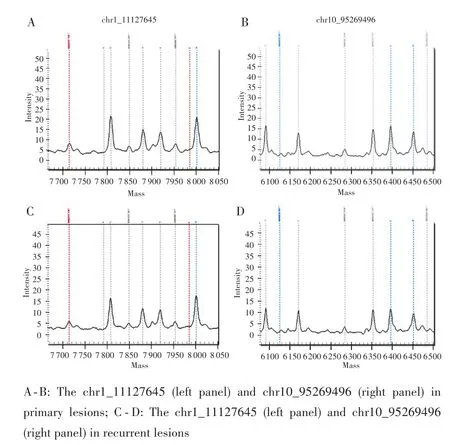
图2 典型位点STR分型结果Fig.2 Representatives of STR analysis results
3 讨论
肝癌肝移植术后约20%的患者出现复发,导致病情难以控制,生存时间大大缩短[12]。而术后复发最常见的类型为早期复发(肝移植术后1年内),主要起源于原发肿瘤病灶术前及术中释放出的循环肿瘤细胞,此类复发病灶与原发灶有相同的遗传背景,同时预示患者预后较差[13]。与早期复发相反,晚期复发(肝移植术1年后)较为少见,可能的机制一是移植肝在乙型肝炎病毒(HBV)感染背景下出现新发肿瘤;二是原肿瘤播散出的肿瘤细胞在长期休眠后被激活导致复发[14]。研究表明,肝移植患者发生晚期复发后,仍然能获得良好的预后[15⁃16]。据报道,早期复发和晚期复发的患者有相似的人口统计学和病理学特征[17],因此除非做基因检测对比复发灶和原发肿瘤的表型,否则几乎不可能判断复发来源。
目前,对肝移植术后复发的治疗仍存在争议,理论上,治疗原发性肝癌的所有手段都可以用于治疗复发患者。尽管适合再次手术切除的患者比例不高,但是手术切除仍然是单复发肿瘤患者可行的治疗手段[18],在晚期复发患者中也可能获得较好的预后[15,19]。本例患者血清AFP水平在手术切除复发灶后短期内很快下降至正常水平,术后长期随访未发现疾病进展。因此,原则上对于病灶可切除的患者,建议行手术切除,且手术切除与系统化疗相结合可进一步延长复发患者的生存时间,即使是对于多器官转移的复发患者仍有一定效果[20]。还有研究报道,局部治疗,例如射频消融、放疗和TACE等都可以作为肝移植术后肝内复发患者的治疗选择,但仅限于没有严重并发症的患者[21]。索拉非尼既往也被应用于肝移植术后复发患者的治疗,但其疗效存在争议[22⁃23],而且大部分患者因出现毒副反应,致使减少剂量甚至停药[24]。靶向治疗可以根据肿瘤的分子通路设计对应靶点,进行个体化治疗,也是一种有前景的治疗手段[25]。因此,鉴别复发肿瘤的来源对选择有效的药物治疗十分关键。
肝移植术后晚期复发较少见,手术10年后超晚期复发更是极为罕见。复习文献发现,PECCHI[26]在165例肝癌患者中发现3例晚期复发患者,CHOK等[27]报道的晚期复发率约为5%(7/139)。与之相反,在SCHLITT等[28]的研究中,20%的患者在接受肝移植术3年后发生肿瘤复发。CHEN等[29]报道了1例罕见病例,患者接受肝移植术后第3年出现肺和肾上腺异位复发。GOLDARACENA等[30]也记录了1例特殊病例,患者在术后第36个月时发生肝细胞癌的口腔异位复发。SCHREIBMAN等[31]发现1例肝移植术6.5年后复发病例,患者伴有丙肝相关肝硬化,最后确认复发肿瘤来源于原发肿瘤。CASTROAGUDÍN等[32]报道了3例晚期复发患者,分别复发于术后7年,9年和10年;通过对比原发肿瘤和复发灶的遗传表型,PIARDI等[33]确认该患者为肝移植术8年后原发肿瘤复发。BHOORI等[25]报道1例肝移植术11年后出现肝内和肝外复发病例,STR分型证实复发灶来源于原发肿瘤。NAVARRO BURGOS 等[34]记录了1例肝移植术后9个月复发肝癌,同时发生肺部转移病例,通过荧光原位杂交技术检测示肿瘤细胞来自原发肿瘤。在TAMÈ等[35]观察的病例中,第1例患者在移植术后5年复发,STR检测提示为供体来源;第2例患者因继发性硬化性胆管炎行移植术,术后6年肿瘤复发,经STR和荧光原位杂交技术检测显示为受体来源。SAAB等[36]报道1例因丙型病毒性肝炎肝硬化行肝移植的病例,患者在术后19年出现肝癌复发,这也是目前为止报道的肝移植术后出现复发时间最晚的病例。
肝移植患者在术后发生晚期复发的原因尚不清楚。尽管有研究表明,相比其他高危因素,乙型病毒性肝炎相关的肝癌患者在肝移植术后更容易出现晚期肿瘤复发[37],但本文报道的患者进行了长期的抗病毒治疗,其HBV DNA指标在病程中一直为阴性。此外,基因表型已经证明复发灶来源于原发肿瘤,进一步排除了移植肝新发肿瘤的可能。肝移植术后复发可能是由于原发肿瘤微转移灶增殖或循环肿瘤细胞再定植[38]。有研究报道,肝移植前接受TACE会增加肿瘤转移风险[39]。然而,本例患者在接受肝移植术前多次行TACE并有效地控制了肿瘤进展,病理检查也未见肝内肿瘤细胞存活灶,且该患者也未发生早期复发,与其他文献报道一致[40]。因此,推测本例患者超晚期复发的肿瘤起源于释放至外周血的循环肿瘤细胞,且这些循环细胞在局部定植后处于休眠状态直至形成影像可见病灶。然而,这些播散出来的肿瘤细胞长时间保持休眠状态,而随后又出现活性并形成复发的原因有待进一步探究。
本研究采用STR分型对肝癌肝移植术后超晚期复发灶的来源进行鉴定,能够有效区分复发灶的克隆起源,证实STR分型是有效鉴定肝移植术后复发灶来源的方法。同时也表明肝癌肝移植患者存在术后超晚期肿瘤复发转移的可能,而对单一复发病灶行手术切除仍能取得较理想的效果,凸显了肝移植术后长期监测和及时干预的必要性,也为肝癌肝移植术后肿瘤复发的个体化治疗提供了思路。
