低分化肝细胞癌的免疫微环境及其对PD⁃1抑制剂疗效的评估价值
2021-11-26杨坤吴坤瑾沙焕臣张晓刚刘昌曲凯
杨坤 吴坤瑾 沙焕臣 张晓刚 刘昌 曲凯
原发性肝癌是全球发病率和死亡率最高的癌症之一,全球每年约有一半的新发肝癌发生在中国,据世界卫生组织(WHO)估计,到2030年全球将有超过100 万人死于肝癌[1⁃2]。肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,其治疗及预后常因所处的疾病阶段不同而差异较大,其中只有约三分之一的患者有机会进行根治性治疗,而大部分患者确诊时已经是晚期,只能接受姑息治疗。目前作为晚期肝癌一线治疗的索拉非尼因为频繁出现耐药性,治疗后的生存获益也有限[3]。在过去十多年里,免疫治疗极大地改变了肿瘤治疗领域[4]。其中,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是免疫治疗的重要治疗策略之一,其通过重新激活免疫系统的抗肿瘤免疫反应发挥作用[5]。ICIs在转移性黑色素瘤治疗中取得的成功极大地推动了免疫治疗在包括HCC在内的多种肿瘤中的应用[6]。在HCC中,纳武利尤单抗(Nivolumab)和帕博利珠单抗(Pembrolizumab)两种针对程序性细胞死亡蛋白1(programmed cell death protein 1,PD⁃1)的单克隆抗体,以及纳武利尤单抗联合伊匹木单抗(Ipilimumab)的治疗策略已被美国FDA批准用于晚期HCC治疗[7]。临床实践表明,ICIs在HCC患者中的总体反应率仅为15%~20%[8]。而且,ICIs所带来的免疫相关性不良反应也严重影响患者预后。因此,迫切需要筛选出对ICIs敏感的HCC亚群。既往研究报道低分化肿瘤常表达更高的PD⁃1/PD⁃L1[9⁃10],因此可能对免疫治疗更敏感,但目前尚缺少低分化HCC免疫治疗的研究。本研究旨在探讨不同分化程度HCC的预后差异,以及免疫治疗对低分化HCC的疗效。
1 材料和方法
1.1 一般资料
收集SEER数据库中于2004—2015年被确诊为HCC的患者临床、病理及随访资料。纳入标准:⑴经2010版WHO病理诊断标准确诊为肝细胞肝癌(ICD⁃O⁃3:8170⁃8175);⑵诊断由阳性组织学确定;⑶Grade分级明确;⑷甲胎蛋白(AFP)及肝纤维化评分信息明确;⑸AJCC第6版TNM分期信息完整;⑹有完整的生存时间及随访信息。排除标准:⑴种族信息未知。⑵病例来源为尸检获取及只有死亡报告的病例。最终,4 114例患者被纳入本研究。
收集2003—2020年于西安交通大学第一附属医院行肝癌切除术的HCC患者的临床、病理及随访资料。纳入标准:⑴年龄大于18岁;⑵根据AJCC第8版TNM分期系统评估为Ⅰ、Ⅱ或Ⅲ期;⑶术前未进行任何抗癌治疗;⑷接受肝癌根治性切除术;⑸经病理学诊断为HCC。共纳入1 752例患者,电话随访自2012年1月至2021年5月,主要随访内容为生存状态、死亡时间、死亡原因等。排除失访或临床数据不完整的患者1 162例。最终,590例患者被纳入本研究。
1.2 临床数据统计分析方法
采用SEER*Stat(Version 8.3.9.2)收集数据,IBM SPSS Statistics 26软件用于数据整理及分析。使用Prism 8.0软件绘制Kaplan⁃Meier生存曲线,预后指标为总生存期(overall survival,OS)及生存状态,并以Log⁃rank法进行假设检验。SEER数据库基线变量(性别、年龄、种族、AFP、TNM分期、肿瘤大小、分化程度、肝纤维化Ishak评分、有无放/化疗及手术)和单中心数据基线变量(性别、年龄、HBsAg、AntiHCV、AFP、TNM分期、分化程度、NLR、肝纤维化ARPI评分、肝纤维化FIB4评分、手术方式)用IBM SPSS Statistics 26软件进行多因素Cox回归分析,得到校正P值(Pa值)和校正HR及95%CI。当P<0.05则认为差异有统计学意义。
1.3 肝癌测序数据及基因筛选
数据来源于TCGA数据库,从XENA项目网站(https://xena.ucsc.edu/)分别下载肝癌患者的临床特征数据(survival/LIHC_survival.txt)和 RNAseq数据(TCGA.LIHC.sampleMap/HiSeqV2)。将基因样本分为肿瘤组与癌旁组,采用独立样本t检验(P<0.05)和FC(LogFC>1或<-1)初步筛选出肿瘤与癌旁组织有显著差异的基因。通过Cox回归分析筛选出影响肝癌患者预后的基因,将两组基因进行匹配,筛选出影响HCC预后的基因(P<0.05)。
1.4 WGCNA和通路富集分析
通过R⁃Studio(version 1.4.1717)中的WGCNA包进行加权共表达网络分析(weighted correlation net⁃work analysis,WGCNA),分析候选基因的表达和临床数据。通过计算基因对之间的Pearson相关性,模块特征基因与性状(包括性别、年龄、病理分级、生存状态、生存时间)的相关性,确定与肿瘤分化、生存结局以及生存时间相关的基因模块。使用在线分析网站Metascape(https://metascape.org/gp/index.html#/main/step1)进行富集分析。
1.5 免疫浸润分析
使用在线分析网站TIMER(https://cistrome.shin⁃yapps.io/timer/)和 TIMER2.0(http://timer.cistrome.org/),基于TIMER算法全面分析候选基因表达和不同免疫细胞浸润水平之间的Spearman相关性和显著性。基于TCGA数据库将肿瘤分为高⁃中分化组与低分化组,采用独立样本t检验比较两组的免疫细胞及PD⁃1/PDL⁃1表达情况。
1.6 PD⁃1免疫荧光染色
肝癌组织在10%福尔马林缓冲液中固定24 h以上,石蜡包埋后切片得到石蜡白片。首先,对石蜡切片白片进行脱蜡处理,顺序依次为二甲苯Ⅰ(15 min),二甲苯Ⅱ(15 min),100% 乙醇Ⅰ(5 min),100% 乙醇Ⅱ(5 min),90% 乙醇(5 min),80% 乙醇(5 min),70%乙醇(5 min),60% 乙醇(5 min)。脱蜡完成后浸泡在PBS溶液清洗5 min,然后将切片放在95℃的柠檬酸盐缓冲液(0.1 mol/L,pH=6.0)中抗原修复 10 min,自然冷却至室温。接着在5%Triton⁃X中透化10 min后,PBS清洗10 min×3次。在避光条件下用3%过氧化氢孵育10 min。待PBS清洗完成后,用5%BSA封闭30 min。封闭完成后,加PD⁃1一抗(1∶200),4℃孵育过夜后,经PBST清洗、荧光二抗孵育(AlexaFluor 546标记驴抗兔抗体 1∶500,Hochest 33342 1∶1 000)2 h、PBST清洗后用90%甘油进行封片,然后立即在激光共聚焦显微镜594 nm波长下观察染色情况,采集图像并分析。
2 结果
2.1 不同分化程度直接影响HCC患者的预后
2.1.1 SEER数据库分析结果 SEER数据库纳入的4 114例HCC患者,对纳入的变量进行Cox多因素回归分析,结果显示,除性别外,年龄、AFP水平、肿瘤大小、分化程度、肝纤维化Ishak评分均是预后的独立危险因素;放疗、化疗、手术均是预后的独立保护因素,见图1。
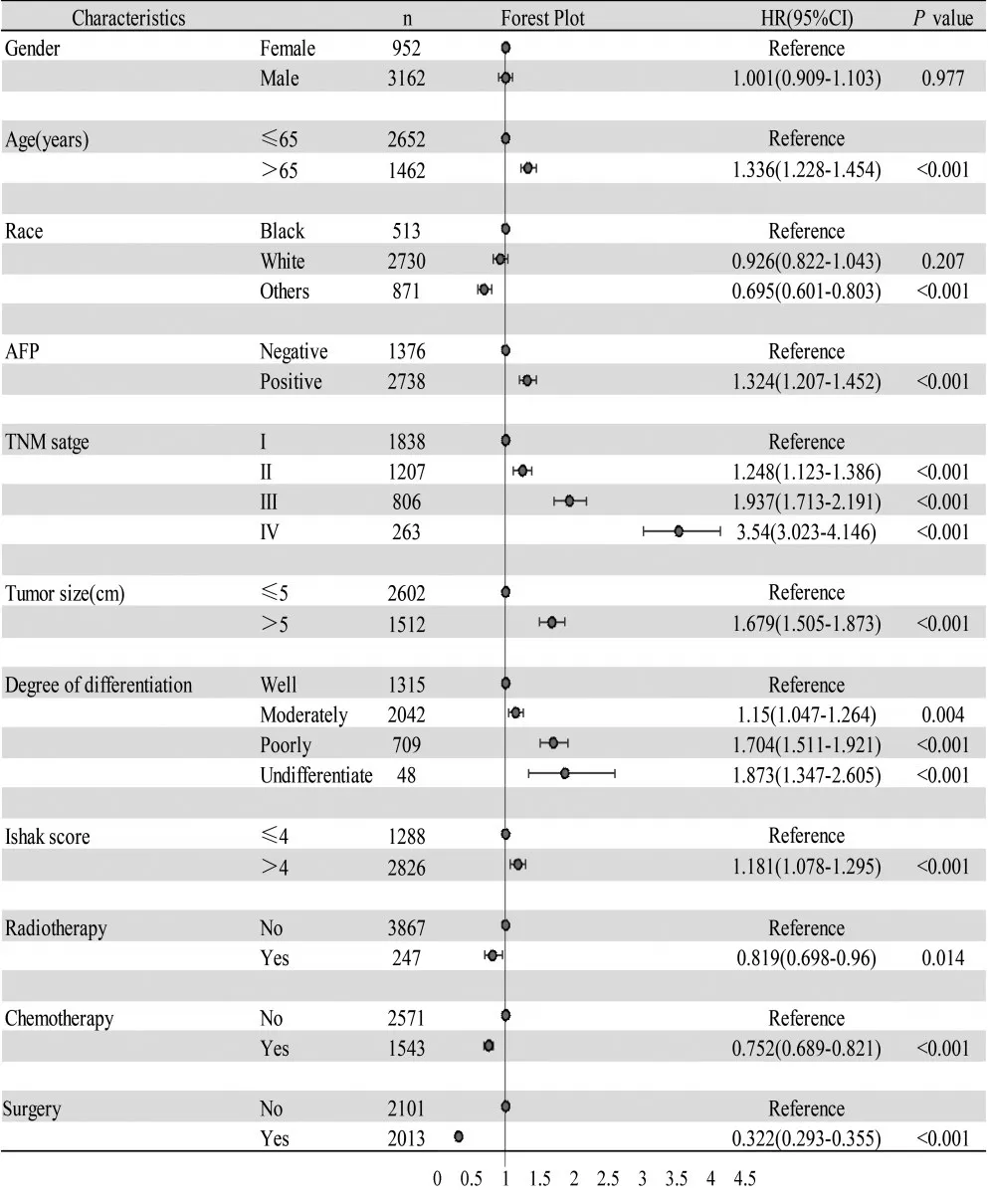
图1 SEER数据库中HCC患者预后因素森林图Fig.1 Forest of prognostic factors of HCC patients in the SEER dataset
亚组分析显示,HCC患者预后与分化程度密切相关。其中,高分化HCC患者的中位生存时间为46个月,中分化患者为40个月,低分化患者为22个月,未分化HCC患者为15个月。将患者分为高、中、低、未分化4组进行生存分析,Log⁃rank检验结果与多因素Cox结果一致,分化程度是影响HCC预后的因素(P<0.001),但高分化组与中分化组的预后差异无统计学意义(P=0.420),低分化组与未分化组的预后差异也无统计学意义(P=0.272),见图2A。因此重新将患者分为高⁃中分化和低⁃未分化两组进行生存分析,结果显示高⁃中分化组的总体预后优于低⁃未分化组患者(P<0.001),见图2B。
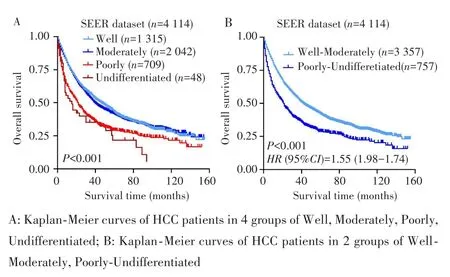
图2 基于SEER数据库分析不同分化程度HCC患者的预后Fig.2 Analysis of the prognosis of HCC patients with different histological grades in SEER dataset
进一步分析不同TNM分期患者的分化程度与的预后关系,结果显示,在TNM的4个不同分期中,低⁃未分化HCC患者的预后均较高⁃中分化患者差(P<0.05),见图3。再次证明HCC分化程度是影响患者预后的重要因素。
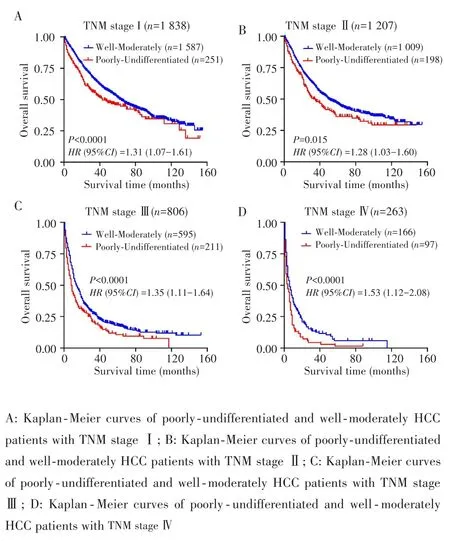
图3 基于SEER数据库分析不同TNM分期中分化程度对患者预后的影响Fig.3 The prognosis effects of histological grades in HCC patients with different TNM stage in SEER dataset
2.1.2 XJTU队列数据分析结果 为了验证上述SEER数据库分析结果,进一步纳入于西安交通大学第一附属医院诊治的590例HCC患者(XJTU队列)进行分析,基线资料见表1。由于590例HCC患者的病理类型中缺乏“未分化”类型,因此将患者分为高、中、低分化3组进行生存分析。其中高分化HCC患者的中位生存时间为64个月,中分化患者为77个月,低分化患者为25个月;Log⁃rank检验结果显示分化程度是影响HCC患者预后的因素(P<0.001),见图4A,但高分化组与中分化组预后差异无统计学意义(P=0.494),因此进一步分为高⁃中分化和低分化两组进行分析,结果与SEER数据库结果一致,高⁃中分化和低分化HCC患者的预后差异有统计学意义(P<0.001),见图4B,即分化程度越差,HCC患者预后越差。

表1 590例HCC患者的临床资料Tab.1 Clinical charactersitics of 590 patients with HCC

图4 基于XJTU队列分析不同分化程度HCC患者的预后Fig.4 Analysis of the prognosis of HCC patients with different histological grades in XJTU cohort
2.2 低分化HCC中免疫细胞浸润及PD⁃1/PD⁃L1表达分析
利用TIMER数据库(https://cistrome.shinyapps.io/timer/)比较低分化HCC与高⁃中分化HCC的免疫细胞浸润情况,结果显示,与高⁃中分化HCC组织比较,低分化HCC组织中存在更多的CD8+T细胞浸润(P<0.05),具有更高的PD⁃1表达(P<0.05),见图5。这一结果提示,低分化HCC组织中具有与高中分化HCC不同的免疫微环境特点。
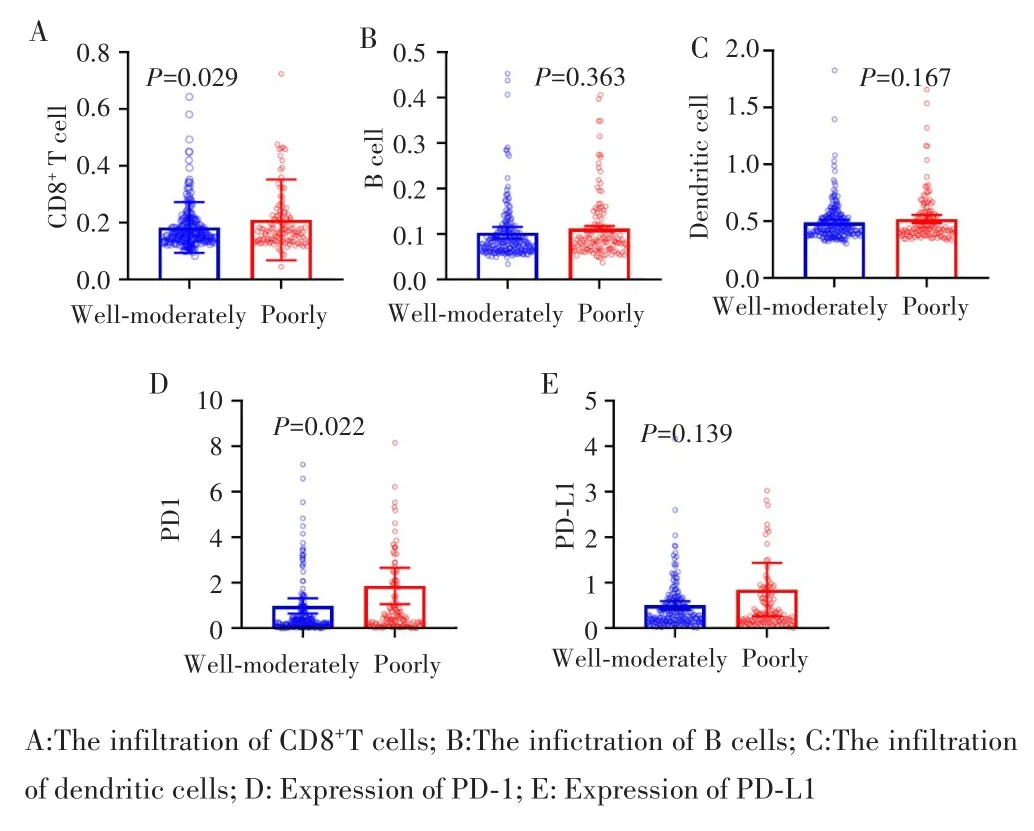
图5 低分化HCC组织中免疫细胞浸润及PD⁃1/PD⁃L1的表达情况Fig.5 The immunocytes infiltration and PD⁃1/PD⁃L1 expression in poorly differentiated HCC
2.3 E2F1作为核心基因参与调控低分化HCC的免疫微环境
本研究利用肝癌测序数据(TCGA⁃LIHCseq),使用WGCNA方法筛选出与肿瘤分化、生存结局及无瘤生存期相关的基因模块,结果显示,MEblue模块的基因与肿瘤分化程度显著相关(P<0.001),也均与生存结局(P<0.05)及总生存期(overall survival,OS)(P<0.001)相关,见图6A。推测MEblue模块内的基因可能与低分化HCC不良预后有关,因此进一步将MEblue模块基因进行TRUSST通路富集分析,结果显示,该类基因主要受E2F1调控(Pa<0.001),见图6B。此外,E2F家族成员E2F4(Pa<0.001)、E2F3(Pa<0.05)也参与调控MEblue模块基因。

图6 肝癌分化相关基因筛选及其调控相关分子预测Fig.6 Identification of the hubgenes that associated with tumor histological grades
本研究利用TIMER数据库对肝癌组织中E2F1与免疫浸润的关系进行分析,结果显示,E2F1表达与免疫细胞浸润水平呈显著相关性,见图7。其中,与E2F1表达关系最密切的免疫细胞为树突状细胞(r=0.405,P<0.001),B细胞(r=0.406,P<0.001)和CD8+T细胞(r=0.307,P<0.001)。上述结果提示,E2F1与HCC分化及预后有关,其机制可能是通过调控HCC免疫微环境而实现。
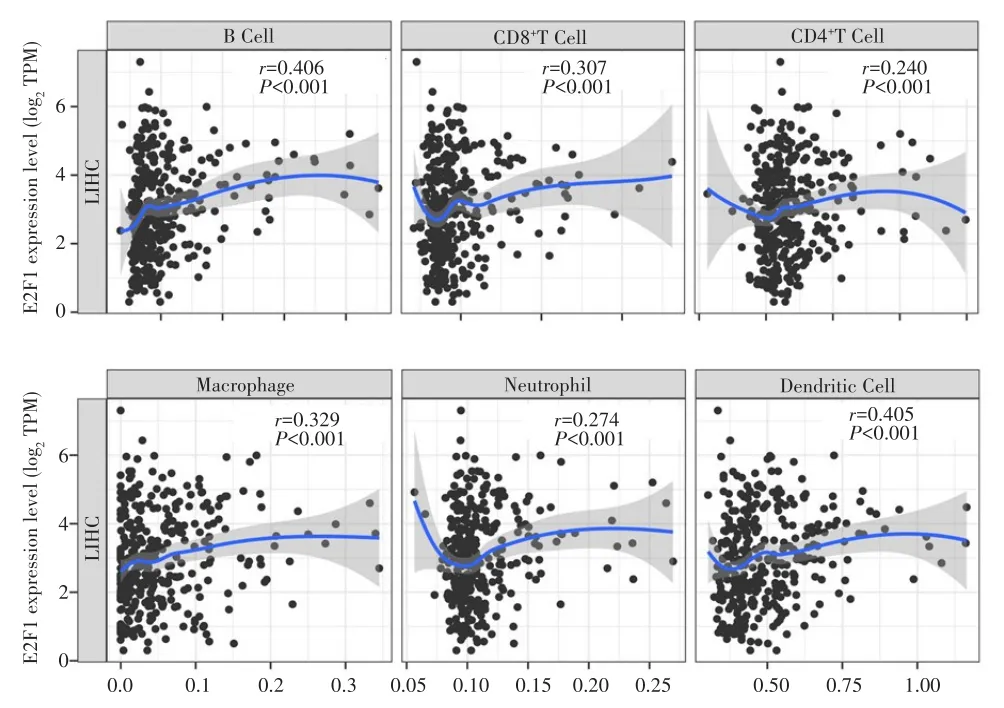
图7 肝癌组织中E2F1表达与免疫细胞浸润的相关性Fig.7 The correlation between E2F1 expression and immunocyte infiltration in HCC tissue
2.4 低分化HCC联合免疫治疗病例分析
患者,男性,40岁,于2020年4月8日入院,入院诊断:原发性肝癌,乙肝肝硬化。于本院行肝癌切除术,术中可见肝脏左外叶外侧2个质软灰白色结节,肿瘤质地柔软,烂鱼肉状,术后病理示:肝脏低分化肝细胞癌伴微血管内癌栓及大片坏死,浸及局部肝被膜;微血管侵犯(microvascular invasion,MVI):M2。考虑为肿瘤复发高危人群,术后给予口服酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)索拉非尼治疗。术后4个月出现肿瘤复发,先后接受两次经肝动脉化疗 栓塞术(transcatheter arterial chemoembolization,TACE),效果不佳。于术后第7个月接受TKI联合免疫治疗。联合免疫治疗后AFP水平逐渐降低至正常水平,见图8A。联合免疫治疗3个月后复查上腹部增强CT,提示肿瘤完全缓解(complete response,CR),见图8B。将患者术中切除的肝癌组织进行PD⁃1免疫荧光染色(红色),结果显示其肿瘤周围存在较多PD⁃1阳性细胞,见图9。进一步验证低分化HCC组织中存在较多PD⁃1阳性T细胞浸润。
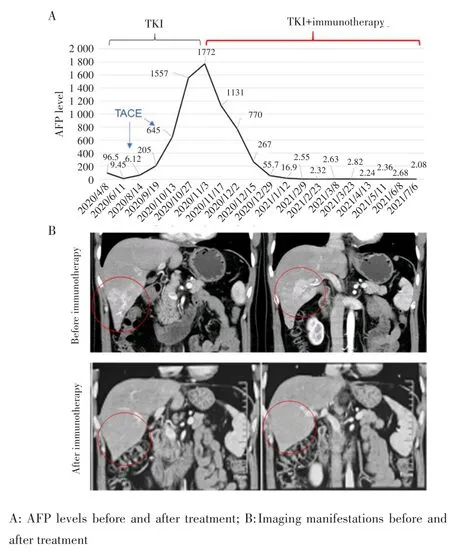
图8 联合免疫治疗前后患者的AFP水平及影像学改变Fig.8 AFP and imaging changes before and after immunotherapy
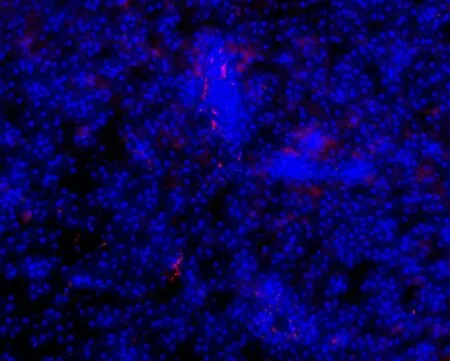
图9 1例低分化HCC患者肝癌组织的PD⁃1免疫荧光染色Fig.9 Immunofluorescence staining of PD⁃1 in a patient with poorly differentiated HCC
3 讨论
临床上大部分HCC患者发现时即为晚期,索拉非尼是晚期HCC的一线治疗药物,但由于索拉非尼的低应答率和高毒性等缺点,亟需开发新的治疗方法作为替代。在这些新的疗法中,免疫疗法可能是最有希望的疗法之一[11]。目前,免疫治疗已经在黑色素瘤、肺癌、肾癌和膀胱癌等多种肿瘤的临床治疗中表现出显著的临床效果[12⁃13]。但免疫治疗在HCC患者中的总体反应率仅为15%~20%,从而限制了其在临床上的应用[8],因此筛选对免疫治疗敏感的HCC亚型至关重要。
HCC作为一种炎症相关肿瘤,其免疫微环境可通过多种机制促进肿瘤免疫耐受和逃逸,免疫抑制作用的强弱也与HCC患者预后密切相关[14]。PD⁃1/PD⁃L1轴是一条重要的与肿瘤免疫耐受和逃逸相关的通路[15],PD⁃1在肿瘤免疫浸润细胞尤其是在T细胞中呈高表达状态[16]。本研究发现,低分化HCC中存在以PD⁃1+CD8+T细胞高度浸润为特点的免疫微环境。近年来,研究人员陆续在具有非酒精性脂肪性肝炎(non⁃alcoholic steatohepatitis,NASH)或乙型肝炎病毒感染背景的HCC中发现以PD⁃1+CD8+T细胞富集为特点的免疫微环境[17⁃18]。PD⁃1作为关键的免疫检查点分子[19],在肝癌、肺腺癌、胃癌、结直肠癌等多种肿瘤的研究中被发现与肿瘤分化程度呈负相关,即肿瘤分化程度越差,免疫细胞PD⁃1或PD⁃1 mRNA表达水平越高[3,20⁃22]。而PD⁃1+CD8+T细胞富集往往意味着体内存在免疫抑制状态,使用PD⁃1抗体可恢复T细胞对肿瘤细胞的杀伤作用。本研究提供的1例典型病例也证实乙肝肝硬化背景下的低分化HCC,因为存在PD⁃1高表达,对免疫治疗表现出高度敏感性。由此推测低分化HCC很可能是免疫治疗的潜在受益人群。然而,最近发表的研究表明[17⁃18],NASH 背景下的HCC对免疫治疗效果不佳。那么,NASH背景下的低分化HCC能否从免疫治疗中获益,目前仍不清楚。因此,针对不同病因背景下低分化HCC对免疫治疗的敏感性仍有待进一步研究。
既往研究报道,E2F家族成员,尤其是E2F1高表达与肿瘤免疫微环境中CD8+T淋巴细胞高度浸润相关,E2F1通路可能具有调节神经系统肿瘤中的免疫细胞浸润的作用[23⁃24]。本研究关于HCC免疫浸润分析结果也显示,在HCC中E2F1表达与免疫细胞浸润具有一定相关性,推测低分化HCC中E2F1通路可能参与调节肿瘤免疫微环境,导致肿瘤组织中PD⁃1+CD8+T淋巴细胞高度浸润,进而对免疫治疗表现出高度敏感性,这一结果为低分化HCC免疫微环境及免疫治疗的机制研究提供了新的思路。
目前关于肿瘤免疫治疗的相关临床研究主要集中在晚期或对其他治疗不敏感的肿瘤上,在一系列临床研究的基础上,多种ICIs被批准用于治疗黑色素瘤、肺癌、尿路上皮癌、头颈部鳞状细胞癌、肾细胞癌和晚期肝癌等肿瘤[25]。但关于免疫治疗的肿瘤亚型尤其是肿瘤分化类型的选择未有明确报道。本研究从肿瘤分化角度出发,试图探索低分化HCC的免疫微环境特征及其对免疫治疗的疗效,这一结果将对肝癌免疫治疗筛选具有借鉴意义。但本研究结果主要基于回顾性数据分析和生物信息学方法,缺乏大样本的前瞻性临床数据,也未深入探索具体的分子机制,因此研究结果具有一定局限性,后续仍需开展大样本的前瞻性临床试验证实。此外,无论是SEER数据库还是笔者所在的中心数据均显示低分化HCC与高⁃中分化HCC患者预后差异显著,而中分化与高分化患者的预后无明显差异,其具体机制也有待深入探讨。
综上所述,本研究发现低分化HCC较高⁃中分化HCC预后更差,其中低分化HCC中存在PD⁃1+CD8+T细胞富集的免疫微环境特征,而其高表达的E2F1可能参与调节这种免疫微环境。因此,低分化HCC患者很可能是免疫治疗的潜在受益人群,值得后续深入探讨。
