基于Gd⁃EOB⁃DTPA增强MRI的列线图模型在预测肝肿瘤术后肝衰竭中的临床价值
2021-11-26李长峰王强瞿成名李雪松蔡萍张雷达马宽生
李长峰 王强 瞿成名 李雪松 蔡萍 张雷达 马宽生
原发性肝癌(primary liver cancer,PLC,简称肝癌)是我国常见的消化道恶性肿瘤,位列恶性肿瘤发病第三位[1]。目前,外科切除仍然是肝癌的首选治疗手段[2⁃3]。但是尽管外科理念、技术设备及围手术期管理能力不断进步,大范围及复杂肝切除手术的比例仍在增加[4]。术后肝衰竭(post⁃hepatectomy liver failure,PHLF)是肝切除患者围手术期死亡的主要原因,既往文献报道的发生率为 1.2%~32.0%[5⁃6]。术前精准、有效的肝功能评估,尤其是预留肝脏的功能评估是预防PHLF发生的有效手段[7⁃9]。目前临床上常用的术前肝功能评估方法主要包括血清学检查、吲哚菁绿滞留率试验、Child⁃Pugh分级、终末期肝病模型(model for end⁃stage liver disease,MELD)评分及肝脏体积测量等[8,10⁃11],但这些指标只能反映肝脏整体功能情况,无法进行局部肝功能评估[11⁃12]。由于我国肝癌患者大多伴有肝纤维化或肝硬化,肝功能均存在不同程度损伤,肝细胞间损伤/修复程度的差异往往导致肝功能节段分布的不均一性[13]。因此,如何局部、定量评估肝功能,进而预估患者发生PHLF的风险、辅助肝胆外科医师规划个体化手术方案,实施精准肝癌切除,是肝胆外科临床上亟待解决的问题。
Gd⁃EOB⁃DTPA(gadoxetic acid disodium,商品名:普美显)增强磁共振(MRI)是临床上常用的影像学检查手段,其独特的肝胆期图像可显示良好的组织对比度,已被越来越广泛地应用于肝脏病灶的筛查、检出和诊断[14⁃15]。近年研究发现,不同肝功能损伤程度患者由于肝细胞吸收以及排泄对比剂程度不同,在Gd⁃EOB⁃DTPA增强MRI图像上表现为肝实质信号强化不同程度下降,因此测量这些信号强度(signal intensity,SI)的变化可以定量评估肝功能状态[7]。既往研究已证实了Gd⁃EOB⁃DTPA增强MRI在术前肝功能定量评估[16]以及PHLF风险预测中的有效性和准确性[17⁃18]。本研究拟采用基于Gd⁃EOB⁃DTPA增强MRI的定量肝功能指标肝⁃肌比率(liver⁃to⁃muscle ratio,LMR)[19]及相关临床危险因素建立预测PHLF的列线图模型,并探讨其临床应用价值。
1 资料与方法
1.1 一般资料
回顾性收集与分析2019年9月至2020年11月于陆军军医大学第一附属医院肝胆外科行肝脏肿瘤切除术的117例肝癌患者的临床病理资料和MRI影像资料。患者纳入标准:⑴行开放或腹腔镜辅助下肝癌切除术;⑵术后病理诊断为原发性肝癌;⑶术前4周内行Gd⁃EOB⁃DTPA增强MRI检查;⑷无其他脏器转移。排除标准:⑴术前接受其他针对肝癌的治疗,如射频消融术、经动脉化疗栓塞术、门静脉栓塞、化疗、靶向治疗等;⑵肝移植患者;⑶MRI图像质量不佳,如出现严重伪影,无法分析。本研究方案经陆军军医大学第一附属医院伦理委员会审批后实施,审批号为(B)KY2021068。
1.2 影像学检查
所有入组患者均采用3.0T MRI扫描仪(Magne⁃tom trio,Siemens Health⁃care,Germany)设备检查。扫描序列:平扫期,冠状位半傅立叶采集单次激发快速自旋回波序列(HASTE),轴位二维T1加权双回波同反相位序列(In⁃Opp TIWI)及单次闭气三维容积内插体部检查序列(3D⁃VIBE)。腹主动脉下端信号强度升高触发动脉期扫描。扫描参数为Echo time:1.31 ms,Repetition time:3.48 ms,Flip angle:10,Field of view=400×275 mm2,Slice Thickness:2.5 mm。Gd⁃EOB⁃DTPA经肘静脉注射,注射剂量为0.1 mL/kg,注射速率为1.0 mL/s,并使用盐水冲管。注射对比剂后60 s、180 s和15 min分别采集门静脉期、平衡期及肝胆期图像。
1.3 Gd⁃EOB⁃DTPA增强MRI图像指标计算
从PACS系统中导出患者Gd⁃EOB⁃DTPA增强MRI的肝胆期图像。由2名肝胆科医师在不知晓患者临床信息的情况下手动勾画感兴趣区域(region of interest,ROI),由1名具有10年以上工作经验的放射科医师审核、确认。勾画所使用的软件为Fiji(java 8,https://imagej.net/Welcome)。具体勾画过程:选取肝胆期轴位图像平门静脉分叉平面,在预留剩余肝脏及双侧脊柱旁肌肉位置上,每一区域勾画2个ROI,并避开肿瘤、脉管、肝脏边缘等不能反映肝实质信号强度的区域(图1)。读取的ROI值取均值后分别代表剩余肝脏信号强度值(SI of the liver)和肌肉信号强度(SI of the muscle),并采用以下公式计算 LMR[17⁃18]:LMR=SI of the liver/SI of the muscle。
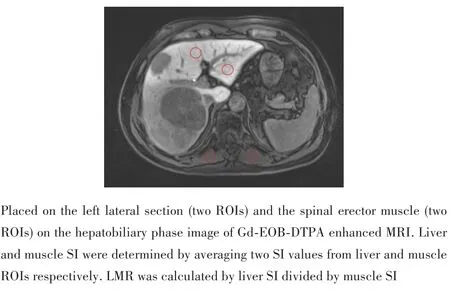
图1 肝胆期左外叶及脊柱旁肌肉感兴趣区域(ROIs)图像Fig.1 A representative case showing four identical circular regions of interest(ROIs)
1.4 临床指标
收集患者的一般资料(年龄、性别、乙肝病史等),术前肝功能评估指标,如吲哚菁绿15min滞留率(indocyanine green retention rate for 15 minutes,ICG⁃R15),MELD评分,Child⁃Pugh分级及白蛋白⁃胆红素(albumin⁃bilirubin,ALBI)分级等。临床生化指标包括血小板(Platelet)(≤125×109/L,>125×109/L)、谷丙转氨酶(ALT)(≤42 U/L,>42 U/L)、谷草转氨酶(AST)(≤42 U/L,>42 U/L)、血清白蛋白、总胆红素、血清肌酐、国际标准化比值(international normalized ratio,INR)等。手术相关指标包括腹腔镜辅助下手术(是/否)、手术切除范围(Ma⁃jor/Minor;按照Couinaud分段标准切除范围≥3个肝段为Major,<3个肝段为Minor)、手术持续时间(≤300 min,>300min)、肝门阻断情况(是/否)、术中失血量(≤600 mL,>600 mL)等。
1.5 术后肝衰竭的评价标准
根据国际肝脏外科协作组(International Study Group of Liver Surgery,ISGLS)制定的术后肝衰竭分级评价标准[5]界定术后肝衰竭,其衡量标准为在术后第5天或之后INR增加(或需要凝血因子来维持正常的INR)和出现高胆红素血症(高于当地实验室正常范围),并且排除由此引起的并可观察到的生化和临床改变的其他明显原因,如胆道梗阻。根据该标准,将研究对象分为PHLF组和非PHLF(Non⁃PHLF)组。
1.6 统计学方法
呈正态分布的计量资料使用均数±标准差(x±s)表示,采用独立样本t检验比较组间差异,非正态分布的计量资料使用中位数(四分位数间距)表示,组间比较使用 Mann⁃Whitney U 检验。使用 Shapiro⁃Wilk检验评估数据分布的正态性。计数资料使用例数(n)或百分数(%)表示,组间比较采用χ²检验或Fisher确切概率法。使用单因素回归分析筛选组间差异有统计学意义的预测因子纳入多因素logistic回归分析中。绘制列线图对模型进行直观量化。采用ROC曲线评估模型的区分度,使用Hosmer⁃Lemeshow检验评估模型的拟合优度。通过Youden指数计算模型最佳cut⁃off值。Calibration曲线用于评估模型校准度。使用决策曲线评估模型的临床实用性。以P<0.05(双侧检验)表示差异有统计学意义。采用R软件(版本4.0,http://www.r⁃project.org/)和 SPSS(版 本 24.0,IBM Corporation,Armonk,NY)软件进行数据分析及绘图。
2 结果
2.1 基线资料
本研究共纳入患者117例,平均年龄为(50.4±10.6)岁,其中男性96例(82.1%),女性21例(17.9%)。PHLF发生率为29.9%。所有患者Child⁃Pugh分级A级占97%,B级占3%。MELD总体中位评分为4.0分,Non⁃PHLF组为4.0分,PHLF组为6.0分(P<0.001)。Non⁃PHLF组中采用腹腔镜辅助下肝切除55例(67.1%),PHLF组12例(34.3%),组间差异有统计学意义(P=0.002)。Non⁃PHLF组的LMR为3.46±1.02,PHLF组为2.55±0.81,差异有统计学意义(P<0.001)。见表1。
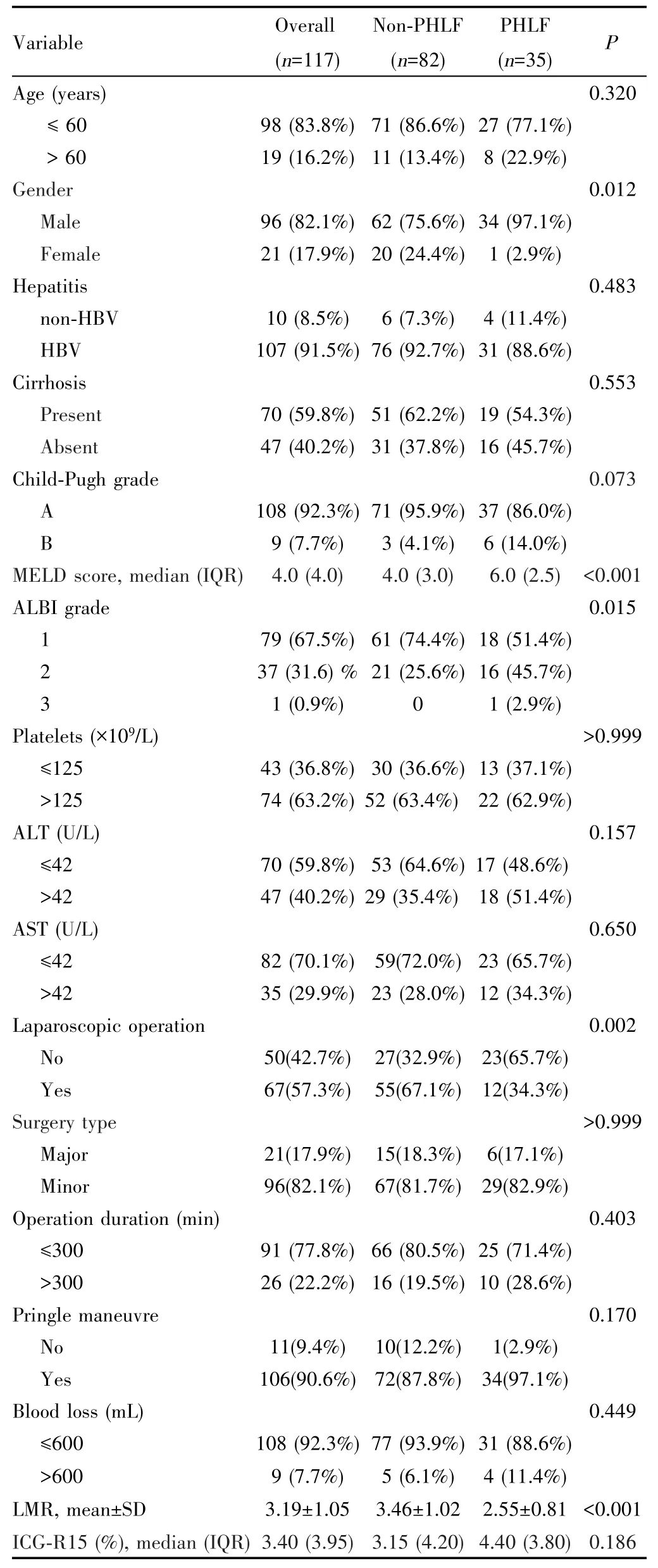
表1 入组患者基线特征Tab.1 Baseline characteristics of the patients
2.2 单因素及多因素logistic回归分析结果
单因素分析结果显示,差异有统计学意义的指标有性别、MELD评分、ALBI分级、手术方式及LMR。将其纳入多因素回归分析,结果显示MELD评分、手术方式及LMR是PHLF发生的独立预测因子(P<0.05)。其中,腹腔镜辅助下手术是PHLF发生的保护性因素,而随着MELD评分的增高或LMR值的降低,PHLF的发生风险也相应增加。见表2。
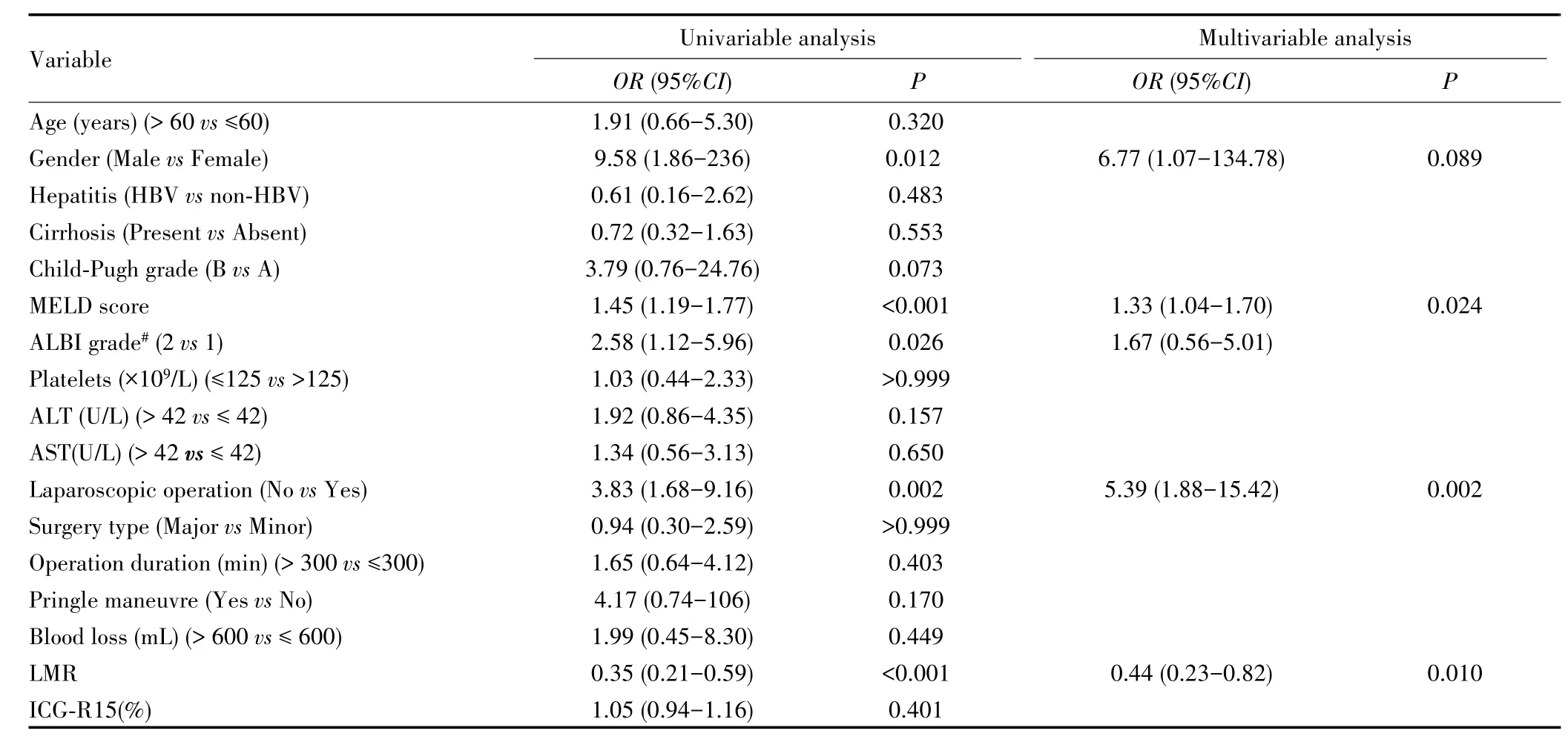
表2 预测肝脏肿瘤患者术后肝衰竭发生的临床危险因素分析Tab.2 Clinical risk factors for prediction of post⁃hepatectomy liver failure after liver tumor resection
2.3 列线图模型的构建及评价
基于多因素logistic回归分析结果,综合MELD评分、手术方式和LMR 3个独立预测因子构建列线图模型,结果如图2。模型ROC曲线下面积(AUC)为0.83(图3A)。由ROC曲线计算出模型预测PLHF的最佳截断值为-2.51,相应的灵敏度为91.4%,特异度为64.6%,准确率为72.7%。Hosmer⁃Lemeshow检验结果P=0.90,说明模型拟合良好。图3B显示列线图模型及其校正模型与理想曲线接近,说明模型的校准度较好。由列线图模型所获得的临床净效益高于在假设所有患者肝癌切除术后均发生或均未发生(“All”和“None”)PHLF两种情况下的临床净效益,显示了模型较高的临床实用性(图3C)。

图2 预测肝肿瘤切除术后肝衰竭发生的列线图模型Fig.2 A nomogram model for predicting post⁃hepatectomy liver failure after liver tumor resection
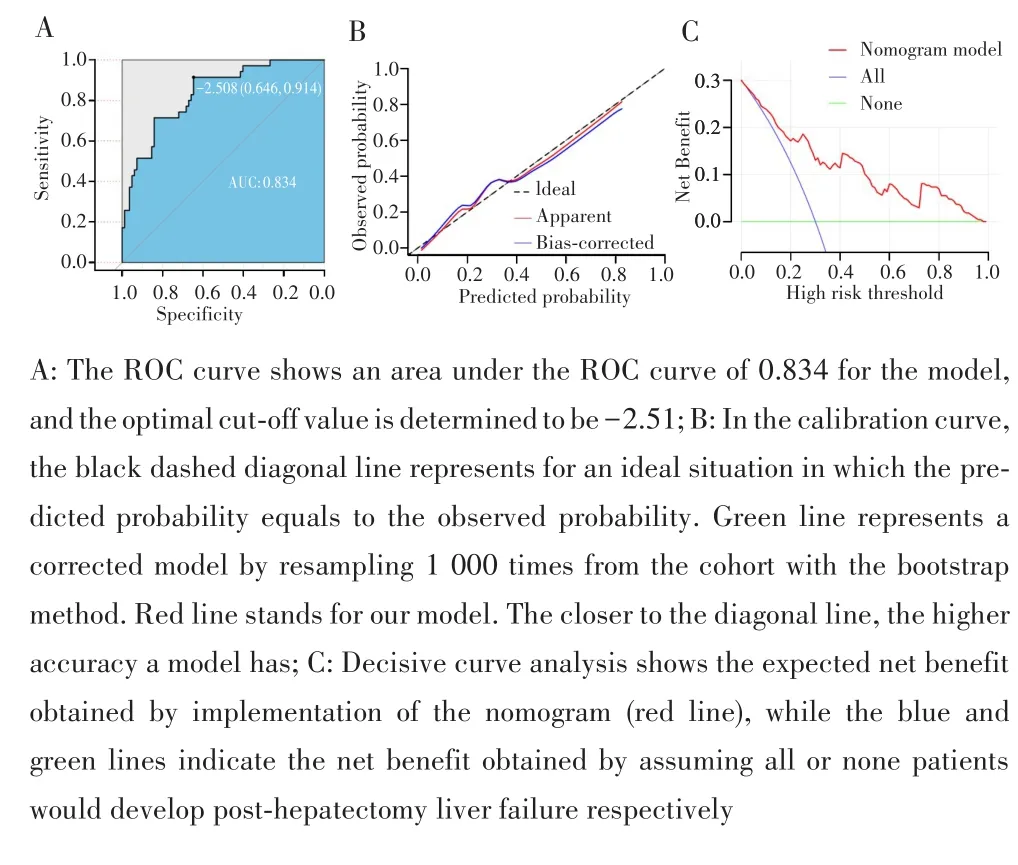
图3 列线图模型的表现Fig.3 Performance of the nomogram model
3 讨论
本研究构建了基于MELD评分、手术方式和MRI定量肝功能指标LMR的列线图模型并用于预测PHLF,其AUC高达0.83,灵敏度为91.4%,具有较好的区分度和预测效能,显示了潜在的临床应用价值。
与其他传统方法相比,Gd⁃EOB⁃DTPA增强MRI在术前定量肝功能评估中具有多重优势。不同于一般的细胞外对比剂,Gd⁃EOB⁃DTPA在静脉输注后可以被肝细胞特异性摄入,并在10~40 min后达到峰值,形成独特的肝胆期[15]。研究发现,Gd⁃EOB⁃DTPA进出肝细胞所使用的蛋白转运系统与ICG相同,均为有机阴离子转运多肽(organic anion transporting polypep⁃tide,OATP)1B1、1B3和多药耐药蛋白2(multidrug re⁃sistance protein,MRP2)系统[15,20]。理论上,Gd⁃EOB⁃DTPA与目前术前定量肝功能评估的“金标准”ICG⁃R15具有相同的效力。此外,Gd⁃EOB⁃DTPA增强MRI还可以提供空间信息,进行肝叶/段肝功能评估[15]。研究还发现,随着慢性肝病病情的发展,肝功能的下降,以及OATP1蛋白表达水平下降而MRP2表达上调,Gd⁃EOB⁃DTPA增强MRI图像上随之会表现为信号强度的降低[7],而肝功能损害程度的不同则表现为MRI信号强度的不同。此外,Gd⁃EOB⁃DTPA增强MRI检查通常在患者入院时用于肿瘤诊断和分期,因此肝功能评估可同时进行而不需要额外检查,而挖掘既有图像蕴藏的附加信息而不增加患者经济负担,也符合卫生经济学原则。
目前常用的基于MRI信号强度的肝功能定量评估指标有肝脏相对强化程度(relative liver enhance⁃ment,RLE)[21],LMR[19,22]及肝⁃脾比率(liver⁃spleen ratio,LSR)[23]等。还有基于弛豫时间的相关指标,如T1弛豫时间、T2弛豫时间等[23⁃24]。本研究选取LMR作为肝功能衡量指标主要基于以下两点考虑:⑴尽管RLE是最早、最常用的指标,但其计算需要平扫期及肝胆期两期图像,勾画两期ROI的过程有可能引入偏差,而LMR的计算只需要肝胆期图像,可以避免这种偏差。计算的便捷性也有利于所建立的模型在临床上推广、应用。⑵尽管LSR也是较为常用的指标,但是考虑到部分肝癌患者可能因为脾功能亢进等已接受脾切除术,致使LSR无法应用于该类脾脏缺如患者。因此,为了扩大模型的适用性,本研究选择了LMR。既往研究显示,LMR可以较好地衡量肝脏储备功能,与ICG检查的一致性达0.68[23]。ARAKI等[19]使用基于LMR的Gd⁃EOB⁃DTPA增强MRI指标预测PHLF,AUC为0.94。本研究的AUC低于上述模型,可能与研究对象不同有关。ARAKI的研究人群为ISGLS B级及C级(严重肝衰竭),而本研究纳入的患者包括了所有符合ISGLS标准的肝衰竭患者,相比之下,ARAKI研究的入组人群肝衰竭程度较重,在MRI上的表现可能更典型,因此预测效果较本模型好。
本研究构建的模型中纳入的另一个指标为MELD评分。MELD评分是临床上常用的评价终末期肝病患者肝脏储备功能和预后的复合评分系统[25],主要由血清肌酐、INR和总胆红素3个指标组成。与临床上常用的评分系统Child⁃Pugh评分相比,MELD评分较为客观,能最大程度减少主观性因素,可重复性较好。本研究发现Child⁃Pugh评分在两组之间无明显差异也反向佐证了这一点。既往多项研究显示MELD评分是PHLF发生的独立危险因素,使用MELD评分或与其他指标联合可用于PHLF预测[25⁃26],AUC可达0.85[10]。本研究构建的模型也表现了类似效应。
相较传统的开腹手术,腹腔镜肝切除手术具有创伤小、视野清晰、出血少、术后恢复快、术后并发症发生率低等优点,在临床中应用越来越广泛[27⁃28]。本研究超过一半的患者在腹腔镜辅助下进行肝切除,且在PHLF组中开腹手术的病例数约为腹腔镜辅助手术病例的一倍(23vs12)。在多因素回归分析中,其校正后的OR值达5.39,进一步证实了是否行腹腔镜手术是有效预测PHLF发生的独立危险因素,也证实了腹腔镜辅助下手术的优势。
ICG⁃R15目前仍然是术前定量肝功能评估的“金标准”,是决定手术切除范围的重要参考依据,指导着肝脏外科手术实践[29]。但ICG⁃R15为肝脏功能的整体性反映,不能用于局部肝脏功能评估[11],对PHLF的预测作用有限。既往多项研究显示,ICG⁃R15在PHLF组和Non⁃PHLF组之间差异无统计学意义[17⁃18,30]。本研究亦未发现 ICG⁃R15 在 PHLF 组与Non⁃PHLF组间存在统计学差异(P=0.186),后续值得继续探讨ICG⁃R15在预测PHLF中的价值。
常见的影响PHLF发生的危险因素还包括肝硬化、手术切除范围等。肝硬化是肝纤维化发展的终末阶段,此时肝脏的正常结构被严重破坏,肝脏储备功能下降,临床上常使用Child⁃Pugh、MELD或ALBI等量化评估肝脏的受损程度。但在本研究中肝硬化这一危险因素在两组间差异无统计学意义,分析原因可能是本研究样本量较少,统计效力不足;未按肝纤维化严重程度将此变量进一步分层分析。对于肝硬化是否为危险因素,既往研究的结论也不一致[31⁃34]。一般情况下,手术切除范围越大的患者术后发生肝衰竭的风险也增大。但本研究未发现该因素在组间差异有统计学意义,既往研究结果也类似[17,19]。可能是本研究仅将手术切除范围粗略划分为大范围(≥3个肝段)和小范围(<3个肝段),而未将预留剩余肝脏具体量化,从而在一定程度上减弱了检验效能。
本研究存在以下局限:⑴本研究为单中心、回顾性研究,可能存在一定选择偏倚,且由于样本量有限,未划分测试集进行内部验证。未来需要开展多中心、前瞻性、大样本研究进一步验证本模型的效度及外推性。⑵本研究仅将肝切除范围大小纳为危险因素,并未量化评估预留肝脏体积大小对PHLF发生的影响,该因素的作用仍需后续探讨。
综上所述,本研究构建的列线图预测模型纳入了基于Gd⁃EOB⁃DTPA增强MRI定量肝功能指标、基于实验室生化检查的综合评分指标以及临床指标,具有一定代表性,在预测PHLF发生中显示了较高的准确性和区分度,具有潜在的临床应用价值。
