蜂毒穴位注射对偏头痛模型大鼠PKA、PACAP及c-Jun的影响
2021-11-25杨花菊刘思婷徐峰王亚飞兰小路李泽琼王雅璇曹鑫怡
杨花菊 刘思婷 徐峰 王亚飞 兰小路 李泽琼 王雅璇 曹鑫怡
偏头痛是一种临床常见的原发性头痛,以反复发作的一侧或双侧搏动性头痛为临床特征,常伴有恶心、呕吐及畏光等表现[1]。偏头痛的发病率呈上升趋势[2],反复发作、经久难愈,给患者的生活质量造成了严重影响,世界卫生组织将严重偏头痛定为最致残的慢性疾病之一[1]。
蜂毒是蜜蜂尾针中的主要物质,经多年临床及实验研究发现,蜂毒中含有多种活性物质,主要具有镇痛、抗炎、抗菌、抗凝、抗肿瘤、降血压等作用。蜂毒肽是蜂毒中主要成分,能够提高疼痛阈值,具有较好的抗炎镇痛作用。蜂毒的临床应用多直接使用蜂针,而注射用蜂毒是经提取后的蜂毒肽等有效成分,降低了蜂毒过敏的可能性,使用更加安全、方便。目前对于蜂毒及其制品的研究多集中在治疗类风湿等骨关节疾病及癌症疼痛方面,关于治疗偏头痛以及相关机制的研究却很少。对注射用蜂毒进行偏头痛方面的治疗研究,能够明确其使用剂量、治疗机制,为临床使用蜂毒治疗偏头痛提供相关依据。本研究将注射用蜂毒冻干粉(主要成分是蜂毒肽)以穴位注射的方式用于硝酸甘油所致急性偏头痛大鼠,观察其行为学变化,并测定血浆蛋白激酶A(protein kinase A,PKA)、垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase-activating peptide,PACAP)及脑组织原癌基因c-Jun的变化,以探究蜂毒对急性偏头痛的治疗效果及可能的作用机制。
1 材料与方法
1.1 实验动物
SPF级SD雄性大鼠48只,购于斯贝福(北京)生物技术有限公司,动物合格证号:SCXK(京)2019-0010,体质量(220±30)g。适应性喂养7天,实验前禁食12小时(自由饮水)。
1.2 药物和试剂
注射用蜂毒(华北制药有限公司,规格:0.5 mg/支,批号:FFMG190301);佐米曲普坦[万特制药(海南)有限公司,规格:2.5 mg/片,批号:20200402];硝酸甘油注射液(北京益民药业有限公司,规格:1 mL∶5 mg,批号:20200601);蛋白激酶A(PKA)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(江苏酶免实业有限公司,批号:61472R2);垂体腺苷酸环化酶(PACAP)ELISA试剂盒(江苏酶免实业有限公司,批号:70626R2);c-Jun兔抗(abcam,批号:Ab40766)。
1.3 动物分组、造模与给药
将48只大鼠按随机数字表法分为6组,每组各8只,分别为正常对照组、偏头痛模型组、佐米曲普坦组、蜂毒高剂量组、蜂毒中剂量组、蜂毒低剂量组。
正常对照组皮下注射生理盐水10 mg/kg,其余各组大鼠采用后颈部皮下注射硝酸甘油注射液10 mg/kg的方法制备急性偏头痛模型,以大鼠5分钟内出现双耳变红、前肢频繁挠头、爬笼次数增加为造模成功。5分钟造模成功,然后立即开始给药。
佐米曲普坦组于两侧太冲、合谷穴注射1 mg/kg生理盐水,同时给予佐米曲普坦1 mg/kg灌胃。正常对照组与偏头痛模型组分别于两侧太冲、合谷穴注射1 mg/kg生理盐水,同时给予佐米曲普坦组同等容量的生理盐水灌胃。蜂毒高、中、低剂量组分别于两侧太冲、合谷穴分别注射0.1 mg/kg、0.05 mg/kg、0.025 mg/kg蜂毒,同时给予佐米曲普坦组同等容量的生理盐水灌胃。蜂毒剂量设计参考徐淑云《药理实验方法学》[3],并结合预实验结果。
1.4 行为学观察
注射硝酸甘油偏头痛大鼠造模后观察并记录:(1)每组大鼠耳红出现及消失时间;(2)每组大鼠爬笼、挠头次数:以30分钟为时间段,观察并记录0~30分钟、30~60分钟、60~90分钟、90~120分钟4个时间段大鼠爬笼、挠头次数。
1.5 取材
分别在造模后的2小时、4小时两个时间点,给各组大鼠腹部酒精消毒,腹腔注射10%水合氯醛溶液0.4 mL/100g麻醉,备皮切开腹部皮肤,寻找并分离腹主动脉。用一次性采血针从腹主动脉取全血5 mL,离心10分钟(离心机设置为4℃,3 000 r/min),取上清液(血浆)分装保存于-80℃冰箱中备用。
在造模后的4小时,大鼠取血完成后将其断头处死,取出全脑,将脑组织放入0.9%生理盐水洗去血渍,吸干多余水分,保存于-80℃冰箱中备用。
1.6 指标检测
1.6.1 ELISA试剂盒测定血浆PACAP、PKA水平 设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;在待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL;然后每孔加入酶标试剂100 μL,空白孔除外;用封板膜封板后置37℃温育60分钟,之后揭膜弃液甩干;再加洗涤液静置30秒后弃去拍干,重复5次;然后加入显色剂A、B混匀,37℃避光显色15分钟;每孔加终止液50 μL,在15分钟内,以空白孔调零,450 nm波长依序测量各孔的吸光度(optical density, OD)值。依据测得的各样品OD值通过曲线回归方程算出其浓度。
1.6.2 蛋白质印迹法定量检测c-Jun的表达 从冰箱取出脑组织,称重、匀碎,加入蛋白裂解液4℃裂解30分钟,离心15分钟(离心机设置为4℃,13 000 r/min),吸取上清液,利用二辛可酸(bicinchoninic acid, BCA)蛋白定量法对样品蛋白含量进行测定;配制十二烷基硫酸钠聚丙烯酰胺凝胶,将样品蛋白加入凝胶孔道中进行蛋白电泳,至溴酚蓝跑出为止;然后取出凝胶转膜2小时,使蛋白转移至PVDF膜上形成印迹;将膜置于封闭液中,室温摇动封闭2小时;将膜按蛋白印迹位置剪开,置于对应一抗中,4℃摇动过夜,然后置于TBST溶液中漂洗5分钟;再将膜置于对应二抗中,室温作用1.5小时,再次漂洗5分钟;之后将膜置于显色剂中30秒后立即曝光1分钟,然后行显影、定影。胶片用Tanon凝胶成像及分析系统进行摄像、分析,每个样品的c-Jun条带亮度值与对应β-actin(内参)条带亮度值的比值,得到校正后c-Jun 条带亮度值。
1.6 统计学方法

2 结果
2.1 蜂毒对偏头痛大鼠症状的影响
2.1.1 耳红开始及消失时间 正常对照组大鼠未出现耳红症状,其它各组大鼠在模型复制后3~5分钟内均出现耳红。与偏头痛模型组相比,各药物干预组耳红开始时间无统计学意义(P>0.05)。与偏头痛模型组相比,佐米曲普坦组、蜂毒中、高剂量组耳红消失时间均有显著缩短(P<0.01);蜂毒低剂量组相比上述3组耳红消失时间缩短较少,但与模型组比仍有统计学意义(P<0.05)。与佐米曲普坦组相比,蜂毒低、中、高三个剂量组耳红消失时间与之相比均有明显延长,差异具有统计学意义(P<0.01)。结果见表1。
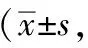
表1 各组偏头痛大鼠耳红开始及消失的时间分钟)
2.1.2 挠头次数 在0~120分钟四个时间段内,正常对照组挠头次数变化不大,只有偶尔几次;与正常对照组比较,偏头痛模型组各个时间段的挠头次数均明显增加(P<0.01)。
在0~30分钟与90~120分钟两个时间段内,与偏头痛模型组相比,佐米曲普坦组、蜂毒低、中、高剂量组的挠头次数均有明显减少,差异有统计学意义(P<0.01)。
在30~60分钟与60~90分钟两个时间段内,与偏头痛模型组相比,佐米曲普坦组、蜂毒中、高剂量组挠头次数显著减少(P<0.01);蜂毒低剂量组相对减少较少,但与模型组比较仍有统计学意义(P<0.05)。
与佐米曲普坦组相比,在0~30分钟、30~60分钟两个时间段内,蜂毒高剂量组的挠头次数与之相比,差异不具有统计学意义(P>0.05)。而在60~90分钟、90~120分钟两个时间段内,与佐米曲普坦组相比,蜂毒各剂量组的挠头次数明显增多,差异具有统计学意义(P<0.05)。结果见表2。
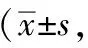
表2 各组偏头痛大鼠各时间段挠头次数比较次)
2.1.2 爬笼次数 在0~120分钟四个时间段内,正常对照组爬笼次数变化不大,只有偶尔几次;与正常对照组比较,偏头痛模型组各个时间段的爬笼次数均明显增加(P<0.01)。
在0~30分钟时间段内,与偏头痛模型组相比,佐米曲普坦组、蜂毒低、中、高剂量组的爬笼次数均明显减少(P<0.01)。其余三个时间段内,与偏头痛模型组相比较,佐米曲普坦组、蜂毒中、高剂量组爬笼次数显著减少(P<0.01)。
与佐米曲普坦组相比,在30~60分钟、60~90分钟两个时间段内,蜂毒中、高剂量组爬笼次数差异不具有统计学意义(P>0.05);蜂毒低剂量组与之相比明显增加(P<0.01)。在0~30分钟、90~120分钟两个时间段内,蜂毒各剂量组的爬笼次数与之相比均显著增加(P<0.01)。结果见表3。
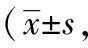
表3 各组偏头痛大鼠各时间段爬笼次数比较次)
2.2 蜂毒对偏头痛大鼠血浆PKA、PACAP及脑部c-Jun的影响
2.2.1 蜂毒对偏头痛大鼠血浆PKA的影响 与正常对照组相比,偏头痛模型组2小时与4小时的血浆PKA含量增高明显(P<0.01)。与偏头痛模型组相比,各给药组2小时与4小时的血浆PKA含量明显减少(P<0.01)。与佐米曲普坦组相比,蜂毒高剂量组2小时和4小时的血浆PKA含量差异不具有统计学意义(P>0.05);蜂毒中低剂量组与之相比明显升高(P<0.01)。结果见表4。

表4 各组偏头痛大鼠血浆PKA含量比较
2.2.2 蜂毒对偏头痛大鼠血浆PACAP的影响 与正常对照组相比,偏头痛模型组2小时与4小时的血浆PACAP含量增高明显(P<0.01)。与偏头痛模型组相比,佐米曲普坦组和蜂毒高剂量组2小时和4小时及蜂毒中剂量组2小时的血浆PACAP含量均有明显减少(P<0.01)。与佐米曲普坦组相比,蜂毒高剂量组2小时的血浆PACAP含量变化不大,无统计学意义(P>0.05)。蜂毒中、低剂量组2小时、4小时和蜂毒高剂量组4小时的血浆PACAP含量明显增多(P<0.01)。结果见表5。

表5 各组偏头痛大鼠血浆PACAP含量比较
2.2.3 蜂毒对偏头痛大鼠脑组织c-Jun表达的影响 与正常对照组比较,偏头痛模型组c-Jun蛋白表达明显上调。与偏头痛模型组比较,佐米曲普坦组、蜂毒中、高剂量组的c-Jun蛋白表达均明显下降,差异有统计学意义(P<0.01)。与佐米曲普坦组相比,蜂毒低、中剂量组的c-Jun蛋白表达上升明显,而蜂毒高剂量组的c-Jun蛋白表达下降明显,差异均具有统计学意义(P<0.01)。结果见表6、图1。

表6 各组偏头痛大鼠脑组织c-Jun蛋白表达情况比较

注:A 正常对照组;B 偏头痛模型组; C 佐米曲普坦组;D 蜂毒低剂量组; E 蜂毒中剂量组;F 蜂毒高剂量组。
3 讨论
硝酸甘油在体内可以直接转换为一氧化氮,而一氧化氮可以导致颅内血管的扩张,从而刺激三叉神经系统释放神经肽类物质,触发神经源性炎症,参与偏头痛的发生[4]。硝酸甘油偏头痛模型的病理生理过程与人类偏头痛发作时极为相似,其病理及生化数据稳定,而且造模方法简单、经济、适用性强,是经典的偏头痛实验模型[5]。本次实验结果可以看出,蜂毒能够有效加快偏头痛大鼠耳红消失、减少挠头和爬笼次数,从行为学上明显减轻了大鼠偏头痛发作时的疼痛。
穴位注射法[6]是以经络学说为依据,将针刺经络穴位和药物有机结合,产生机械刺激和化学刺激,兼具速效和长效双重作用,具有简单、方便、效果显著等特点。四关穴包括合谷穴和太冲穴,左右共4个穴位,是临床经常用到的治疗疼痛疾病的对穴之一。合谷穴具有调和气血、祛风解表、通络止痛等作用,对头面五官诸疾均有良好疗效。现代实验研究也证实了针刺合谷穴有很好的镇痛作用。有研究[7]显示,针刺合谷穴可以提高体内β-内啡肽含量,降低P物质含量,使二者之间保持平衡,从而起到镇痛效果。太冲穴具有疏肝理气、活血散瘀、通络止痛等作用,主要治疗头痛、眩晕等肝胆以及神志相关疾病。杨宗保[8]通过针刺太冲透刺涌泉的方法,能够有效地减轻偏头痛发作时的疼痛及其它相关症状。合谷、太冲两穴合用,具有祛风解表、行气活血、养阴平肝、通络止痛等作用。有研究[9]表明,针刺四关穴可以明显降低患者疼痛视觉模拟量表评分,减少偏头痛发作次数。故而本次实验选取四关穴作为注射穴位。
PACAP是一种神经多效生物活性肽,广泛分布在中枢及外周神经系统中[10],参与许多与偏头痛相关的机制通路。PKA是环腺苷3′,5′-磷酸(cyclic adenosine monophosphate,cAMP)依赖性蛋白激酶的一种。cAMP是参与细胞功能调节的第二信使,是细胞内传递激素和递质的中介因子。cAMP反应元件结合蛋白(cAMP-responsive element binding protein,CREB)是一种转录因子,存在于细胞核上,在脑内所有细胞内均有表达。CREB可以通过激活靶基因,如c-Fos、降钙素基因相关肽等,促使中枢敏化,从而参与偏头痛的发生[11]。c-Jun是与c-Fos相伴的一个原癌基因,是一种转录调节因子。在一般情况下,c-Jun在体内很少表达,但在接收到伤害性刺激信号后,可以立即启动基因的复制、转录以及表达。在痛觉的传递通道中,c-Jun对疼痛的调控有着非常重要的作用,凡是能够引起痛觉的刺激均可以提高c-Jun的表达[12]。
PACAP可以通过G-蛋白耦联受体发挥生物学效应,激活腺苷酸环化酶(adenyl cyclase, AC)[13],AC的激活可以提高靶细胞cAMP的水平,从而激活cAMP依赖的PKA[14-15],增加CREB在脑内的表达,诱导c-Jun基因转录mRNA在胞浆内翻译合成Jun蛋白[16]。PACAP、PKA和c-Jun之间可以形成信号传导通路:PACAP→AC→cAMP-PKA-CREB→c-Jun,所以选择c-Jun作为本次研究的检测指标。
蜂毒肽皮下注射后,可以通过降低交感神经的血管紧张度,减少脊骨内PKA的激活,减轻痛觉增敏和机械超敏等反应,从而起到镇痛的作用[17]。蜂毒肽还能够刺激垂体―肾上腺―下丘脑系统释放更多的皮质激素和抗炎因子等抑制性神经递质,同时降低c-Jun受体在脊髓中的含量,提高人体疼痛阈值,从而产生抗炎镇痛作用,缓解偏头痛发作症状[18]。本次实验结果表明,蜂毒可以降低大鼠血浆中PKA、PACAP含量和脑组织c-Jun蛋白表达,尤以蜂毒高剂量组更为明显。
曲坦类药属于高选择性5-羟色胺受体激动剂,具有起效快、安全性高等特点[19],在偏头痛发作期越早应用效果越好,是偏头痛发作期治疗的一线药物。本次实验中,高剂量的蜂毒与佐米曲普坦相比,在0~60分钟的挠头次数、30~90分钟的爬笼次数、PACAP 2小时含量、PKA 2小时和4小时的含量差异不明显,说明高剂量的蜂毒与佐米曲普坦疗效具有可比性,而且高剂量的蜂毒较佐米曲普坦更能够降低c-Jun含量。本次实验结果表明,蜂毒治疗偏头痛疗效明显,且达到其剂量效应后的效果并不弱于偏头痛特异性治疗药物。
从本次研究结果推断蜂毒治疗偏头痛可能是通过以下机制:蜂毒进入大鼠体内后,其中的多肽类成分能够降低毛细血管的通透性,抑制了可能引起各种炎症因子释放的通道,使大鼠体内的PACAP含量减少,则G蛋白偶联受体活化减少,亦使AC活化减少,从而抑制cAMP的表达,降低PKA含量,再通过cAMP-PKA-CREB信号通路[20],抑制c-Jun基因或蛋白在神经系统的表达,从而减少了偏头痛的诱发及刺激因素,降低偏头痛的发生机率,缓解偏头痛发作时的症状。
声明本文章作者单位、本课题组所有成员承诺本研究不涉及利益冲突。
